
- •Контрольні завдання
- •§ 1. Розділ 1 механіка
- •§ 1. Кінематика матеріальної точки
- •§ 2. Динаміка матеріальної точки. Закони ньютона
- •§ 3. Робота, потужність, енергія
- •§ 4. Сили в механіці і сили інерції.
- •§ 5. Динаміка обертального руху твердого тіла.
- •Умови рівноваги твердого тіла
- •§ 6. Гравітація. Елементи теорії поля.
- •Напруженість гравітаційного поля тіла масою
- •§ 7. Механіка рідин 1 газів
- •§ 8. Елементи спеціальної теорії відносності
- •§ 12, 13. Основи молекулярно-кінетичної теорії речовини. Статистичні розподіли та явища переносу в газах
- •§ 14. Перше начало термодинаміки
- •§ 15. Друге начало термодинаміки
- •§ 16. Реальні гази 1 рідини
- •§ 17. Теплові властивості твердих тіл. Фазові переходи
- •§ 18. Електричне поле
- •§ 19. Електричне поле в речовині
- •§ 20. Постійний електричний струм
- •Правила Кірхгофа для розгалужених кіл
- •§ 21. Електричний струм у металах, вакуумі та газах
- •§ 22. Постійне магнітне поле
- •§ 23. Електромагнітна індукція
- •§ 25. Магнітне поле в речовині
- •1. Вільні коливання в контурах
- •2. Вимушені коливання в контурах
- •Тема 27. Геометрична оптика.
- •§ 28. Інтерференція світла
- •§ 29. Дифракція світла
- •§ 30. Поляризація світла. Розсіяння, поглинання, дисперсія світла
- •§ 33. Хвильові властивості речовини
- •§ 34. Будова атомів і молекул
- •§ 35. Квантові явища в твердих тілах
- •§ 38. Основні характеристики атомного ядра
- •§ 39. Радіоактивність
- •Тема 9. Вільні гармонічні коливання.
- •Тема 10. Згасаючі та вимушені коливання.
- •Тема 11. Хвильові процеси. Акустика.
- •Тема 12. Основи молекулярно-кінетичної теорії'.
- •Тема 13. Статистичні розподіли та явища переносу в газах.
- •Тема 14. Перше начало термодинаміки.
- •Тема 19. Електростатичне поле в речовині.
- •Тема 20. Закони постійного струму.
- •Тема 22. Магнітне поле.
- •Тема 27. Геометрична оптика.
- •Тема 28. Інтерференція світла.
- •Тема 29. Дифракція світла.
- •Тема 31. Теплове випромінювання.
- •Тема 32. Квантова оптика.
- •Тема 33. Елементи квантової механіки.
§ 12, 13. Основи молекулярно-кінетичної теорії речовини. Статистичні розподіли та явища переносу в газах
Атомна
одиниця маси
![]() кг. Відносна
молекулярна маса, або відносна маса
молекули
кг. Відносна
молекулярна маса, або відносна маса
молекули
![]() , (1.145)
, (1.145)
де
![]() — абсолютне значення маси молекули,
кг.
— абсолютне значення маси молекули,
кг.
Відносна молекулярна маса речовини
![]() , (1.146)
, (1.146)
де
![]() —
кількість атомів
—
кількість атомів
![]() хімічного елемента, що входить до складу
молекули даної речовини;
хімічного елемента, що входить до складу
молекули даної речовини;
![]() —
відносна атомна маса цього елемента
(відносні атомні маси наведено в таблиці
Менделєєва).
—
відносна атомна маса цього елемента
(відносні атомні маси наведено в таблиці
Менделєєва).
В
одному молі довільної речовини міститься
однакова кількість структурних елементів
(стала Авогадро):
![]() == 6,02 . 1023
моль-1.
== 6,02 . 1023
моль-1.
Молярна
маса
![]() (кг/моль). Кількість молів речовини
(кг/моль). Кількість молів речовини
![]() , (1.147)
, (1.147)
де
![]() — кількість структурних елементів
(молекул) речовини,
— кількість структурних елементів
(молекул) речовини,
![]() — маса речовини.
— маса речовини.
Кількість молів суміші речовин
![]() .
.
Основне рівняння кінетичної теорії газів
![]() , (1.148)
, (1.148)
де
![]() —тиск газу;
—тиск газу;
![]() — концентрація
молекул;
— концентрація
молекул;
![]() — середня кінетична енергія поступального
руху молекули.
— середня кінетична енергія поступального
руху молекули.
Середня енергія молекули
![]() , (1.149)
, (1.149)
де
![]() Дж/К — стала Больцмана;
Дж/К — стала Больцмана;
![]() — термодинамічна
температура газу.
— термодинамічна
температура газу.
Залежність тиску газу від концентрації молекул і температури
![]() . (1.150)
. (1.150)
Рівняння стану ідеального газу (рівняння Менделєєва — Клапейрона)
![]() , (1.151)
, (1.151)
де
![]() =8,31 Дж/(моль•К) — універсальна газова
стала.
=8,31 Дж/(моль•К) — універсальна газова
стала.
Тиск суміші газів (закон Дальтона)
![]() , (1.152)
, (1.152)
![]() — парціальний
тиск
— парціальний
тиск
![]() -ї
компоненти суміші;
-ї
компоненти суміші;
![]() — число
компонентів.
— число
компонентів.
Молярна маса суміші газів
![]() , (1.153)
, (1.153)
де
![]() — маса
— маса
![]() компоненти суміші;
компоненти суміші;
![]() — кількість молів
— кількість молів
![]() -ї
компоненти
-ї
компоненти
суміші.
Середня квадратична, середня арифметична і найбільш імовірна швидкості молекул
![]() .
(1.154)
.
(1.154)
Розподіл Максвелла
 ,
,
або
![]() , (1.155)
, (1.155)
де
![]() — кількість
молекул, швидкості яких лежать в
інтервалі від
— кількість
молекул, швидкості яких лежать в
інтервалі від
![]() до
до
![]() ;
;
![]() —
загальна кількість молекул;
—
загальна кількість молекул;
![]() — відносна
швидкість молекул.
— відносна
швидкість молекул.
Барометрична формула
![]() , (1.156)
, (1.156)
де
![]() і
і
![]() — тиск газу
відповідно на висоті
— тиск газу
відповідно на висоті
![]() і
і
![]() .
.
Розподіл Больцмана
![]() , (1.157)
, (1.157)
де
![]() — різниця
потенціальних енергій частинок (молекул)
на двох рівнях довільного потенціального
поля,
— різниця
потенціальних енергій частинок (молекул)
на двох рівнях довільного потенціального
поля,
![]() і
і
![]() — концентрації
частинок (молекул) на цих рівнях.
— концентрації
частинок (молекул) на цих рівнях.
Розподіл Максвелла — Больцмана
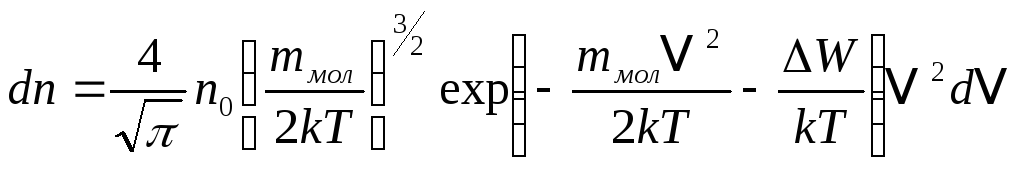 Середня
довжина вільного пробігу молекул газу
Середня
довжина вільного пробігу молекул газу
![]() , (1.158)
, (1.158)
де
![]() — концентрація молекул,
— концентрація молекул,
![]() — ефективний діаметр молекули.
— ефективний діаметр молекули.
Середня кількість зіткнень однієї молекули за одиницю часу
![]() . (1.159)
. (1.159)
Кількість зіткнень усіх молекул в одиниці об'єму за одиницю часу
![]() . (1.160)
. (1.160)
Середнє число ударів молекул за одиницю часу об одиничну плоску поверхню, розміщену в газі,
![]() . (1.161)
. (1.161)
Маса
газу
![]() ,
перенесеного під час дифузії за час
,
перенесеного під час дифузії за час
![]() через плоску поверхню
через плоску поверхню
![]() ,
розміщену перпендикулярно до осі
,
розміщену перпендикулярно до осі
![]() ,
при градієнті густини вздовж цієї осі
,
при градієнті густини вздовж цієї осі
![]() (закон Фіка),
(закон Фіка),
![]() , (1.162)
, (1.162)
де
![]() — коефіцієнт дифузії. (1.162. а)
— коефіцієнт дифузії. (1.162. а)
Сила
внутрішнього тертя
![]() між двома шарами газу площею
між двома шарами газу площею
![]() ,
що рухаються з різними швидкостями
(закон Ньютона),
,
що рухаються з різними швидкостями
(закон Ньютона),
![]() , (1.163)
, (1.163)
де
![]() — градієнт швидкості течії газу в
перпендикулярному до
— градієнт швидкості течії газу в
перпендикулярному до
![]() напрямі. Знак «мінус» означає, що сила
тертя, яка діє на більш швидкі шари
газу, напрямлена проти швидкості;
напрямі. Знак «мінус» означає, що сила
тертя, яка діє на більш швидкі шари
газу, напрямлена проти швидкості;
![]() — коефіцієнт динамічної в’язкості.
(1.163.а)
— коефіцієнт динамічної в’язкості.
(1.163.а)
Кількість
теплоти, яка переноситься внаслідок
теплопровідності за час
![]() через плоску поверхню
через плоску поверхню
![]() при градієнті температури
при градієнті температури
![]() ,
перпендикулярному до
,
перпендикулярному до
![]() ,
,
![]() , (1.164)
, (1.164)
де
![]() — коефіцієнт теплопровідності;
(1. 164.а)
— коефіцієнт теплопровідності;
(1. 164.а)
![]() — питома
теплоємність газу при сталому об'ємі.
— питома
теплоємність газу при сталому об'ємі.
