
- •Общие методические указания
- •Требования к знаниям и умениям по дисциплине.
- •Распределение часов учебного плана по формам обучения и видам занятий
- •1.1. Вывод химической формулы вещества по его количественному составу
- •1.2. Расчеты по химическим уравнениям
- •1 Моль hCl – 1 моль nh4Cl
- •0,2 Моль hCl – х моль nh4Cl
- •2. Моль. Закон Авогадро. Мольный объем
- •1 Моль занимает объем 22,4 л
- •3. Классы неорганических соединений
- •4. Составление уравнений окислительно-восстановительных реакций по методу электронного баланса
- •5. Направление окислительно-восстановительных процессов
- •6. Гальванические элементы
- •7. Коррозия
- •8. Электрохимические процессы при электролизе
- •9. Комбинированные задачи
- •Варианты контрольных работ
Требования к знаниям и умениям по дисциплине.
После изучения дисциплины студент должен иметь целостное представление о процессах и явлениях, происходящих в неживой и живой природе, понимать возможность современных научных методов познания природы и владеть ими на уровне, необходимом для решения задач, имеющих естественнонаучное содержание и возникающие при выполнении профессиональных функций.
Иметь представление:
- об основных химических процессах и системах;
- о взаимосвязи между свойствами химической системы, природой веществ и их реакционной способностью;
- о методах химической идентификации и определения веществ.
Требования к минимуму содержания дисциплины.
Химические системы: растворы, дисперсные системы, электрохимические системы, катализаторы и каталитические системы, полимеры и олигомеры;
химическая термодинамика и кинетика: энергетика химических процессов, химическое и фазовое равновесие, скорость реакции и методы ее регулирования, колебательные реакции;
реакционная способность веществ: химия и периодическая система элементов, кислотно-основные и окислительно-восстановительные свойства веществ, химическая связь, комплементарность, свойства металлов и их соединений;
химическая идентификация: качественный и количественный анализ, аналитический сигнал, химический, физико-химический и физический анализ.
Распределение часов учебного плана по формам обучения и видам занятий
|
Виды занятий |
Заочное обучение |
|
|
1 семестр |
|
Количество занятий |
|
|
Лекции |
10 |
|
Лабораторные занятия |
12 |
|
Самостоятельная работа |
78 |
|
Всего |
100 |
|
Итоговый контроль (зачеты, экзамены) |
Экзамен, 2 к.р. |
1.1. Вывод химической формулы вещества по его количественному составу
Для того чтобы вывести простейшую химическую формулу вещества, необходимо знать весовой состав и атомные массы образующих его элементов.
Пример 1. В состав сульфата натрия входят: Na – 32,43 %, S – 22,55 %, О – 45,02 %. Вывести простейшую формулу вещества.
Решение. Расчет удобно делать в виде таблицы:
|
Элемент |
Процентный состав |
Весовой состав, г |
Молярные массы атомов |
Состав вещества (моль атомов) |
Наименьшие целые числа, представляющие собой отношение количества вещества, а следовательно, и атомов в молекуле вещества |
Химическая формула |
|
Na |
32,43 |
32,43 |
23 |
|
2 |
Na2SO4 |
|
S |
22,55 |
22,55 |
32 |
|
1 |
|
|
O |
45,02 |
45,02 |
16 |
|
4 |
Для того чтобы было легче подобрать целые числа грамм-атомов, дробные значения нужно разделить на наименьшее из них:
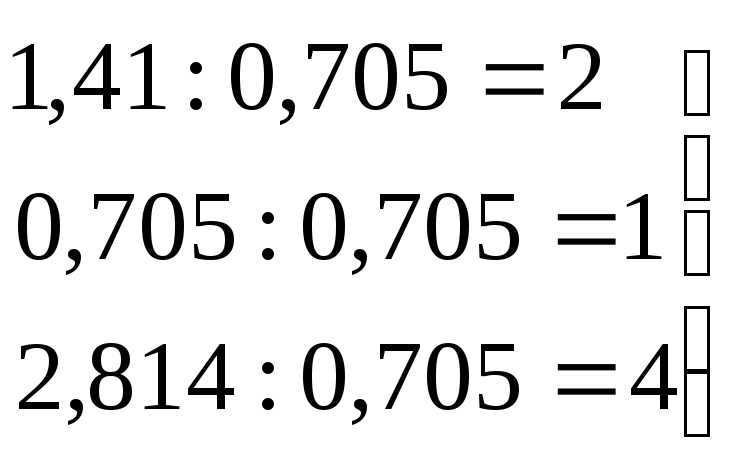 Na2SO4
Na2SO4
Расчет химической формулы по схеме, представленной в приведенной таблице, можно вести и в углеродных единицах.
Если известна молекулярная масса вещества и содержание отдельных элементов (в %), нетрудно установить его химическую формулу.
Пример 2. Ацетилен имеет состав: 92,3 % С и 7,7 % Н. 1 литр ацетилена весит 1,17 г (н.у.)
Решение:
Плотность ацетилена по водороду
DH=1,17:0,09=13.
Молекулярный вес газа по формуле M=2D
равен 26 у.е. Из этого количества 92,3 %
приходится на долю углерода, что
составляет
![]() 24
у.е. На долю водорода приходится 26 у.е.–24
у.е.=2 у.е.; 24 у.е. углерода – это вес двух
атомов С; 2 у.е. – это вес двух атомов Н.
Следовательно, молекулярная формула
ацетилена – С2Н2.
24
у.е. На долю водорода приходится 26 у.е.–24
у.е.=2 у.е.; 24 у.е. углерода – это вес двух
атомов С; 2 у.е. – это вес двух атомов Н.
Следовательно, молекулярная формула
ацетилена – С2Н2.
Задачи
1. Формалин (формальдегид), уксусная и молочная кислоты, а также глюкоза имеют одинаковый состав: 40,01 % С, 6,66 % Н и 53,33 % О. Молекулярные массы этих веществ соответственно равны: 30, 60, 90 и 180 у.е. Вывести их молекулярные формулы.
2. Красящее вещество крови – гематин – содержит 64,6 % С; 5,2 % Н; 12,6 % О; 8,8 % N и 8,8 % Fe. Молекулярная масса указанного вещества 633. Вывести формулу гематина.
3. 1 литр паров фосгена весит4,42 г (н.у.). Фосген содержит 12,13 % C; 16,17 % О и 71,70 % Сl. Вывести его формулу.
4. 1 литр паров некоторого вещества при нормальном давлении и температуре 8000С весит 1,523 г. Процентный состав вещества: Al – 20.2 % и Cl – 79,8 %. Вывести формулу вещества.
5. Вещество содержит (по массе) 26,53 % калия, 35,37 % хрома и 38,10 % кислорода. Найти его простейшую формулу.
6. Найти формулу кристаллогидрата хлорида бария, зная, что 36,6 г соли при прокаливании теряют в массе 5,4 г.
7.Найти молекулярную формулу масляной кислоты, содержащей (по массе) 54,5 % углерода, 36,4 % кислорода и 9,1 % водорода, зная, что плотность ее паров по водороду равна 44.
8. Найти молекулярную формулу вещества, содержащего (по массе) 93,75 % углерода и 6,25 % водорода, если плотность этого вещества по воздуху равна 4,41.
9. При сгорании 4,3 г углеводорода образовалось 13,2 г СО2. Плотность пара углеводорода по водороду равна 43. Вывести молекулярную формулу вещества.
10. При полном сгорании навески органического бромсодержащего вещества массой 1,88 г получено 0,88 г СО2 и 0,3 г Н2О. После превращения всего брома, содержащегося в навеске, в бромид серебра, получено 3,76 г AgBr. Плотность паров вещества по водороду равна 94. Определить молекулярную формулу исследуемого вещества.
11. При взрыве смеси, полученной из одного объема некоторого газа и двух объемов кислорода, образуются два объема СО2 и один объем N2. Найти молекулярную формулу газа.
12. Найти молекулярную формулу соединения бора с водородом, если масса 1 литра этого газа равна массе 1 литра азота, а содержание бора в веществе составляет 78,2 % (масс.)
13. Вещество содержит азот (массовая доля 82,36 %) и водород. Молекулярная масса его равна 17 г/моль. Найдите молекулярную формулу этого вещества.
14. Молекулярная масса вещества 34. Состав вещества: 5,9 % Н; 94,1 % О. Установите его молекулярную формулу.
15. Газообразное вещество содержит 85,7 % углерода и 14,3 % водорода. Плотность этого вещества по водороду равна 14. Какова молекулярная формула вещества?
