
- •6)Конвективный теплообмен. Факторы, влияющие на конвективный теплообмен.
- •7)Газовые смеси. Способы их задания.
- •8. Холодильный цикл - термодинамический цикл, осуществляемый системой, которая передает тепло от тела с низкой температурой к телу с высокой температурой.
- •9) Калорические параметры состояния, их свойства. Калорическое уравнение состояния.
- •10. Основные элементы котельной установки, их значение.
- •11) Аналитическое выражение 1 закона термодинамики. В каком случае теплота, работа и изменение внутренней энергии считаются положительными. А когда – отрицательными.
- •12) Виды топлива, используемого в котельных установках. Основная характеристика топлив, их различие по содержанию золы и влаги. Условное топливо.
- •13) Классификация термодинамических процессов и их применение в термодинамических процессах. Цель анализа термодинамических процессов.
- •14)Основной закон теплопроводности (Закон Фурье)
- •15)Баланс тепловых потоков для термодинамических процессов (адиабатного, изотермического, изохорного) в соответствии с 1 законом термодинамики
- •16.Истечение. Газов.
- •Процессы
- •Применение
- •Обратный цикл Ренкина
- •31. Раб. Тело, его назначение. Преимущества исп-я газообразных продуктов сгорания перед водяным паром.
- •32. Котельный агрегат и его элементы
- •Двигатель внутреннего сгорания - это устройство, в котором химическая энергия топлива превращается в полезную механическую работу. Циклы работы поршневых двс
- •38. Теплопроводность через плоскую стенку.
- •39. Отличие теоретического цикла двс от действительного.
- •41. Круговые процессы( циклы). Теоретический цикл холодильной машины (обратный цикл Карно).
- •45 Теплопроводимость через цилиндрическую однослойную стенку
- •46. Теплопередача, коэффициент теплопередачи.
- •46. Теплопередача, коэффициент теплопередачи.
- •47. Коэффициент теплоотдачи от рабочего тела к стенке.
- •49. Энтальпия.
- •51. В учебнике стр 213-214.
15)Баланс тепловых потоков для термодинамических процессов (адиабатного, изотермического, изохорного) в соответствии с 1 законом термодинамики
Для адиабатного
процесса^ dq = 0, dU = CvdT, L=
Для изотермического процесса: t = const, dU = CvdT = 0, dq = dL, L = RT ln(V2/V1)
dq- теплота процесса; dL – изменение работы; dU- изменение внутренней энергии;
Для изохорного процесса: dq = dU, dL = 0, dU = CvdT
Для изобарного
процесса: dU = CvdT; L= ;dq=dh=CpdT;
;dq=dh=CpdT;
16.Истечение. Газов.
Истечение . газов следует тем же основным законам, что и Истечение . жидкостей; но в случае газов мы имеем дело с веществом, объем и плотность которого зависят от давления, поэтому нельзя, как в случае жидкостей, считать среду несжимаемой. И. всегда происходит под влиянием разности давления, а следовательно, истекающая струя газа, попадающая в среду с меньшим давлением, занимает больший объем, расширяется. Расширение же газа всегда сопровождается охлаждением его, охлаждение же зовет за собой опять изменения в объеме, плотности и давлении. Ввиду этого решение общих задач об И. газов представляет вопрос весьма сложный и одну из самых трудных глав аэродинамики — науки о движениях газов; полное рассмотрение вопросов И. газов должно было бы вестись не только на основании принципов гидродинамики, но и на основании механической теории тепла и кинетической теории газов. Если пренебречь охлаждением газа от расширения и действием силы тяжести, то для скорости V истечения газа, под влиянием одной разности давления, получим формулу, аналогичную формуле (2):
|
|
(12.) |
где a — постоянная Мариоттова зак. (см. Газы), p0, q0 и ω0 — давление, сечение и плотность для сосуда, из которого истекает газ, p1, q1 и ω1 — те же величины для места наименьшего сечения струи. Более простое выражение для V получим из формулы Торричелли, применив ее к газам:
|
|
(13.) |
При И. газов в виде струи наблюдается то же основное явление сжатия струи, что и при И. жидкостей. Его легко заметить, если наблюдать И. струи окрашенного газа или табачного дыма. Замечательно, что коэффициент сжатия струи (K) для газов весьма близок по величине к тому же коэффициенту для жидкостей. Так, по Вейсбаху, величины K:
При течении по трубам законы И. для газов те же, что и для жидкостей; скорость И. замедляется и выражается уже формулой
|
|
(14.) |
где
d
— диаметр трубки, l
— длина трубки, а
![]() —
величина, характеризующая трение воздуха
о стенки трубки. По Вейсбаху,
—
величина, характеризующая трение воздуха
о стенки трубки. По Вейсбаху,
![]() для
стекла равно 0,02197, а по Д'Обюисону для
металлических труб — 0,0238. Этот последний
ученый нашел из целого ряда опытов
эмпирическую формулу, дающую достаточно
точно количество вытекающего по трубе
в единицу времени газа, именно:
для
стекла равно 0,02197, а по Д'Обюисону для
металлических труб — 0,0238. Этот последний
ученый нашел из целого ряда опытов
эмпирическую формулу, дающую достаточно
точно количество вытекающего по трубе
в единицу времени газа, именно:
 ,
,
где p выражено в давлении ртутного столба.
При И. газов из волосных трубок они следуют, как и жидкости, закону Пуазейля. И. газов из волосных трубок пользуются для определения внутреннего трения их. При И. газы образуют струи, представляющие все особенности жидких струй — реакцию (ракеты, отдача от выстрелов), удар струи и т. д. (см. Струя). При действии мгновенных сил И. газов происходит в виде вихря (при взрывах, при образовании фосфористого водорода и т. д.).
Теория И. газов весьма важна для техники — газопроводного дела, устройства пневматической передачи, воздуходувных приборов, вентиляционных и дымовых труб; в науке она важна для теоретической метеорологии (ветры). Значительные математические трудности замедляют пока полную разработку вопросов об И. газов и паров.
17) Анализ политропных
процессов по энергетическим показателям
(∆U, q, l) Политропный – процессы, в кот.
теплоемкость имеет любое, но постоянное
на протяжении всего процесса значение.
P* -уравнение
состояния.
-уравнение
состояния.
 =const
– Ур-е политропного (обобщающего)
процесса, где
=const
– Ур-е политропного (обобщающего)
процесса, где
 )/(
)/(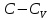 )
– показатель полит.процесса.
)
– показатель полит.процесса.
 =const
=const
 – соотношения м/у
параметрами T и υ, p и T.
– соотношения м/у
параметрами T и υ, p и T.
Изменение энтропии: Энтропия является функцией состояния. Ее изменение в пределах процесса определяется как разность конечного и начального значений. Энтропия, и ее изменение не поддается физическому определению и измерению, а является расчетной величиной.
![]() ;
;
![]()
![]() ;
;
Работа расширения
/сжатия в политропном процессе: ;
;
Количество теплоты:
![]() ,
q
– удельное количество теплоты.
,
q
– удельное количество теплоты.
Внутренняя энергия термодинамической системы зависит от температуры рабочего тела:
![]() ;
;
Энтальпия представляет
собой сумму внутренней энергии тела и
работы, которую необходимо затратить,
чтобы тело объемом V ввести в окружающую
среду, имеющую давление p и находящуюся
c телом в равновесном состоянии:
![]() ;
;
КПД цикла
Термодинамические исследования цикла Ренкина показывают что его эффективность в большей степени зависит от величин начальных и конечных параметров (давления и температуры) пара.
![]()

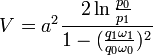 ,
, .
.