
- •6)Конвективный теплообмен. Факторы, влияющие на конвективный теплообмен.
- •7)Газовые смеси. Способы их задания.
- •8. Холодильный цикл - термодинамический цикл, осуществляемый системой, которая передает тепло от тела с низкой температурой к телу с высокой температурой.
- •9) Калорические параметры состояния, их свойства. Калорическое уравнение состояния.
- •10. Основные элементы котельной установки, их значение.
- •11) Аналитическое выражение 1 закона термодинамики. В каком случае теплота, работа и изменение внутренней энергии считаются положительными. А когда – отрицательными.
- •12) Виды топлива, используемого в котельных установках. Основная характеристика топлив, их различие по содержанию золы и влаги. Условное топливо.
- •13) Классификация термодинамических процессов и их применение в термодинамических процессах. Цель анализа термодинамических процессов.
- •14)Основной закон теплопроводности (Закон Фурье)
- •15)Баланс тепловых потоков для термодинамических процессов (адиабатного, изотермического, изохорного) в соответствии с 1 законом термодинамики
- •16.Истечение. Газов.
- •Процессы
- •Применение
- •Обратный цикл Ренкина
- •31. Раб. Тело, его назначение. Преимущества исп-я газообразных продуктов сгорания перед водяным паром.
- •32. Котельный агрегат и его элементы
- •Двигатель внутреннего сгорания - это устройство, в котором химическая энергия топлива превращается в полезную механическую работу. Циклы работы поршневых двс
- •38. Теплопроводность через плоскую стенку.
- •39. Отличие теоретического цикла двс от действительного.
- •41. Круговые процессы( циклы). Теоретический цикл холодильной машины (обратный цикл Карно).
- •45 Теплопроводимость через цилиндрическую однослойную стенку
- •46. Теплопередача, коэффициент теплопередачи.
- •46. Теплопередача, коэффициент теплопередачи.
- •47. Коэффициент теплоотдачи от рабочего тела к стенке.
- •49. Энтальпия.
- •51. В учебнике стр 213-214.
-
Идеальный газ. Уравнение состояния (уравнение взаимосвязи между параметрами состояния P, V, T). Охарактеризовать величины, входящие в состав ур-ия состояния. Идеальный газ – газ, между молекулами которого отсутствует взаимодействие, а сами молекулы принимаются за материальные точки, не имеющие объёма. Уравнение состояния газов. PV=RT – уравнение Клапейрона-Менделеева.( PV=МRT, если масса газа не 1 кг). T (температура) – мера средней кинетической энергии движения молекул газа. Т = 273,15 + t [K]. P (давление) – средний результат ударов молекул газа о стенки сосудов. Рабс = Ризб + В0, где В0 – давление при нормальных условиях. Давление измеряется в Па (Н/м2); давление, равное 0,1 МПа, называется бар. V (удельный объем) – объем 1 кг массы газа, выраженный в кубических метрах. Плотность – величина, обратная объему.
 [Нм3/кг].
[Нм3/кг].
 =
8314 Дж/кмоль*К – универсальная газовая
постоянная . R – удельная газовая
постоянная, кДж/кг*К. R =
=
8314 Дж/кмоль*К – универсальная газовая
постоянная . R – удельная газовая
постоянная, кДж/кг*К. R =
 /
/ ,
где
,
где
 – молярная масса газа.
– молярная масса газа. -
2) КПД котельного агрегата. Почему величина КПД при работе на твердом топливе меньше, чем на газе и мазуте? Коэффициентом полезного действия отопительного котла называют отношение полезной теплоты, израсходованной на выработку пара (или горячей воды), к располагаемой теплоте отопительного котла. Не вся полезная теплота, выработанная котельным агрегатом, направляется потребителям, часть теплоты расходуется на собственные нужды. Потери теплоты происходят за счет: химической неполноты сгорания топлива, потери теплоты через стенки котла, физического не дожигания, часть тепла уходит с отработанными газами. Располагаемая теплота в котле складывается из теплоты вносимой с топливом, теплоты поступаемой с воздухом. При работе на твердом топливе кпд меньше, так как возрастают физические потери теплоты и необходимо затратить тепло на парообразование, так как горит только газ. Следовательно, при работе на газу или мазуте кпд теплокотла больше.
3) Разновидности
теплоемкостей рабочего тела( С, C',µС).
Теплоемкостью тела называют количество
теплоты, необходимое для изменения ее
температура на 1 К. В зависимости от
того, в каких единицах задано количество
вещества ,в расчетах используют следущие
удельные теплоемкости: С – массовая
теплоемкость, отнесенную к 1 кг
массы[дж/кг*К]; µС – молярную теплоем,
отнесенную к 1 Кмолю вещества[Дж/(Кмоль*К)];
С’ – объемную, кол-во вещества
содержащегося в 1
 при нормальнах физических условиях[дж/(К*
при нормальнах физических условиях[дж/(К*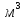 )].
Удельные теплоемкости связаны между
собой соотношением С=
µС/µ=С’/
)].
Удельные теплоемкости связаны между
собой соотношением С=
µС/µ=С’/ .
Теплоемкость газообразного вещества
зависит от характера термодинамического
процесса: CV – молярная теплоемкость в
изохорном процессе (V = const) и Cp – молярная
теплоемкость в изобарном процессе (p =
const). Связь
между теплоемкостями дается уравнением
майера:
.
Теплоемкость газообразного вещества
зависит от характера термодинамического
процесса: CV – молярная теплоемкость в
изохорном процессе (V = const) и Cp – молярная
теплоемкость в изобарном процессе (p =
const). Связь
между теплоемкостями дается уравнением
майера:
 ;
R=8,314-универсальная
газовая постоянная. Зависимость
теплоемкости от характера процесса
выражается формулами:
;
R=8,314-универсальная
газовая постоянная. Зависимость
теплоемкости от характера процесса
выражается формулами:
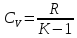 ;
;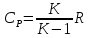 ;
;
Характер зависимости
молярной теплоемкости от температуры
обусловлен степенями свободы молекулы
,общее число которых равно утроенному
числу образующих ее атомов.
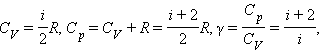
i-число степеней свободы.
Отношение
теплоемкостей в процессах с постоянным
давлением и постоянным объемом играет
важную роль в термодинамике. Оно
обозначается греческой буквой γ и
называется показателем адиабаты: γ= .
.
4. Общие сведения о неравновесной термодинамике (термодинамики открытых систем) Классическая термодинамика (ее три «начала») изучает термодинамические равновесные, обратимые процессы. Для неравновесных процессов она устанавливает лишь неравенства, которые указывают возможное направление этих процессов.Основная задача неравновесной термодинамики - количественное изучение неравновесных процессов, в частности определение их скоростей в зависимости от внешних условий. В неравновесной термодинамике системы, в которых протекают неравновесные процессы, рассматриваются как непрерывные среды, а их параметры состояния — как полевые переменные, то есть непрерывные функции координат и времени. Слабо неравновесная (линейная) термодинамика рассматривает термодинамические процессы, происходящие в системах в состояниях, близких к равновесию. Таким образом, линейная термодинамика описывает стабильное, предсказуемое поведение систем, стремящихся к минимальному уровню активности.Пример:если сила «один» (например, градиент температуры) для слабо неравновесных ситуаций воздействует на поток «два» (например, на диффузию), то сила «два» (градиент концентрации) воздействует на поток «один» (поток тепла).Таким образом, в слабо неравновесной области практически действуют законы равновесной термодинамики, система ни к чему не стремится и ее поведение в большинстве случаев вполне предсказуемо.Сильно неравновесная термодинамика рассматривает процессы, происходящие в системах, состояние которых далеко от равновесия.Когда термодинамические силы, действуя на систему, становятся достаточно большими и выводят ее из линейной области в нелинейную, устойчивость состояния системы и ее независимость от флуктуации значительно уменьшается.
Все материальные системы, от самых малых до самых больших, считаются открытыми, обменивающимисяэнергией и веществом с окружающей средой и находящимися, как правило, в состоянии, далеком от термодинамического равновесия.
Это свойство материальных систем позволило в свою очередь определить целый ряд новых свойств материи.
Вот некоторые из них.
- все процессы необратимы, так как они всегда сопровождаются потерями энергии;
- энтропия S в открытых системах имеет две составляющие: deS – характеризует обмен энтропией с внешним миром; diS – характеризует необратимые процессы внутри;
- материя обладает свойством самоорганизации
5) Классическая формула средней теплоёмкости. Под удельной теплоёмкостью вещества понимают количество теплоты, необходимое для нагревания единицы в-ва, чтобы изменить его температуру на 1 К.
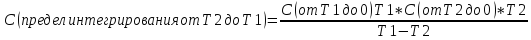
С-удельная теплоемкость, Т1-Т2 диапазон температур.
6)Конвективный теплообмен. Факторы, влияющие на конвективный теплообмен.
Конвективным теплообменом называется одновременный перенос теплоты конвекцией и теплопроводностью. В инженерных расчетах часто определяют конвективный теплообмен между потоками жидкости или газа и поверхностью твердого тела. Этот процесс конвективного теплообмена называют конвективной теплоотдачей или просто теплоотдачей. Для описания конвективной теплоотдачи используется формула:
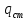 =
a(
=
a( —
—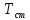 ),
),
где qcт — плотность теплового потока на поверхности, вт/м2; a — коэффициент теплоотдачи, вт/(м2·°С); T0 и Тст — температуры среды (жидкости или газа) и поверхности соответственно. Величину T0 — Тст часто обозначают DТ и называется температурным напором.
Основными факторами, влияющими на процесс теплоотдачи являются следующие:1)Природа возникновения движения жидкости вдоль поверхности стенки. Самопроизвольное движение жидкости (газа) в поле тяжести, обусловленное разностью плотностей её горячих и холодных слоев, называют свободным движением (естественная конвекция).Движение, создаваемое вследствие разности давлений, которые создаются насосом, вентилятором и другими устройствами, называется вынужденным (вынужденная конвекция).2) Режим движения жидкости. Упорядоченное, слоистое, спокойное, без пульсаций движение называется ламинарным.Беспорядочное, хаотическое, вихревое движение называется турбулентным.3)Физические свойства жидкостей и газов.Большое влияние на конвективный теплообмен оказывают следующие физические параметры: коэффициент теплопроводности (l), удельная теплоемкость (с), плотность (ρ), κкоэффициент температуропроводности (а = λ/cр·ρ), коэффициент динамической вязкости (μ) или кинематической вязкости (ν = μ/ρ), тεмпературный коэффициент объемного расширения (β = 1/Т).4). Форма (плоская, цилиндрическая), размеры и положение поверхности (горизонтальная, вертикальная).
7)Газовые смеси. Способы их задания.
Газовой смесью понимается смесь отдельных газов, вступающих между собой ни в какие химические реакции. Каждый газ (компонент) в смеси независимо от других газов полностью сохраняет все свои свойства и ведет себя так, как если бы он один занимал весь объем смеси. Парциальное давление – это давление, которое имел бы каждый газ, входящий в состав смеси, если бы этот газ находился один в том же количестве, в том же объеме и при той же температуре, что и в смеси.Газовая смесь подчиняется закону Дальтона: Общее давление смеси газов равно сумме парциальных давлений отдельных газов, составляющих смесь.Р = Р1 + Р2 + Р3 + . . .Рn = ∑ Рi , где Р1 , Р2 , Р3 . . .Рn – парциальные давления.
Состав смеси задается объемными, массовыми и мольными долями, которые определяются соответственно по следующим формулам:
Объемной долей называют отношение парциального объема компонента к объему смеси:
r1 = V1 / Vсм ; r2 = V2 / Vсм ; rn = Vn / Vсм ,
Сумма объемных
долей компонентов равна 1:
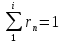 ;
;
Массовой долей называют отношение массы компонента к массе смеси:
g1 = m1 / mсм ; g2 = m2 / mсм ; … gn = mn / mсм ,
Молярной долей наз отношение числа киломолей компонента к числу киломолей смеси
r1′ = ν1 / νсм ; r2′ = ν2 / νсм ; … rn′ = νn / νсм ,
где V1 ; V2 ; … Vn ; Vсм –объемы компонентов и смеси;
m1 ; m2 ; … mn ; mсм – массы компонентов и смеси;
ν1 ; ν2 ; … νn ; νсм – количество вещества (киломолей) компонентов и смеси.
