
- •§1. Концептуальные уровни химии. Учение о составе вещества
- •§2. Квантовые числа
- •§3. Строение атомов и периодическая таблица элементов Менделеева
- •§4. Химическая связь
- •§5. Развитие структурной химии
- •§6. Учение о химических процессах. Термодинамические методы управления химическими реакциями
- •§7. Перспективы развития энергетики
- •§8. Учение о химических процессах. Кинетические методы управления химическими реакциями
- •§9. Эволюционная химия
- •Современные концепции развития геосферных оболочек
- •§1. Строение и химический состав атмосферы Земли.
- •§2. Эволюция атмосферы
- •§3. Литосфера как абиотическая основа жизни. Экологические функции литосферы: ресурсная, геодинамическая, геофизико-геохимическая
- •§4. Географическая оболочка Земли
- •§1. Синергетика
§4. Химическая связь
Бóльшая часть вещества во Вселенной находится в звездах в ионизированном состоянии (плазма). Однако на Земле плазмы немного (за исключением внешнего атмосферного слоя – ионосферы). В то же время и в атомарном состоянии в обычных земных условиях пребывает весьма незначительная часть вещества – это одноатомные газы, образованные элементами восьмой группы таблицы Менделеева, – гелий, неон, аргон и др. Атомы остальных элементов, взаимодействуя друг с другом и с атомами других элементов, образуют более сложные частицы и макроскопические системы. Это взаимодействие имеет электромагнитную природу, проявляется, в первую очередь, в притяжении разноименных и отталкивании одноименных зарядов ядер и внешних (валентных) электронов соседних атомов и называется химической связью.
Образование химических связей соответствует принципу минимума энергии системы. Атомы, имеющие на внешнем энергетическом уровне менее восьми (иногда двух) электронов, «стремятся» приобрести устойчивую, энергетически выгодную внешнюю восьмиэлектронную (октет) или двухэлектронную (дуплет) оболочки. Устойчивая электронная конфигурация может быть образована разными способами. Это соответствует различным видам химических связей: ковалентной, ионной, металлической, водородной и ван-дер-ваальсовой.
Связь, осуществляемая за счет образования электронной пары, принадлежащей обоим атомам, называется ковалентной. Существует обменный и донорно-акцепторный механизмы образования ковалентной связи.
В случае обменного механизма образования связи при сближении двух атомов они оказываются на расстоянии, при котором силы притяжения их разноименных зарядов равны силам отталкивания их одноименных зарядов. На этом расстоянии, называемом длиной ковалентной связи, электронные оболочки, участвующие в образовании связи, перекрываются между собой. При этом для обоих электронов существенным является не только поле притяжения своего «родного», но и соседнего ядра. Атомы постоянно как бы обмениваются общей парой электронов (отсюда термин «обменный механизм»). Область перекрытия электронных оболочек имеет повышенную плотность отрицательного заряда, что приводит к уменьшению отталкивания ядер друг от друга и способствует образованию ковалентной связи.
Если центры расположения положительных и отрицательных зарядов в системе связанных атомов совпадают, то ковалентная связь называется неполярной, если эти центры не совпадают, то ковалентная связь – полярная. Неполярную ковалентную связь образуют одинаковые атомы. Например, в молекулах H2 и Cl2 атомы связаны неполярной связью. Полярную ковалентную связь образуют атомы разных элементов. Например, в молекуле HCl атомы водорода и хлора связаны полярной связью.
При донорно-акцепторном механизме образования ковалентной связи один атом (донор) предоставляет электронную пару, а другой атом (акцептор) – свободную орбиталь. Так, например, образуется ион аммония
H+ + :NH3 = NH4+
Здесь электронную пару (обозначена точками) предоставляет атом азота, а свободную 1s-орбиталь – ион водорода.
Ионная связь осуществляется за счет электростатического притяжения между ионами, образованными путем практически полного смещения электронной пары к одному из атомов. Ионную связь можно трактовать как предельный случай полярной ковалентной связи. При образовании ионной связи один атом, теряя электрон, становится положительным ионом (катионом), а другой, приобретая этот электрон, – отрицательным ионом (анионом).
Способность атомов элементов образовывать катионы характеризуется энергией ионизации. Чем она меньше, тем вероятнее образование катиона. Поэтому наиболее вероятно образование катионов из атомов щелочных и щелочно-земельных металлов. Образование простых анионов наиболее энергетически выгодно для атомов галогенов вследствие их высокой энергии сродства к электрону, т.е. энергии, выделяющейся в результате присоединения электрона к атому. Таким образом, ионные связи чаще всего образуются при взаимодействии атомов щелочных и щелочно-земельных металлов с галогенами (Na+Cl-, Cs+Br- и т.п.).
Взаимодействие ионов противоположного знака не приводит к полной компенсации их электростатических полей, что оставляет ионам способность притягивать другие ионы противоположного знака в иных направлениях. В результате возникает, например, кристаллическая решетка хлорида натрия, имеющая кубическую форму, где каждый ион натрия окружен шестью ионами хлора и наоборот (рис. 3).
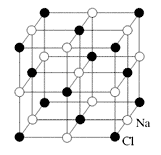
Рис. 3
Физико-химические свойства металлов обусловлены существованием в них особого вида связи – металлической. Валентные электроны металлов слабо связаны со своими атомами и легко могут отрываться от них (энергия ионизации атомов металлов невелика). Поэтому металл представляет собой систему положительных ионов, расположенных упорядоченно и образующих кристаллическую решетку, и большого количества электронов, достаточно свободно перемещающихся внутри решетки – «электронный газ», который обеспечивает связь между всеми ионами металла. Такая связь и называется металлической.
Водородная связь – это связь между положительным зарядом атома водорода одной молекулы и отрицательным зарядом атома другой молекулы (водородная связь может быть и внутримолекулярной). Данный вид связи носит частично электростатический, частично донорно-акцепторный характер.
Водородные связи возникают, например, между молекулами воды. Связи О – Н в молекуле воды являются ковалентными полярными с избытком отрицательного заряда δ- на атоме кислорода и с избытком положительного заряда δ+ на атоме водорода. Поэтому атом водорода может связываться с атомом кислорода другой молекулы воды через его неподеленные пары электронов (на схеме водородная связь обозначена штриховой линией).
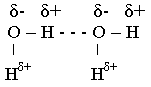
Ван-дер-ваальсовой (межмолекулярной) связью называется связь, обусловленная незначительным притяжением, действующим между молекулами на расстояниях порядка 10-9 м. Существует три вида ван-дер-ваальсовых сил притяжения, имеющих электрическую природу.
Если молекулы полярные, то между ними возникают ориентационные силы притяжения, т.е. одна полярная молекула ориентируется в поле другой полярной молекулы так, что они притягиваются (рис. 4 а, б).
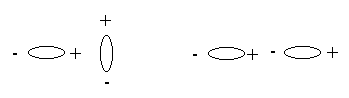
а) б)
Рис. 4 (а, б)
В случае разнородных полярной и неполярной молекул возникают индукционные силы притяжения, обусловленные тем, что в электрическом поле полярной молекулы в неполярной молекуле наводятся (индуцируются) электрические заряды (рис. 5 а, б), т.е.
![]()
а) б)
Рис. 5 (а, б)
Силы притяжения возникают и между неполярными молекулами (дисперсионные силы). Дело в том, что благодаря движению электронов их конфигурация в молекуле все время меняется. Поэтому у неполярной молекулы положения положительного и отрицательного зарядов совпадают лишь в среднем. В каждый момент времени молекула в некоторой степени поляризована в каком-либо направлении, т.е. имеет мгновенное собственное электрическое поле, которое наводит заряды в соседней неполярной молекуле, поляризуя ее. Та, в свою очередь, своим электрическим полем индуцирует дополнительные заряды в первой молекуле и т.д., что приводит к увеличению сил притяжения. Поэтому дисперсионные силы значительно превосходят ориентационные и индукционные силы даже для полярных молекул.
Однако по сравнению с другими видами связей межмолекулярные связи нельзя назвать прочными. Так, если энергия связи, т.е. энергия необходимая для разрыва связи, для ковалентных и ионных связей составляет 100 – 800 кДж/моль, для металлических связей – в 3-4 раза меньше, для водородных связей – 20 – 40 кДж/моль, то для ван-дер-ваальсовых связей эта энергия составляет лишь несколько килоджоулей на моль.
