
- •§1. Концептуальные уровни химии. Учение о составе вещества
- •§2. Квантовые числа
- •§3. Строение атомов и периодическая таблица элементов Менделеева
- •§4. Химическая связь
- •§5. Развитие структурной химии
- •§6. Учение о химических процессах. Термодинамические методы управления химическими реакциями
- •§7. Перспективы развития энергетики
- •§8. Учение о химических процессах. Кинетические методы управления химическими реакциями
- •§9. Эволюционная химия
- •Современные концепции развития геосферных оболочек
- •§1. Строение и химический состав атмосферы Земли.
- •§2. Эволюция атмосферы
- •§3. Литосфера как абиотическая основа жизни. Экологические функции литосферы: ресурсная, геодинамическая, геофизико-геохимическая
- •§4. Географическая оболочка Земли
- •§1. Синергетика
§3. Строение атомов и периодическая таблица элементов Менделеева
Для объяснения строения и порядка заполнения электронных оболочек атомов весьма полезными оказываются следующие положения.
Принцип Паули: в атоме не может двух электронов с одинаковыми квантовыми числами.
Правило Хунда: заполнение подуровней начинается электронами с одинаковой ориентацией спина и только затем – с противоположной.
Принцип минимума энергии: наибольшей вероятностью обладает состояние электрона с наименьшей энергией, что соответствует наибольшей энергии связи электрона с ядром.
Правило Клечковского: электрон в основном состоянии занимает уровень с минимально возможным значением суммы n+l; при равенстве этой суммы для двух или более электронов энергия меньше у тех электронов, у которых меньше главное квантовое число n.
Руководствуясь принципом Паули, можно рассчитать число электронов, находящихся на одном энергетическом уровне, т.е. имеющим определенное число n. При заданных n, l и ml. состояния электронов могут отличаться только числом ms, которое может принимать два разных значения ( +½ и – ½), т.е., таких электронов будет 2. При заданных n и l электроны могут отличаться также числом ml, которое может иметь 2 l + 1 значений, т.е., таких электронов будет 2(2 l + 1). Наконец, при заданном n электроны отличаются еще числом l, принимающим значения от 0 до n – 1. Таким образом, максимальное число электронов N, имеющим одинаковое главное квантовое число n, определяется суммой
![]() N
=
N
=
![]() =
2(1 + 3 + 5 +…) = 2n2
=
2(1 + 3 + 5 +…) = 2n2
Следовательно, на первом энергетическом уровне (n = 1) может быть не более 2 электронов, на втором – 8, на третьем – 18 и т.д.
Первый энергетический уровень состоит из одного подуровня 1s, второй – из двух подуровней – 2s и 2р, третий – из трех подуровней – 3s, 3р и 3d и т.д. Подуровень, в свою очередь, делится на квантовые ячейки, т.е. состояния, отличающиеся значением числа ml. Таким образом, каждый подуровень содержит 2 l + 1 квантовых ячеек.
Электроны в квантовой ячейке могут отличаться только числом ms, которое принимает только два значения. Следовательно, каждая квантовая ячейка, согласно принципу Паули, может содержать не более двух электронов (как говорят, электронов с антипараллельными спинами). Квантовая ячейка схематично обозначается квадратиком, а направление спина электрона – стрелкой.
Теперь мы можем рассмотреть строение (конфигурации) электронных оболочек атомов элементов таблицы Менделеева.
Так состояния электронов у атомов первых двух элементов – водорода и гелия можно представить в виде

Согласно принципу Паули на гелии завершается построение первой электронной оболочки, что обусловливает его химическую инертность. Водород и гелий образуют первый период таблицы Менделеева.
Рассмотрим далее строение внешних электронных оболочек атомов следующих восьми элементов, т.е. элементов второго периода (полностью завершенный 1s подуровень в таблице не показан).
 Построение
2р-подуровня
происходит в соответствии с правилом
Хунда. Заполнение
2-го уровня заканчивается на атоме неона,
который, как и гелий, химически инертен.
Построение 3-го уровня начинается с
атома натрия (11Na)
и заканчивается на атоме аргона (18Ar),
образующим третий период, и происходит
по указанным выше принципам. В частности,
для всех элементов с 1-го по 18-й справедливо
правило Клечковского.
Построение
2р-подуровня
происходит в соответствии с правилом
Хунда. Заполнение
2-го уровня заканчивается на атоме неона,
который, как и гелий, химически инертен.
Построение 3-го уровня начинается с
атома натрия (11Na)
и заканчивается на атоме аргона (18Ar),
образующим третий период, и происходит
по указанным выше принципам. В частности,
для всех элементов с 1-го по 18-й справедливо
правило Клечковского.
Рассмотрим, наконец, строение внешних электронных оболочек атомов первых восьми из десяти элементов четвертого периода, т.е., с атома калия (19K) до атома железа (26Fe). (Первые три полностью заполненных энергетических уровня в таблице не показаны).

Следует обратить внимание, что у элементов с 19-го по 23-й сначала заполняется не 3d, а 4s-подуровень, что соответствует правилу Клечковского. Действительно, для 3d-подуровня число Клечковского k = n+l = 3+2 = 5, а для 4s-подуровня k = n+l = 4+0 = 4. Однако атом хрома 24Cr является первым исключением из этого правила. Дело в том, что правило Клечковского есть проявление принципа минимума энергии электронов в атоме, но, как и у многих других правил, у него есть исключения. Для атома хрома энергия электронов конфигурации 3d54s1 меньше, чем конфигурации 3d44s2. Существуют и другие исключения из правила Клечковского, например, атомы меди 29Cu, платины 78Pt, золота 79Au и др. Электронные конфигурации этих атомов, как, впрочем, и всех других, соответствуют принципу минимума энергии.
Периодичность свойств элементов, обнаруженных Д.И. Менделеевым, объясняется периодической повторяемостью числа электронов на внешних энергетических уровнях (валентных электронов), которые в основном и определяют химические свойства атомов. Число возможных энергетических уровней атома (семь) обусловливает деление элементов на семь периодов. Каждый период начинается элементами, атомы которых на внешнем уровне имеют один электрон, – атомы химически активных водорода и щелочных металлов – и заканчиваются элементами с завершенным внешним слоем – атомы химически инертных благородных газов.
Периодичность прослеживается и при сравнении значений количественных характеристик атомов элементов, например, энергии ионизации атомов, т.е., энергии, необходимой для отрыва наиболее слабо связанного электрона от атома (или, что то же, энергии связи внешнего электрона с атомом). Из графика, представленного на рис.2, следует, что энергия ионизации минимальна для щелочных металлов, затем внутри периода она возрастает и принимает максимальное значение у инертных газов. Сверху вниз вдоль группы энергии ионизации уменьшаются, что объясняется экранированием ядра внутренними электронными оболочками.
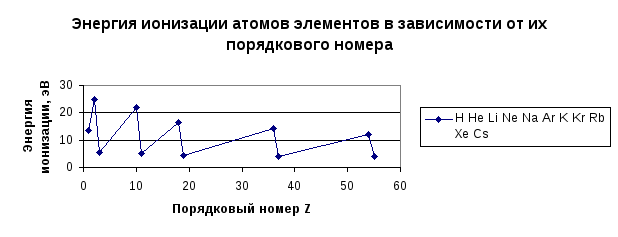
Рис. 2
