
- •Общая и неорганическая химия
- •Часть I. Общая химия
- •1. Основные понятия химии
- •2. Строение атома
- •2.1. Корпускулярно-волновой дуализм
- •2.2. Квантовые числа
- •2.3. Электронные конфигурации атомов
- •2.4. Периодический закон
- •3. Химическая связь
- •3.1. Метод валентных связей.
- •3.2. Теория молекулярных орбиталей
- •3.3. Некоторые типы химических связей Ионная связь
- •Водородная связь
- •Межмолекулярные взаимодействия
- •4. Закономерности протекания химических процессов
- •4.1. Термохимия
- •4.2. Химическая кинетика
- •4.3. Химическое равновесие
- •5.1. Концентрация растворов
- •5.2. Электролитическая диссоциация
- •5.3. Диссоциация слабых электролитов
- •5.4. Диссоциация сильных электролитов
- •5.5 Ионное произведение воды. Водородный показатель.
- •5.6. Буферные растворы.
- •5.7. Гидролиз солей
- •5.8. Протолитическая теория кислот и основания
- •6. Константа растворимости. Растворимость.
- •Условие осаждения и растворения осадка
- •Эффект общего иона
- •Солевой эффект
- •7. Окислительно-восстановительные реакции
- •Ионно-электронный метод составления овр
- •8. Координационные соединения
- •Номенклатура координационных соединений
- •Химическая связь координационных соединений
- •Диссоциация координационных соединений
- •Часть II. Неорганическая химия
- •9. Химия s-элементов
- •9.1. Химия элементов ia группы.
- •Химические свойства щелочных металлов.
- •Химические свойства соединений щелочных металлов
- •9.2. Химия элементов iia группы.
- •Химические свойства элементов
- •Химические свойства соединений
- •10. Химия р-элементов
- •10.1. Химия элементов iiia группы
- •Свойства бора и его соединений
- •Свойства алюминия и его соединений
- •10.2. Химия элементов iva группы
- •Свойства углерода и его соединений
- •Cвойства кремния и его соединений
- •Свойства соединений олова и свинца
- •10.3. Химия элементов va группы
- •Свойства азота и его соединений
- •Свойства фосфора и его соединений
- •10.4. Химия элементов via группы
- •Химия кислорода и его соединений
- •Химия серы и ее соединений
- •10.5. Химия элементов viia группы
- •Химия водорода и его соединений
- •Химия фтора и его соединений
- •Химия хлора и его соединений
- •Химия брома, иода и их соединений
- •11. Химия d-элементов
- •Химия хрома и его соединений
- •Химия марганца и его соединений
- •Химия железа и его соединений
- •Химия меди и ее соединений
- •Химия цинка и его соединений
- •Содержание
- •Часть I. Общая химия ……………………………….. 3
- •1. Основные понятия химии …………………………………… 3
- •Часть II. Неорганическая химия ………...…………. 66
5.3. Диссоциация слабых электролитов
Применим закон действия масс к равновесию между ионами и молекулами в растворе слабого электролита, например, уксусной кислоты:
CH3COOH![]() CH3COO-
+ H+
CH3COO-
+ H+
![]()
или синильной кислоты:
HCN![]() H+
+ CN-
H+
+ CN-
![]()
Константы равновесия реакций диссоциации называются константами диссоциации. Константы диссоциации характеризуют диссоциацию слабых электролитов, чем меньше константа, тем меньше диссоциирует слабый электролит, тем он слабее. Так, например, поскольку КHCN =6,210-10KCH3COOH = 1,810-5, то синильная кислота хуже диссоциирует и слабее, чем уксусная кислота.
Многоосновные кислоты диссоциируют ступенчато:
H3PO4![]() H+
+ H2PO4-
H+
+ H2PO4-
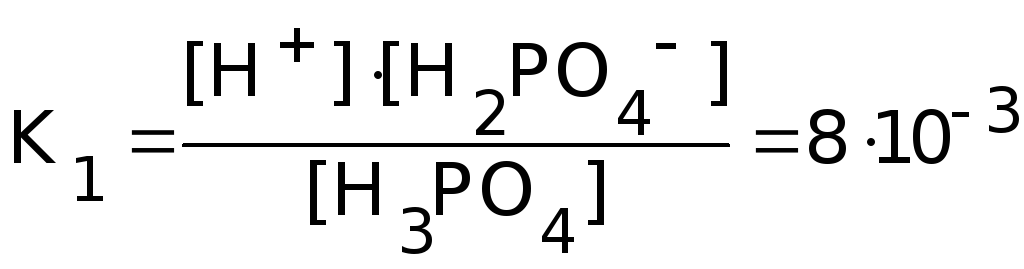
H2PO4-![]() H+
+ HPO42-
H+
+ HPO42-

HPO42-![]() H+
+ PO43-
H+
+ PO43-
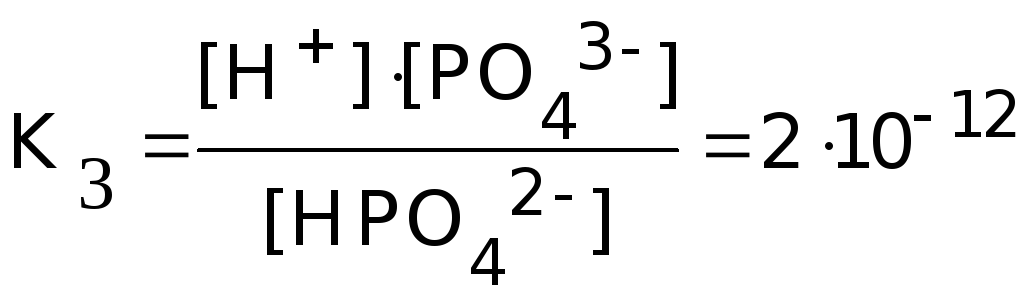
Константа равновесия суммарной реакции диссоциации равна произведению констант отдельных стадий диссоциации:
H3PO4![]() 3H+
+ PO43-
3H+
+ PO43-
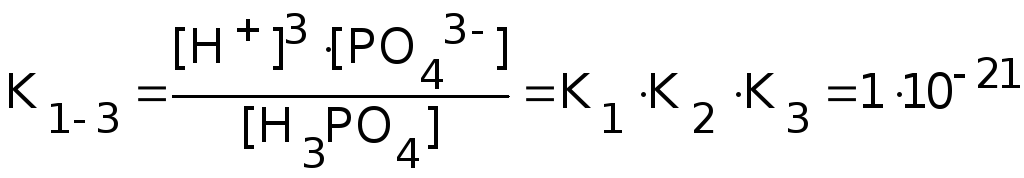
Закон разбавления Оствальда. При диссоциации слабого электролита, например, CH3COOH, молярная концентрация которого равна С, начальные и равновесные концентрации молекул и ионов равны:
CH3COOH![]() CH3COO-
+ H+
CH3COO-
+ H+
Снач С 0 0
Сравн С-C C C
где - степень диссоциации.
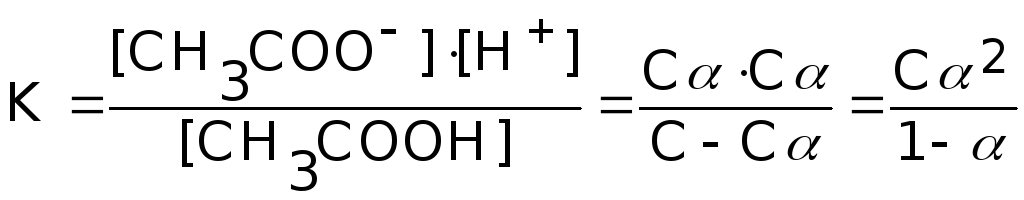
Поскольку
для слабых электролитов a<<1 и 1 - a
1, имеем K=C2
или
=
![]() .
.
Закон разбавления Оствальда: степень диссоциации слабого электролита увеличивается при уменьшении его концентрации, то есть при разбавлении.
Влияние общего иона на диссоциацию слабого электролита. Добавление общего иона уменьшает диссоциацию слабого электролита. Так, при добавлении к раствору слабого электролита CH3COOH
CH3COOH
![]() CH3COO-
+ H+
<<1
CH3COO-
+ H+
<<1
сильного электролита, содержащего общий с CH3COOH ион, то есть ацетат-ион, например, CH3COONa
CH3COONa
![]() CH3COO-
+ Na+
= 1
CH3COO-
+ Na+
= 1
концентрация ацетат иона увеличивается, и равновесие диссоциации CH3COOH сдвигается влево, то есть диссоциация уменьшается.
Пример. Найти [H+] в 0,1 М растворе CH3COOH K=1,810-5.
Решение.
Для CH3COOH
![]() CH3COO-
+ H+
CH3COO-
+ H+
имеем
![]() Поскольку CH3COOH
- слабый электролит, то [CH3COOH]
= С = 0,1 М, кроме того [H+]
= [CH3COO-].
Отсюда
Поскольку CH3COOH
- слабый электролит, то [CH3COOH]
= С = 0,1 М, кроме того [H+]
= [CH3COO-].
Отсюда
![]() .
.
Пример. Найти [H+] в растворе 0,1 М CH3COOH (K=1,810-5) и 0,1 М CH3COONa (=1).
Решение.
Имеем CH3COOH
![]() CH3COO-
+ H+
(<<1)
CH3COO-
+ H+
(<<1)
![]()
![]()
и
CH3COONa![]() CH3COO-
+ Na+
= 1
CH3COO-
+ Na+
= 1
Учитывая, что CH3COOH - слабый электролит и пренебрегая числом диссоциированных молекул, полагаем
[CH3COOH] = C(CH3COOH)=0,1 М. Поскольку CH3COONa диссоциирован полностью и пренебрегая количеством ионов CH3COO-, образовавшихся при диссоциации CH3COOH, получаем
[CH3COO-]=C(CH3COONa)=0,1
М.
Отсюда
имеем:
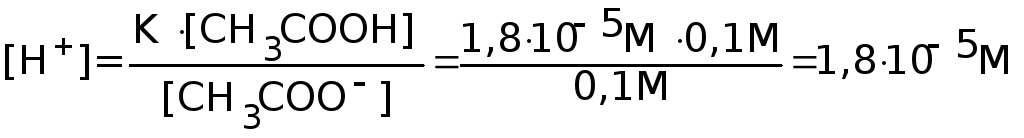 .
.
Видно, что при добавлении раствора CH3COONa к раствору CH3COOH концентрация ионов водорода уменьшилась в 1,3410-3 / 1,810-5 = 74,4 раза.
5.4. Диссоциация сильных электролитов
Сильные электролиты в растворе полностью диссоциированы на ионы. Ионы взаимодействуют между собой и ведут себя так, будто их концентрация меньше их действительной концентрации. Для учета взаимодействия между ионами в растворе вводится понятие активности ионов.
Активность иона - a - это концентрация иона, проявляющаяся в его свойствах. Например, активность ионов Na+ и Cl- в 1М растворе NaCl равна 0,65М. Это значит, что ионы ведут себя так, словно их концентрация равна не 1 моль/л, а 0,65 моль/л.
Коэффициент активности - f - это отношение активности иона a к концентрации C: f = a/c или a = fc.
Если f=1, то активность равна концентрации, т.е. ионы свободны и не взаимодействуют между собой. Это имеет место в очень разбавленных растворах, в растворах слабых электролитов и т.д.
Если f<1, то активность меньше концентрации, т.е. ионы взаимодействуют между собой. Чем меньше f, тем больше взаимодействие между ионами.
Коэффициент активности зависит от ионной силы раствора m - чем больше ионная сила, тем меньше коэффициент активности.
Ионная
сила раствора
зависит от зарядов Z и концентраций C
ионов:
![]()
Пример. Найти ионную силу раствора, 1 литр которого содержит 0,02 моль Ca(NO3)2 и 0,05 моль Na2SO4.
Решение. Считая, что Ca(NO3)2 и Na2SO4 полностью диссоциированы, имеем [Ca2+]=0,02 M, [NO3-]=0,04M, [Na+]=0,1M,
[SO42-]=0,05M. Суммируя по каждому иону, находим:
![]() .
.
Для электролитов, имеющих концентрацию С, ионная сила равна в зависимости от типа электролита:
A+B- = 1/2(С12+С12) = С NaOH, HCl
A2+B2- = 1/2(2С12+С22) = 3С H2SO4, MgCl2
A2+B2- =1/2(С22+С22) = 4С CuSO4, MgSO4
A3+B3- =1/2(С32+3С12) = 6С AlCl3, Na3PO4
Коэффициент активности зависит от заряда иона, чем больше заряд иона, тем меньше коэффициент активности. Математически зависимость коэффициента активности f от ионной силы m и заряда иона z записывается с помощью формулы Дебая-Хюккеля:
![]() ,
а при m < 0,01
,
а при m < 0,01
![]()
Коэффициенты активности ионов можно определить с помощью следующей таблицы:
|
Z |
|
0 |
0,001 |
0,005 |
0,01 |
0,05 |
0,1 |
0,2 |
|
1 |
f |
1 |
0,96 |
0,92 |
0,90 |
0,81 |
0,78 |
0,70 |
|
2 |
|
1 |
0,86 |
0,72 |
0,63 |
0,44 |
0,33 |
0,24 |
|
3 |
|
1 |
0,73 |
0,51 |
0,39 |
0,15 |
0,08 |
0,02 |
Пример. Найти активности ионов в 0,025М CuSO4.
Решение: =0,1; f(Cu2+) = f(SO42-) = 0,33;
a(Cu2+) = a(SO42-) = 0,0250,33 = 8,2510-3M.
