
Литература
1. Практические работы по физической химии/ Под ред. К.П.Мищенко, А.А.Равделя, А.М.Пономаревой.-Л.: Химия, 1982.-С. 87-102.
2. Физическая химия/ Под ред. К. С. Краснова.-М.: Высшая школа, 1982.-С. 383-400.
Работа № 12
ТЕРМИЧЕСКИЙ АНАЛИЗ СПЛАВОВ ДВУХКОМПОНЕНТНОЙ СИСТЕМЫ
Целью работы является построение диаграммы плавкости системы из несмешивающихся в твердом состоянии компонентов и не образующих химического соединения. Построение диаграммы производится методом термического анализа на основании изучения термограмм охлаждения расплавов различных составов.
1. Теоретическая часть
Диаграммами плавкости называют диаграммы состояния двухкомпонентных систем для частного случая ТВ. ЖИДК. Поскольку изменение внешнего давления даже в довольно широких пределах лишь очень слабо влияет на температуры плавления и кристаллизации индивидуальных веществ и их сплавов, диаграммы плавкости обычно строят при постоянном давлении в координатах "температура состав". Каждая точка диаграммы, называемая фигуративной точкой, отражает условия, при которых находится система (температура и состав), а также ее агрегатное состояние (жидкая, твердая, гомогенная, гетерогенная). Диаграммы плавкости строят на основании опытных данных. Наиболее распространенным является метод термического анализа, основанный на наблюдении за скоростью охлаждения расплавленных чистых веществ и их сплавов различного состава. В зависимости от свойств, компоненты могут смешиваться друг с другом как в жидком, так и твердом состояниях, образуя, соответственно, жидкие и твердые растворы, могут растворяться в жидком и не растворяться в твердом состоянии, а также обладать ограниченной растворимостью, то есть смешиваться в определенных пределах. Для простоты далее будут рассматриваться лишь системы, компоненты которых неограниченно растворимы друг в друге в жидком, расплавленном состоянии.
 1.1.
Диаграммы плавкости систем, компоненты
которых не образуют химических соединений
и нерастворимы друг в друге в твердом
состоянии (неизоморфные системы).
1.1.
Диаграммы плавкости систем, компоненты
которых не образуют химических соединений
и нерастворимы друг в друге в твердом
состоянии (неизоморфные системы).
Рис.1.
Диаграмма плавкости двухкомпонентной
системы из компонентов A
и B,
нерастворимых друг в друге в твердом
состоянии и не образующих химического
соединения
![]() и
и
![]() это температуры плавления (кристаллизации)
чистых компонентов A и B. На этой,
как и на любой другой диаграмме плавкости,
имеются два графика, которые делят
плоскость всей диаграммы на четыре
области. Каждая отдельная область
диаграммы соответствует местоположению
фигуративных точек для систем, имеющих
агрегатное состояние, обозначенное на
рис.1.
это температуры плавления (кристаллизации)
чистых компонентов A и B. На этой,
как и на любой другой диаграмме плавкости,
имеются два графика, которые делят
плоскость всей диаграммы на четыре
области. Каждая отдельная область
диаграммы соответствует местоположению
фигуративных точек для систем, имеющих
агрегатное состояние, обозначенное на
рис.1.
График abc называется линией ликвидуса.
Линия ликвидуса это график зависимости температуры начала кристаллизации системы от ее состава, и в то же время зависимости состава расплава от температуры.
График adec называется линией солидуса.
Линия солидуса это график зависимости температуры полного затвердевания системы от ее состава, и в то же время график зависимости состава твердой фазы (кристаллов) от температуры.
Анализ диаграмм плавкости можно проводить, строя термограммы охлаждения (зависимости температуры системы от времени при ее охлаждении) для расплавов различного состава. Пример такого анализа приведен на рис.2.
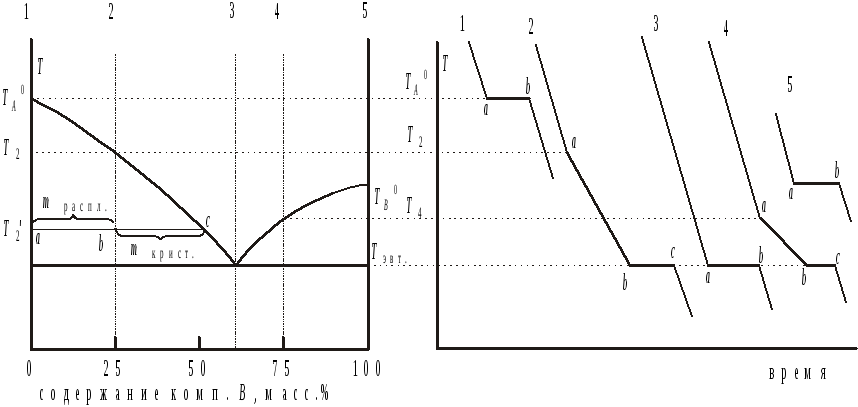
Рис.2. Диаграмма плавкости и соответствующие ей термограммы охлаждения для системы из нерастворимых друг в друге и не образующих химических соединений компонентов A и B (диаграмма с простой эвтектикой).
Термограмма охлаждения расплава индивидуального компонента A (состав № 1, содержащий 0 % компонента B) состоит из трех отдельных участков:
-
Первый участок охлаждение расплава (одна фаза) до температуры
 ,
то есть до точки (a) на термограмме,
система моновариантна
С = К Ф + 1 = 1
1 + 1 = 1. Это означает, что температура
является независимой переменной, а
состав жидкой фазы
величина постоянная (100% компонента
A,0% компонента В).
,
то есть до точки (a) на термограмме,
система моновариантна
С = К Ф + 1 = 1
1 + 1 = 1. Это означает, что температура
является независимой переменной, а
состав жидкой фазы
величина постоянная (100% компонента
A,0% компонента В). -
При температуре
 появляются первые кристаллы компонента
A, система становится двухфазной
(расплав + кристаллы) и поэтому инвариантной
(число степеней свободы равно нулю): С
= К Ф + 1 = 1
2 + 1 = 0. Это означает, что число независимых
переменных, описывающих систему, равно
нулю. Температура становится постоянной
величиной до тех пор, пока в системе
сосуществуют две фазы, то есть до момента
времени, соответствующего точке (b),
когда закристаллизуется последняя
капля расплава. С этого момента времени
система становится однофазной (только
твердая фаза) и число независимых
переменных становится равным единице
С = К Ф + 1 = 1
1 + 1 = 1.
появляются первые кристаллы компонента
A, система становится двухфазной
(расплав + кристаллы) и поэтому инвариантной
(число степеней свободы равно нулю): С
= К Ф + 1 = 1
2 + 1 = 0. Это означает, что число независимых
переменных, описывающих систему, равно
нулю. Температура становится постоянной
величиной до тех пор, пока в системе
сосуществуют две фазы, то есть до момента
времени, соответствующего точке (b),
когда закристаллизуется последняя
капля расплава. С этого момента времени
система становится однофазной (только
твердая фаза) и число независимых
переменных становится равным единице
С = К Ф + 1 = 1
1 + 1 = 1. -
После момента времени, соответствующего точке (b), система остывает, поскольку ее температура становится независимой переменной.
Термограмма охлаждения расплава 2 (25% компонента B) состоит из четырех участков:
-
До температуры
 (точка (a) термограммы № 2) расплав
охлаждается в соответствии с законом
Ньютона. Число независимых переменных
равно двум: С = К Ф
+ 1 = 2 1 + 1 = 2. Температура
и состав расплава
независимые переменные.
(точка (a) термограммы № 2) расплав
охлаждается в соответствии с законом
Ньютона. Число независимых переменных
равно двум: С = К Ф
+ 1 = 2 1 + 1 = 2. Температура
и состав расплава
независимые переменные. -
При температуре
 появляются первые кристаллы индивидуального
компонента A и скорость охлаждения
системы уменьшается из-за выделения
теплоты его кристаллизации. Система
становится двухфазной и число независимых
переменных, описывающих систему,
уменьшается на единицу С = К
Ф + 1 = 2 2 + 1 = 1.
Температура остается независимой
переменной, но состав расплава теперь
зависит от температуры. При температуре
появляются первые кристаллы индивидуального
компонента A и скорость охлаждения
системы уменьшается из-за выделения
теплоты его кристаллизации. Система
становится двухфазной и число независимых
переменных, описывающих систему,
уменьшается на единицу С = К
Ф + 1 = 2 2 + 1 = 1.
Температура остается независимой
переменной, но состав расплава теперь
зависит от температуры. При температуре
 система состоит из расплава, состав
которого определяется точкой пересечения
ноды с линией ликвидуса и кристаллов
компонента A. Правило
рычага позволяет вычислить относительные
массы твердой и жидкой фаз. При температуре
система состоит из расплава, состав
которого определяется точкой пересечения
ноды с линией ликвидуса и кристаллов
компонента A. Правило
рычага позволяет вычислить относительные
массы твердой и жидкой фаз. При температуре
 :
:
![]() (рис.2).
(рис.2).
По мере охлаждения состав расплава приближается к эвтектическому и в момент времени соответствующий точке (b) состав расплава становится равным эвтектическому.
-
Из расплава эвтектического состава продолжают выпадать кристаллы компонента A и появляются кристаллы компонента B. Число фаз становится равным трем (расплав эвтектического состава + кристаллы компонента A + кристаллы B) и система становится инвариантной: С = К Ф + 1 = 2 3 + 1 = 0. Температура остается постоянной до момента времени соответствующего точке (c), когда исчезает последняя капля расплава, то есть до момента полного ее затвердевания.
-
После полного затвердевания системы она становится двухфазной (кристаллы A + кристаллы B) и моновариантной: С = К Ф + 1 = 2 2 + 1 = 1. Температура вновь становится независимой переменной (составы твердых фаз постоянные величины), и после момента времени соответствующего точке (c), система начинает охлаждаться в соответствии с законом Ньютона.
Термограмма № 3 для эвтектического состава состоит из трех участков:
-
На первом участке охлаждение расплава до температуры
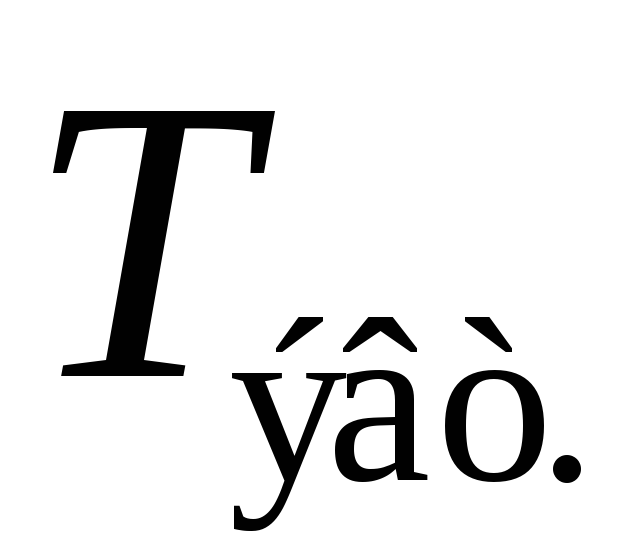 ,
то есть до момента времени, соответствующего
точке (a), происходит
в соответствии с законом Ньютона.
Система однофазна и дивариантна (см.
ранее).
,
то есть до момента времени, соответствующего
точке (a), происходит
в соответствии с законом Ньютона.
Система однофазна и дивариантна (см.
ранее). -
По достижении
 из расплава начинают выпадать как
кристаллы компонента A, так и
кристаллы компонента B. Система
становится трехфазной и инвариантной.
Температура перестает меняться со
временем до полного затвердевания
системы.
из расплава начинают выпадать как
кристаллы компонента A, так и
кристаллы компонента B. Система
становится трехфазной и инвариантной.
Температура перестает меняться со
временем до полного затвердевания
системы. -
После окончания кристаллизации система становится двухфазной (кристаллы A + кристаллы B) и моновариантной.
Термограмма № 4 имеет вид аналогичный
термограмме № 2, только по достижении
температуры начала кристаллизации (![]() )
из расплава начинают выпадать кристаллы
компонента B.
)
из расплава начинают выпадать кристаллы
компонента B.
Термограмма № 5 для чистого компонента B совершенно аналогична термограмме охлаждения № 1 для чистого компонента A.
1.2. Диаграммы плавкости систем, компоненты которых нерастворимы друг в друге в твердом состоянии и образуют химическое соединение, плавящееся без разложения.
Такие диаграммы представляют собой комбинацию из двух простейших диаграмм систем А – АmВn и АmВn – B, где АmВn – химическое соединение, образуемое компонентами.

Рис. 2. Диаграмма плавкости для двухкомпонентной системы из компонентов, нерастворимых друг в друге и образующих химическое соединение, плавящееся без разложения: I тв.A + расплав; II тв.AmBn + расплав; III тв.AmBn + расплав; IV тв.B + расплав
Анализ таких диаграмм проводится аналогично рассмотренному в предыдущем разделе. В зависимости от состава системы из расплава при охлаждении может кристаллизоваться компонент А, компонент В или их соединение АmВn.
1.3. Диаграммы плавкости систем, компоненты которых нерастворимы друг в друге в твердом состоянии и образуют химическое соединение, плавящееся с разложением.
Особенность
химического соединения АmВn
состоит в том, что при нагревании его
до температуры
![]() ,
которая ниже температуры плавления,
оно распадается на жидкий расплав и
кристаллы компонента В.
,
которая ниже температуры плавления,
оно распадается на жидкий расплав и
кристаллы компонента В.

Рис. 3. Диаграмма плавкости двухкомпонентной системы из компонентов, образующих химическое соединение, плавящееся с разложением: I тв.A + расплав; II тв.AmBn + расплав; III тв.B + расплав.
1.4. Диаграммы плавкости для двухкомпонентных систем, компоненты которых частично растворимы в твердом состоянии.
Диаграммы плавкости этого типа отличаются от диаграмм с простой эвтектикой наличием участков, соответствующих твердым растворам компонентов друг в друге. Кроме линии ликвидуса и линии солидуса на таких диаграммах имеются графики зависимости составов насыщенных твердых растворов компонентов друг в друге от температуры. Их положение на диаграммах определяется взаимной растворимостью друг в друге и тем, растет или уменьшается растворимость с температурой. Из расплава при температуре начала кристаллизации выпадает не индивидуальный компонент А или В, а кристаллы твердого раствора, состав которого определяется точкой пересечения соответствующей ноды с линией солидуса. Из расплава эвтектического состава выпадает одновременно две твердые фазы – кристаллы насыщенного раствора А в В и кристаллы насыщенного раствора В в А.

Рис. 4. Диаграммы плавкости систем с частичной растворимостью компонентов в твердом состоянии. При большой разнице в температурах плавления компонентов (а) и при близких температурах плавления (б ): I тв.р-р B в A; II тв.р-р B в A + расплав; III тв.р-р A в B + расплав; IV тв.р-р A в B
1.5. Диаграммы плавкости двухкомпонентных систем из неограниченно растворимых друг в друге компонентов.
Системы не образующие эвтектических составов кристаллизуются и плавятся при температурах, промежуточных между температурами плавления чистых компонентов (рис. 5). При образовании эвтектических составов температуры плавления и кристаллизации в таких системах могут быть выше и ниже температур плавления индивидуальных компонентов (рис. 6).
Согласно первому правилу Гиббса-Розебума, расплав по сравнению с твердой фазой, находящейся с ним в равновесии, обогащен компонентом, добавление которого в систему вызывает понижение температуры начала ее кристаллизации. По второму правилу в точках минимума и максимума на зависимостях температуры кристаллизации от состава системы твердый раствор и равновесный с ним расплав имеют одинаковые составы.
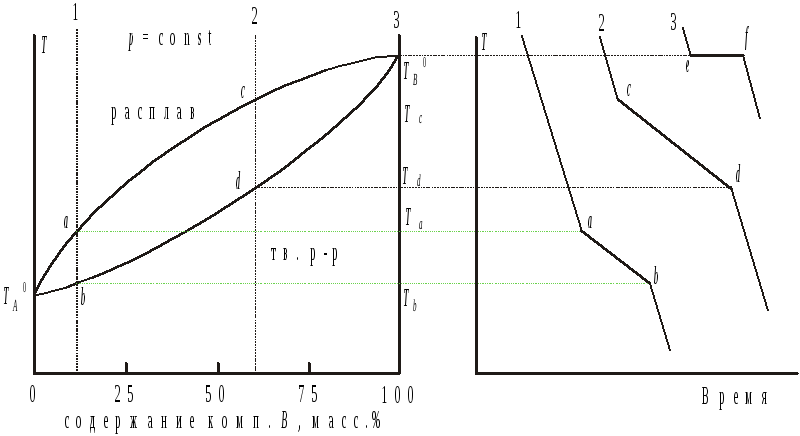
Рис. 5. Диаграмма плавкости для двухкомпонентной системы из компонентов неограниченно растворимых друг в друге и соответствующие ей термограммы охлаждения

Рис. 6. Диаграммы плавкости систем из неограниченно растворимых друг в друге компонентов, образующих эвтектические составы: I расплав + твердый раствор; II расплав + твердый раствор.
2. Построение диаграммы плавкости двухкомпонентной системы с простой эвтектикой
Для построения диаграммы необходимо определить температуры начала и окончания кристаллизации для нескольких составов, равномерно распределенных в интервале от 0 до 100% содержания каждого компонента. Определение этих температур проще всего проводить путем построения термограмм охлаждения расплавов известного состава. Для измерения температуры сплавов могут использоваться как термометры, так и термопары.
2.1. Устройство и принцип действия термопары

φ хол. φ гор.
Рис. 7. Схема термопары
При соединении между собой двух различных металлов, имеющих различную работу выхода электрона, между ними возникает скачок потенциала, называемый контактный потенциалом (φ). Если в гальваническую цепь включить навстречу друг другу два таких соединения (спая), суммарная ЭДС цепи окажется равной нулю при одинаковых температурах спаев. Если температуры спаев различны, ЭДС термопары становится отличной от нуля и тем больше, чем больше разница температур спаев.
Для
измерений с помощью термопары, температуру
одного из спаев поддерживают постоянной,
помещая его в стакан с водой или тающим
льдом (холодный спай), а другой спай
(горячий) погружают в расплав, температуру
которого необходимо измерить. Поскольку
зависимость ЭДС от разницы в температурах
спаев, а значит и от температуры горячего
спая является линейной, для градуировки
термопары достаточно измерить ЭДС
термопары при температурах плавления
чистых компонентов
![]() и
и
![]() ,
которые берут из справочника. Величины
ЭДС, соответствующие температурам
плавления чистых компонентов, получают
из термограмм охлаждения их расплавов
(ЭДС, соответствующие «площадкам» на
термограммах охлаждения). В дальнейшем
температура горячего спая определяется
путем измерения ЭДС и нахождения
соответствующей величины
,
которые берут из справочника. Величины
ЭДС, соответствующие температурам
плавления чистых компонентов, получают
из термограмм охлаждения их расплавов
(ЭДС, соответствующие «площадкам» на
термограммах охлаждения). В дальнейшем
температура горячего спая определяется
путем измерения ЭДС и нахождения
соответствующей величины
![]() по линейному калибровочному графику
зависимости ЭДС от температуры,
построенному по двум точкам.
по линейному калибровочному графику
зависимости ЭДС от температуры,
построенному по двум точкам.
2.2. Ход работы, обработка полученных данных
2.2.1. Поставить тигель с одним из образцов в муфельную печь.
2.2.2. После полного расплавления образца тигель специальными щипцами перенести в термостат, в расплав ввести горячий спай термопары, защищенный специальной металлической гильзой и закрыть термостат двустворчатой крышкой.
2.2.3. В муфельную печь поставить следующий тигель.
2.2.4. После того, как показания милливольтметра достигнут максимума и начнут снижаться, включить секундомер и снимать показания милливольтметра через каждые 30 с, занося полученные данные в табл. 1. Первоначальные показания милливольтметра не должны быть менее ~18 мВ для чистого свинца и ~16 мВ для других образцов. Наблюдения проводить до достижения ~6.8 мВ для сплавов из двух компонентов и до получения отчетливой "площадки" и снижающихся показаний милливольтметра для индивидуальных компонентов.
2.2.6. После окончания опыта термопару аккуратно извлечь из гильзы, тигель перенести на асбестовую пластину, а в термостат поставить тигель со следующим о6разцом и повторить измерения.
2.2.7. Построить термограммы охлаждения в координатах ЭДС время.
2.2.7. Построить градуировочную прямую, используя термограммы охлаждения для индивидуальных компонентов и справочные данные по температурам их плавления.
2.2.9. По градуировочной прямой определить температуры начала и окончания кристаллизации для трех составов. Построить диаграмму плавкости, объединив данные, полученные двумя студентами.
Таблица 1
-
Номер образца,
состав, масс.%
Номер образца,
состав, масс.%
Номер образца,
состав, масс.%
Номер образца,
состав, масс.%
Время, мин
ЭДС, мВ
Время, мин
ЭДС, мВ
Время, мин
ЭДС, мВ
Время, мин
ЭДС, мВ
Контрольные вопросы к теме "Термический анализ сплавов двухкомпонентной системы":
1. Понятия: фаза, компонент, параметр системы.
2. Вывод и применение правила фаз Гиббса.
3. Анализ диаграмм плавкости систем с простой эвтектикой, с образованием устойчивого и неустойчивого химического соединения, систем из частично и полностью растворимых друг в друге компонентов.
4. Устройство и принцип действия термопары, построение градуировочного графика по термограммам охлаждения расплавов индивидуальных компонентов.
5. Построение диаграмм плавкости по термограммам охлаждения.
