
Литература
1. Практические работы по физической химии / Под ред. К.П. Мищенко,А.А. Равделя, А.М. Пономаревой.-Л.: Химия, 1982.С. 3137, 4043, 6169.
2. Физическая химия / Под ред. К.С.Краснова. -М.: Высшая школа, 1982. С. 326336.
Работа № 11
ИССЛЕДОВАНИЕ РАВНОВЕСИЯ ЖИДКОСТЬ ПАР В ДВУХКОМПОНЕНТНОЙ СИСТЕМЕ
Целью работы является построение диаграммы жидкость пар для двухкомпонентной системы из неограниченно смешивающихся компонентов.
1. Теоретическая часть
1.1. Идеальные и неидеальные растворы. Закон Рауля, закон Генри
Растворами называются гомогенные системы, состоящие не менее чем из двух компонентов. Обычно компонент, находящийся в избытке по сравнению с другими называют растворителем, остальные компоненты называют растворенными веществами. Растворы могут быть газовыми, жидкими и твердыми. Если один из компонентов раствора является жидкостью, а другие газами или твердыми веществами, растворителем считают жидкость.
Если насыщенный пар находится в равновесии с раствором, состоящим из двух летучих компонентов (1 и 2), то его давление равно сумме парциальных давлений компонентов в паре:
![]() .
.
Согласно закону Рауля, парциальное давление компонента в насыщенном паре пропорционально его мольной доле в жидкости:
![]() и
и
![]() ,
,
где
![]() и
и
![]()
давление насыщенного пара над чистыми
компонентами 1 и 2, соответственно;
давление насыщенного пара над чистыми
компонентами 1 и 2, соответственно;
![]() и
и
![]()
мольные доли компонентов в растворе,
причем сумма мольных долей равна единице
(
мольные доли компонентов в растворе,
причем сумма мольных долей равна единице
(![]() ).
).
Закон Рауля можно представить также в виде:
![]() ,
или
,
или
 .
.
Относительное понижение давления пара растворителя (компонент 1) равно мольной доле растворенного вещества (компонент 2).
Общее давление пара также линейно зависит от мольной доли растворенного вещества:
![]()
Зависимости парциальных давлений компонентов над раствором и общего давления пара от состава раствора в данном случае выражаются диаграммой, представленной на рис .1.
Растворы, подчиняющиеся закону Рауля при любых составах, называются идеальными. В идеальных растворах энергии межмолекулярного взаимодействия между любыми молекулами равны друг другу:
![]() .
.
В
связи с этим смешение компонентов при
образовании раствора не сопровождается
выделением или поглощением тепла (![]() ).
Собственные объемы молекул компонентов
идеальных растворов одинаковы, в связи
с чем изменения мольного объема при
смешении компонентов не происходит
(
).
Собственные объемы молекул компонентов
идеальных растворов одинаковы, в связи
с чем изменения мольного объема при
смешении компонентов не происходит
(![]() ),
поэтому объем раствора всегда равен
сумме объемов компонентов. Идеальн
),
поэтому объем раствора всегда равен
сумме объемов компонентов. Идеальн ыми
обычно являются растворы, состоящие из
компонентов, имеющих очень близкие
физико-химические свойства, например
гексан
циклогексан, бензол
толуол, смесь Н2О
и D2O
и т.д. Большинство растворов не является
идеальными. Закон Рауля в случае
неидеальных растворов выполняется лишь
для растворителя и только при низких
концентрациях растворенного вещества,
причем тем точнее, чем более разбавленным
является раствор. Зависимость парциального
давления растворенного вещества
(компонент 2) от мольной доли его в
растворе описывается законом Генри:
ыми
обычно являются растворы, состоящие из
компонентов, имеющих очень близкие
физико-химические свойства, например
гексан
циклогексан, бензол
толуол, смесь Н2О
и D2O
и т.д. Большинство растворов не является
идеальными. Закон Рауля в случае
неидеальных растворов выполняется лишь
для растворителя и только при низких
концентрациях растворенного вещества,
причем тем точнее, чем более разбавленным
является раствор. Зависимость парциального
давления растворенного вещества
(компонент 2) от мольной доли его в
растворе описывается законом Генри:
Рис.1.
Зависимости парциальных давлений
компонентов и общего давления пара над
раствором от его состава
![]() ,
,
где
![]()
коэффициент Генри, который может быть
найден опытным путем. Отклонения от
идеальности обусловлены тем, что энергии
межмолекулярного взаимодействия
компонентов раствора обычно не равны
друг другу:
коэффициент Генри, который может быть
найден опытным путем. Отклонения от
идеальности обусловлены тем, что энергии
межмолекулярного взаимодействия
компонентов раствора обычно не равны
друг другу:
![]() .
.
В
зависимости от соотношения между этими
величинами, при смешении компонентов
тепло либо выделяется, либо поглощается
(![]() ).
Поскольку собственные объемы молекул
компонентов также обычно не одинаковы,
объем неидеального раствора не равен
сумме объемов компонентов
).
Поскольку собственные объемы молекул
компонентов также обычно не одинаковы,
объем неидеального раствора не равен
сумме объемов компонентов
![]() .
.
Зависимости парциальных давлений компонентов и общего давления пара над раствором от его состава для неидеальных растворов выражаются диаграммами, представленными на рис .2.

Рис. 2. Зависимости парциальных давлений компонентов A и B и общего давления насыщенного пара от состава раствора; а) положительные отклонения (например, система бензол ацетон), б) отрицательные отклонения (например, система хлороформ эфир)
Положительные
отклонения от закона Рауля наблюдаются
для растворов, в которых энергии
взаимодействия между молекулами
компонентов меньше, чем энергии
взаимодействия между одинаковыми
молекулами растворителя и растворенного
вещества:
![]() и
и
![]() .
При отрицательных отклонениях наоборот:
.
При отрицательных отклонениях наоборот:
![]() и
и
![]() .
.
1.2. Диаграммы состояния жидкость пар, законы Коновалова
Двухкомпонентные системы полностью характеризуются тремя параметрами: давление, температура и содержание одного из компонентов, поэтому диаграммы состояния таких систем должны быть трехмерными. На практике, однако, чаще всего используют двумерные диаграммы, рассматриваемые либо при постоянном давлении, либо при постоянной температуре.
В качестве примера рассмотрим простейшую диаграмму состояния системы из неограниченно смешивающихся компонентов, рассматриваемую при постоянном давлении (рис .3). Условием гетерогенного равновесия является равенство химических потенциалов компонентов в различных фазах. Для равновесия ЖИДК. ПАР :
![]() и
и
![]() .
.
Если считать раствор идеальным, то химический потенциал компонента такого раствора при данной температуре определяется его мольной долей в растворе:
![]() .
.
Химический потенциал компонента идеального пара определяется его относительным парциальным давлением и, следовательно, мольной долей его в паре:
![]() .
.
При равновесии между раствором и его паром каждому составу раствора соответствует строго определенный состав пара:
![]() ,
,
![]() ,
,
откуда:
![]() ,
,
![]() .
.

Рис.3.
Диаграмма жидкость
пар для двухкомпонентной системы из
неограниченно растворимых друг в друге
компонентов A
и B
![]() ,
,
![]() и, значит (
и, значит (![]() ,
,
![]() ).
При изменении температуры соотношение
между составами жидкой и газовой фаз
меняется. Так, при температуре
).
При изменении температуры соотношение
между составами жидкой и газовой фаз
меняется. Так, при температуре
![]() составу
составу
![]() соответствует состав пара
соответствует состав пара
![]() ,
а при температуре
,
а при температуре
![]() составу
составу
![]() соответствует состав
соответствует состав
![]() (рис.3). Нижний график диаграммы называется
линией жидкости, верхний
линией пара. Область диаграммы, лежащая
между линиями жидкости и пара, соответствует
состояниям системы из двух равновесных
фаз жидкой и
газообразной (кипящая жидкость). Если
фигуративная точка попадает в область
диаграммы выше линии пара, система
является газообразной (одна фаза), если
ниже линии жидкости
система является жидкой и также
однофазной.
(рис.3). Нижний график диаграммы называется
линией жидкости, верхний
линией пара. Область диаграммы, лежащая
между линиями жидкости и пара, соответствует
состояниям системы из двух равновесных
фаз жидкой и
газообразной (кипящая жидкость). Если
фигуративная точка попадает в область
диаграммы выше линии пара, система
является газообразной (одна фаза), если
ниже линии жидкости
система является жидкой и также
однофазной.
Линия жидкости это график зависимости температуры начала кипения системы от ее состава и в то же время график зависимости состава жидкой фазы от температуры. Линия пара это график зависимости температуры полного выкипания системы от ее состава и в то же время это график зависимости состава пара от температуры.
Согласно рис. 3 температуры начала кипения системы и полного ее выкипания являются промежуточными между температурами кипения чистых компонентов. Это наблюдается лишь при сравнительно небольших отклонениях от идеальности, а также для идеальных растворов. При значительных отклонениях от идеальности на линии жидкости, то есть на зависимости температуры начала кипения от состава системы, могут наблюдаться экстремумы максимум или минимум. В этом случае температуры начала кипения системы и температуры ее полного выкипания не являются промежуточными между температурами кипения чистых компонентов (рис. 4).
Согласно первому закону Коновалова увеличение содержания компонента в жидкости приводит к увеличению содержания его в паре.
По второму закону Коновалова пар по сравнению с жидкостью обогащен компонентом, добавление которого к системе приводит к повышению общего давления пара и к соответствующему понижению температуры кипения.
По третьему закону Коновалова состав системы, отвечающий минимуму или максимуму на зависимости температуры кипения от состава, называется азеотропным; для него характерно равенство составов жидкости и равновесного с ней пара.
На различиях в составах жидкости и равновесного с ней пара основан метод разделения смесей летучих компонентов путем фракционной перегонки или ректификации. При фракционной перегонке в дистиллят переводят только часть исходной смеси, кипящей в определенном интервале температур. При этом дистиллят оказывается обогащенным по сравнению с исходной смесью тем компонентом, который понижает температуру ее кипения (по второму закону Коновалова). Последующая фракционная перегонка такого дистиллята приводит к получению еще большего содержания этого компонента в новом дистилляте и так вплоть до получения одного из компонентов с желаемой степенью чистоты. В кубе, в конце концов, остается второй чистый компонент. Разделение азеотропных составов на компоненты путем фракционной перегонки невозможно, поскольку для него состав пара совпадает с составом кипящей жидкости.

Рис.4. Диаграммы состояния жидкость пар для систем из неограниченно смешивающихся компонентов A и B при значительных отклонениях от идеальности (образующих азеотроп); x* азеотропный состав
Диаграммы жидкость пар для систем из ограниченно смешивающихся компонентов имеют вид, представленный на рис.5.

Рис. 5. Диаграмма жидкость пар для систем из ограниченно смешивающихся компонентов A и B: а) при небольшом различии в температурах кипения чистых компонентов; б) при значительной разнице в температурах кипения; x* азеотропный состав
Рис .6. Диаграмма жидкость
пар для систем из несмешивающихся
компонентов.
 иаграммы
жидкость-пар для систем из совершенно
несмешивающихся компонентов имеют вид,
представленный на рис. 6. Из диаграммы
следует, что смесь из нерастворимых
друг в друге компонентов закипает при
температуре ниже температур кипения
чистых компонентов. Это свойство таких
систем используется для перегонки
веществ, разлагающихся при температуре
кипения (перегонка с водяным паром).
иаграммы
жидкость-пар для систем из совершенно
несмешивающихся компонентов имеют вид,
представленный на рис. 6. Из диаграммы
следует, что смесь из нерастворимых
друг в друге компонентов закипает при
температуре ниже температур кипения
чистых компонентов. Это свойство таких
систем используется для перегонки
веществ, разлагающихся при температуре
кипения (перегонка с водяным паром).
1.3. Анализ диаграмм жидкость-пар. Правило рычага
Диаграммы состояния жидкость пар позволяют определить интервалы температур кипения для различных составов системы, определить составы и относительные количества жидкой фазы и равновесного с ней пара при различных условиях (температура и состав системы) и т.д.
Рис.7.
Диаграмма жидкость
пар для двухкомпонентной системы AB
 иченно
растворимых друг в друге компонентов
A и
B (рис.7). Пусть система
характеризуется некоторой фигуративной
точкой с координатами
иченно
растворимых друг в друге компонентов
A и
B (рис.7). Пусть система
характеризуется некоторой фигуративной
точкой с координатами
![]() ,
то есть имеет состав
,
то есть имеет состав
![]() и температуру
и температуру
![]() .
Поскольку правило фаз Гиббса для системы,
находящейся при постоянном давлении
формулируется как
.
Поскольку правило фаз Гиббса для системы,
находящейся при постоянном давлении
формулируется как
С = К Ф + 1
(только один внешний фактор температура), в этой точке система обладает двумя степенями свободы, поскольку она является однофазной (жидкой) и двухкомпонентной:
С
= К
Ф + 1 = 2
1 + 1 = 2. Следовательно, температура и
состав фазы являются независимыми
величинами, которые можно менять
произвольно (изменение температуры не
приводит к изменению состава жидкой
фазы). При нагревании рассматриваемой
системы до температуры
![]() она закипает, появляется вторая фаза
пар состава
она закипает, появляется вторая фаза
пар состава
![]() .
Пар по сравнению с жидкой фазой обогащен
компонентом 1, поскольку его добавление
в систему приводит к уменьшению
температуры кипения. Выше температуры
.
Пар по сравнению с жидкой фазой обогащен
компонентом 1, поскольку его добавление
в систему приводит к уменьшению
температуры кипения. Выше температуры
![]() число фаз равно двум и система становится
моновариантной: С = К
Ф + 1 = 2
2 + 1 = 1. Это означает, что система описывается
теперь лишь одной независимой переменной,
температурой. Вторая переменная
состав жидкой, а значит и газовой фазы
зависит от температуры. Действительно,
при повышении температуры до
число фаз равно двум и система становится
моновариантной: С = К
Ф + 1 = 2
2 + 1 = 1. Это означает, что система описывается
теперь лишь одной независимой переменной,
температурой. Вторая переменная
состав жидкой, а значит и газовой фазы
зависит от температуры. Действительно,
при повышении температуры до
![]() ,
составы жидкой и газовой фаз становятся
равными
,
составы жидкой и газовой фаз становятся
равными
![]() и
и
![]() ,
соответственно. В общем случае составы
фаз, находящихся в равновесии, находят,
проводя через фигуративную точку линию,
параллельную оси ординат до пересечения
с линиями жидкости и пара (см. рис. 7). Эта
линия называется нода.
,
соответственно. В общем случае составы
фаз, находящихся в равновесии, находят,
проводя через фигуративную точку линию,
параллельную оси ординат до пересечения
с линиями жидкости и пара (см. рис. 7). Эта
линия называется нода.
Согласно
правилу рычага мольные количества
жидкости и пара относятся друг к другу
обратно пропорционально отрезкам, на
которые фигуративная точка делит ноду.
Для температуры
![]() :
:
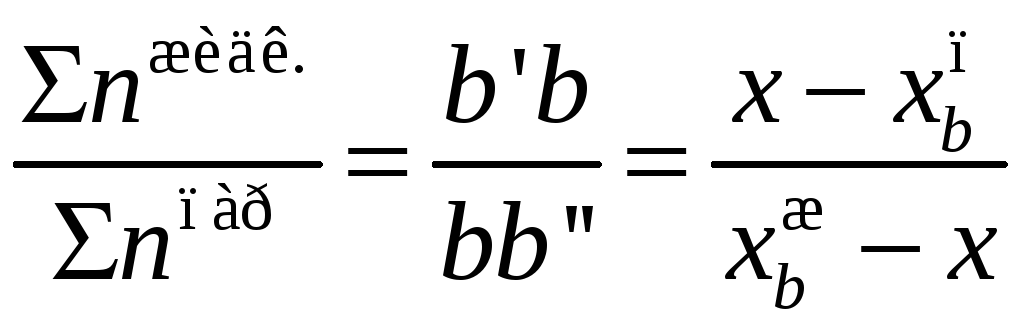 .
.
Если состав системы на диаграмме выражен в массовых процентах, отношение отрезков ноды определяет отношение масс жидкой и газовой фаз:
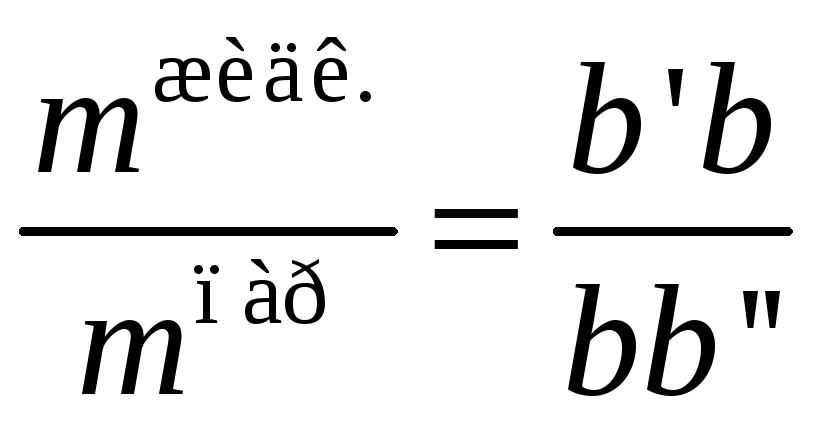
С
увеличением температуры относительное
количество жидкости уменьшается (отрезок
![]() становится меньше), а пара
увеличивается (отрезок
становится меньше), а пара
увеличивается (отрезок
![]() растет). При температуре
растет). При температуре
![]() относительное количество жидкости
становится равным нулю и система
становится полностью газообразной. При
температурах выше
относительное количество жидкости
становится равным нулю и система
становится полностью газообразной. При
температурах выше
![]() система становится однофазной (только
газ) и, следовательно, снова дивариантной.
Из диаграммы на рис.7 следует, что система
состава
система становится однофазной (только
газ) и, следовательно, снова дивариантной.
Из диаграммы на рис.7 следует, что система
состава
![]() выкипает в интервале от
выкипает в интервале от
![]() до
до
![]() .
Чистые компоненты полностью выкипают
при строго определенных температурах
.
Чистые компоненты полностью выкипают
при строго определенных температурах
![]() и
и
![]() ,
поскольку однокомпонентные двухфазные
системы инвариантны: С = К
Ф + 1 = 1
2 + 1 = 0 (температура системы не меняется,
пока в ней сосуществуют две фазы
жидкая и газовая). Системы азеотропного
состава также полностью выкипают при
строго определенной температуре,
,
поскольку однокомпонентные двухфазные
системы инвариантны: С = К
Ф + 1 = 1
2 + 1 = 0 (температура системы не меняется,
пока в ней сосуществуют две фазы
жидкая и газовая). Системы азеотропного
состава также полностью выкипают при
строго определенной температуре,
![]() (рис.4), поскольку для них составы жидкой
и газовой фаз одинаковы (
(рис.4), поскольку для них составы жидкой
и газовой фаз одинаковы (![]() )
и число уравнений, связывающих концентрации
компонентов, увеличивается на единицу.
Поэтому правило фаз для этого случая
записывается как С = К
Ф + 1
1. По этой причине кипящая система
азеотропного состава (два компонента
и две фазы) инвариантна: С = К
Ф + 1
1 = 2
2 + 1
1 = 0. При этом и температура и составы
фаз являются величинами постоянными
вплоть до полного выкипания системы
(до тех пор, пока Ф = 2).
)
и число уравнений, связывающих концентрации
компонентов, увеличивается на единицу.
Поэтому правило фаз для этого случая
записывается как С = К
Ф + 1
1. По этой причине кипящая система
азеотропного состава (два компонента
и две фазы) инвариантна: С = К
Ф + 1
1 = 2
2 + 1
1 = 0. При этом и температура и составы
фаз являются величинами постоянными
вплоть до полного выкипания системы
(до тех пор, пока Ф = 2).
2. Построение диаграммы жидкость пар для двухкомпонентной системы
Для построения диаграммы необходимо определить температуры кипения чистых компонентов, температуры начала кипения нескольких смесей и определить как их состав, так и состав равновесного с ними пара.
Рис.8.
Прибор Свентославского
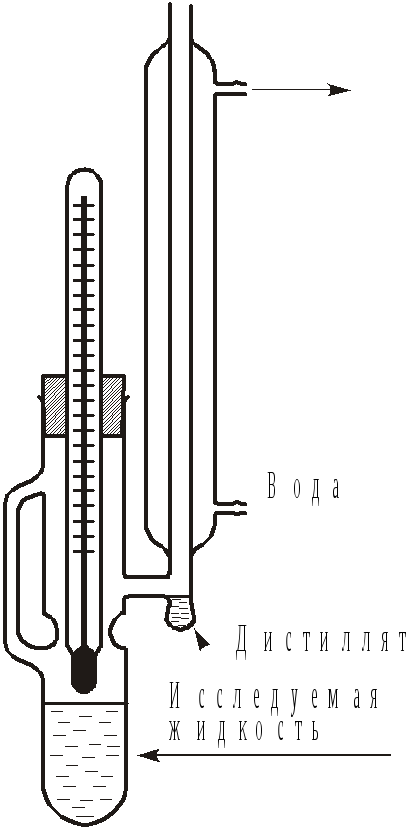 .1.
Определение температур кипения чистых
компонентов и температур начала кипения
их смесей. Температуры кипения жидкостей
удобно определять с помощью прибора
Свентославского (рис. 8). Прибор состоит
из сосуда, соединенного с обратным
холодильником, в котором конденсируется
пар, образующийся при кипении жидкости,
заполняющей нижнюю часть прибора.
Температуру пара измеряют термометром,
укрепленным в верхней части сосуда с
помощью пробки. Под обратным холодильником
находится небольшая по объему емкость,
заполняемая дистиллятом, имеющим состав
пара, равновесного с кипящей жидкостью.
Поскольку отношение массы кипящей
жидкости к массе дистиллята достаточно
велико (отрезок
.1.
Определение температур кипения чистых
компонентов и температур начала кипения
их смесей. Температуры кипения жидкостей
удобно определять с помощью прибора
Свентославского (рис. 8). Прибор состоит
из сосуда, соединенного с обратным
холодильником, в котором конденсируется
пар, образующийся при кипении жидкости,
заполняющей нижнюю часть прибора.
Температуру пара измеряют термометром,
укрепленным в верхней части сосуда с
помощью пробки. Под обратным холодильником
находится небольшая по объему емкость,
заполняемая дистиллятом, имеющим состав
пара, равновесного с кипящей жидкостью.
Поскольку отношение массы кипящей
жидкости к массе дистиллята достаточно
велико (отрезок
![]() много больше отрезка
много больше отрезка
![]() ,
см. рис.7), измеренная температура
достаточно близка к температуре начала
кипения (
,
см. рис.7), измеренная температура
достаточно близка к температуре начала
кипения (![]() ,
рис.7). Из этой емкости проба дистиллята
может быть отобрана для установления
ее состава. После отбора пробы температура
кипения не должна измениться более чем
на 0.5С.
,
рис.7). Из этой емкости проба дистиллята
может быть отобрана для установления
ее состава. После отбора пробы температура
кипения не должна измениться более чем
на 0.5С.
2.2. Определение составов жидкой и равновесной с ней газовой фаз. Состав смеси двух компонентов может быть определен путем измерения для нее показателя преломления, который линейно зависит от состава, выраженного в объемных долях (объемных процентах). Для определения состава смеси измеряют показатели преломления чистых компонентов и по двум точкам строят линейный график зависимости показателя преломления системы от ее состава, выраженного в объемных процентах (рис. 9).

Рис. 9. Зависимость показателя преломления смеси компонентов A и B от ее состава, выраженного в объемных процентах. (Для смесей CHCl3 – CCl4 компонентом В является четыреххлористый углерод, показатель преломления которого выше).
Измеряя показатель преломления жидкости неизвестного состава и дистиллята, имеющего состав равновесного с ней пара, по графику "показатель преломления состав", рис. 9, находят состав как кипящей жидкости (по показателю преломления жидкости), так и равновесного с ней пара (по показателю преломления дистиллята).
2.3. Ход работы и обработка полученных данных:
2.3.1. В аппарат Свентославского залить индивидуальный компонент (по заданию CHCl3 или CCl4).
2.3.2. Поставить аппарат в колбонагреватель, включить колбонагреватель, пустить воду в обратный холодильник.
2.3.3. C помощью рефрактометра определить показатели преломления индивидуального компонента и трех заданных смесей. Результаты измерений внести в табл. 1.
2.3.4. После установления постоянной температуры записать температуру кипения индивидуального компонента.
2.3.5. Слить индивидуальный компонент в бутыль для отходов, высушить прибор и залить в него исследуемую смесь (по заданию). Измерить температуру начала ее кипения, как указано выше, и записать в табл. 1.
2.3.6. Измерить показатель преломления дистиллята, отобрав его пробу на стекло рефрактометра, записать в табл. 1.
2.3.7. Аналогично определить температуры начала кипения и показатели преломления дистиллятов для всех остальных смесей (согласно заданию). Занести полученные данные в табл.1.
Таблица 1
|
Номер образца |
Температура начала кипения |
Показатель преломления |
Состав, объемные проценты CCl4 (рис. 9). |
|
||||||||
|
жидкости |
дистиллята |
в жидкости |
в паре |
|
||||||||
|
|
чистый комп. |
|
|
|
|
|
||||||
|
|
1 |
|
|
|
|
|
||||||
|
|
2 |
|
|
|
|
|
||||||
|
|
3 |
|
|
|
|
|
||||||
2.3.8. Пользуясь калибровочным графиком, по показателям преломления исследуемых смесей и соответствующих им дистиллятов определить составы жидкости и пара в объемных процентах CCl4. Результаты записать в табл. 1.
2.3.9. Построить диаграмму жидкость пар, откладывая по оси ординат температуру начала кипения, а по оси абсцисс состав жидкости и пара в объемных долях (объемных процентах), объединяя результаты работы двух студентов. Если студент работает один, он определяет температуры кипения и показатели преломления обоих индивидуальных компонентов, а также температуры начала кипения и показатели преломления жидкости и соответствующего ей дистиллята для трех смесей.
Контрольные вопросы к теме "Диаграмма состояния жидкость пар в двухкомпонентной системе"
1. Способы выражения состава растворов.
2. Идеальные и неидеальные растворы. Закон Рауля, закон Генри.
3. Диаграммы состояния жидкость-пар для двухкомпонентных систем из неограниченно растворимых друг в друге компонентов, ограниченно растворимых и нерастворимых друг в друге компонентов.
4. Анализ диаграмм жидкость пар.
5. Правило фаз Гиббса, законы Коновалова.
6. Фракционная перегонка, ректификация.
7. Определение состава двухкомпонентной системы по показателю преломления.
8. Построение диаграмм жидкость-пар для двухкомпонентных систем.
