
МИНИСТЕРСТВО КУЛЬТУРЫ РОССИЙСКОЙ ФЕДЕРАЦИИ
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
«САНКТ-ПЕТЕРБУРГСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
КИНО И ТЕЛЕВИДЕНИЯ»
Кафедра общей, органической и физической химии
ФИЗИЧЕСКАЯ ХИМИЯ
Методические указания по выполнению лабораторных
работ для студентов специальности 240504.
"Технология кинофотоматериалов и магнитных носителей"
дневного и заочного отделений.
Часть II. Гетерогенные равновесия.
Санкт-Петербург
2010
Составитель: Л.Л. Кузнецов
Рецензент: В.В. Митрофанов
Рекомендовано к изданию в качестве методических указаний по лабораторному практикуму по физической химии кафедрой общей, органической и физической химии.
Протокол заседания кафедры общей, органической и физической химии
№ 17 от 1 июля 2010 г.
СПбГУКиТ 2010 г.
ТЕОРЕТИЧЕСКОЕ ВВЕДЕНИЕ
1. Условия равновесия в гетерогенной системе, условия самопроизвольности протекания термодинамических процессов
Термодинамической системой называют рассматриваемую часть окружающего мира, отделенную от других его частей реальными или мнимыми границами. То, что находится за пределами этих границ называется окружающей средой.
Составляющим веществом термодинамической системы называют вещество, которое может быть выделено из нее и существовать отдельно. Компонентами термодинамической системы называют составляющие вещества, концентрацию которых можно менять произвольно. Число компонентов термодинамической системы равно числу составляющих веществ минус число химических реакций между ними. При отсутствии химических реакций число компонентов равно числу составляющих веществ, то есть все составляющие вещества являются компонентами термодинамической системы.
Фазой называется часть термодинамической системы, отделенная от других частей границами раздела и имеющая в каждой своей точке одинаковый состав и свойства.
Гетерогенными называются термодинамические системы, состоящие как минимум из двух фаз и имеющие по крайней мере одну поверхность раздела. Такие системы могут состоять из одного или нескольких составляющих веществ, способных как химически реагировать между собой, так и переходить через поверхность раздела из одной фазы в другую.
В качестве примера рассмотрим простейшую систему, состоящую из жидкости и ее насыщенного пара. Пусть она находится при постоянном объеме в закрытом сосуде. Термодинамические свойства системы, такие как температура, давление пара, состав фаз, не меняются во времени, хотя молекулы составляющих веществ непрерывно переходят из жидкой фазы в газовую и обратно (ограничимся случаем, когда химические реакции между составляющими веществами не протекают). Такое состояние системы называется равновесным. При увеличении температуры системы молекулы составляющих веществ начнут с большей скоростью переходить из жидкой фазы в газовую, масса жидкой фазы будет уменьшаться во времени, газовой фазы увеличиваться, давление будет расти, будет меняться и состав фаз. Такое самопроизвольное изменение свойств системы называется термодинамическим процессом. Этот процесс протекает до наступления нового равновесия, характеризующегося своими значениями температуры, давления, составов фаз. Рассмотрим, что является движущей силой любых самопроизвольно протекающих термодинамических процессов, в том числе и описанного процесса испарения жидкости в закрытом сосуде.
Математическое выражение второго начала термодинамики для неравновесных, самопроизвольно протекающих процессов имеет вид:
![]()
![]() .
.
Для
адиабатических, протекающих без
теплообмена с окружающей средой процессов
в изолированной системе, для которых
![]() ,
условие самопроизвольности формулируется
как
,
условие самопроизвольности формулируется
как
![]() .
Следовательно, в изолированной системе
самопроизвольно протекают процессы,
приводящие к увеличению ее энтропии
(S).
.
Следовательно, в изолированной системе
самопроизвольно протекают процессы,
приводящие к увеличению ее энтропии
(S).
Условие самопроизвольности для неадиабатических процессов легко получается при совместном решении математических выражений первого и второго начал термодинамики. Если ограничиться процессами, в которых единственной работой является работа расширения против сил внешнего давления, математическое выражение первого начала термодинамики может быть записано следующим образом:
![]() .
.
Первое начало термодинамики гласит: теплота, получаемая системой, расходуется на увеличение ее внутренней энергии (на нагревание) и на совершение системой работы.
Если
подставить в выражение для первого
начала термодинамики значение
![]() из второго начала термодинамики, для
самопроизвольных процессов можно
получить:
из второго начала термодинамики, для
самопроизвольных процессов можно
получить:
![]() ,
или
,
или
![]()
Для
изобарно-изотермических условий (![]() это выражение можно переписать как
это выражение можно переписать как
![]() .
Поскольку
.
Поскольку
![]()
изобарно изотермический потенциал, или
энергия Гиббса системы, условие
самопроизвольности протекания процесса
при постоянном давлении и температуре
формулируется как
изобарно изотермический потенциал, или
энергия Гиббса системы, условие
самопроизвольности протекания процесса
при постоянном давлении и температуре
формулируется как
![]() .
Следовательно, в изобарно-изотермических
условиях самопроизвольно протекают
процессы, приводящие к уменьшению
энергии Гиббса системы.
.
Следовательно, в изобарно-изотермических
условиях самопроизвольно протекают
процессы, приводящие к уменьшению
энергии Гиббса системы.
Аналогично
можно показать, что в изохорно-изотермических
условиях (![]() самопроизвольно
протекают процессы, приводящие к
уменьшению энергии Гельмгольца системы,
или ее изохорно-изотермического
потенциала:
самопроизвольно
протекают процессы, приводящие к
уменьшению энергии Гельмгольца системы,
или ее изохорно-изотермического
потенциала:
![]() ,
или
,
или
![]() и, поскольку
и, поскольку
![]() это энергия Гельмгольца системы, то
условие самопроизвольности протекания
процесса формулируется как
это энергия Гельмгольца системы, то
условие самопроизвольности протекания
процесса формулируется как
![]() .
Аналогично легко показать, что в общем
случае самопроизвольными
являются
процессы, приводящие к уменьшению
соответствующего термодинамического
потенциала системы:
.
Аналогично легко показать, что в общем
случае самопроизвольными
являются
процессы, приводящие к уменьшению
соответствующего термодинамического
потенциала системы:
![]() ;
;
![]() ;
;
![]() ;
;
![]() .
.
Процессы, в ходе которых термодинамические потенциалы растут, самопроизвольно не протекают. Такие процессы могут идти только за счет энергии, поглощаемой из окружающей среды.
Условием равновесия является минимально возможное в данных условиях постоянное значение соответствующего термодинамического потенциала или максимально возможное и постоянное значение энтропии системы:
![]() ;
;
![]() ;
;
![]() ;
;
![]() ;
;
![]() и, соответственно
и, соответственно
![]()
Таким образом, перемещение части молекул составляющих веществ из жидкой фазы в газовую в рассмотренном примере испарения происходит за счет уменьшения изохорно-изотермического потенциала системы, то есть ее свободной энергии подобно тому как самопроизвольное скатывание шарика по наклонной плоскости происходит за счет уменьшения его потенциальной энергии.
Весьма важной характеристикой компонента системы является его химический потенциал. Химическим потенциалом компонента называют изменение соответствующего термодинамического потенциала системы при добавлении в нее одного моля данного компонента при неизменном количестве других компонентов:
 .
.
Другими словами, химический потенциал это энергия одного моля вещества при данном составе системы и данных условиях. Для идеального газа химический потенциал определяется его физико-химической природой, температурой и давлением:
![]() Дж/моль
(для идеальных газов),
Дж/моль
(для идеальных газов),
где
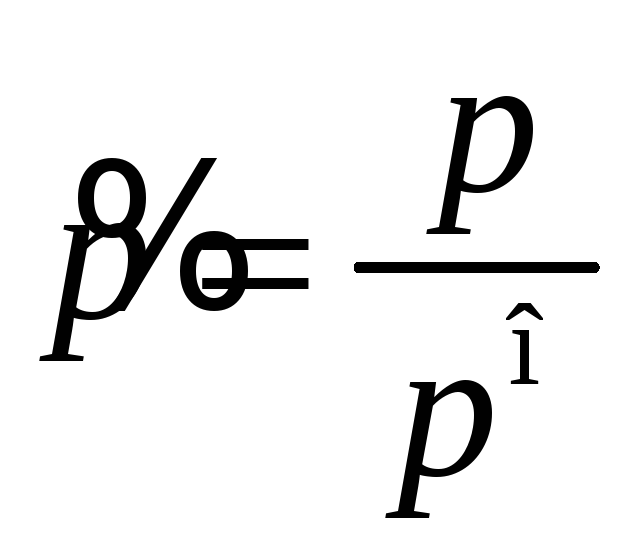
относительное безразмерное давление
газа, показывающее во сколько раз
давление газа
относительное безразмерное давление
газа, показывающее во сколько раз
давление газа
![]() отличается от стандартного давления
отличается от стандартного давления
![]() .
В качестве стандартного выбрано
.
В качестве стандартного выбрано
![]() =
1 атм = 760 мм.рт.ст. = 1.0133105
Па;
=
1 атм = 760 мм.рт.ст. = 1.0133105
Па;
![]()
стандартный химический потенциал,
равный энергии 1 моля данного вещества
при температуре
стандартный химический потенциал,
равный энергии 1 моля данного вещества
при температуре
![]() и стандартном давлении
и стандартном давлении
![]() .
.
Химический потенциал индивидуальных конденсированных веществ (жидкостей или твердых веществ) всегда равен стандартному потенциалу:
![]() Дж/моль
(для жидкостей и твердых веществ).
Дж/моль
(для жидкостей и твердых веществ).
Химический
потенциал неидеальных газов вычисляется
так же как и для идеальных, но вместо
относительного давления в выражение
подставляют относительную фугитивность,
равную произведению давления
![]() на коэффициент активности
на коэффициент активности
![]() ,
который зависит от степени отклонения
свойств газа от свойств идеального
газа:
,
который зависит от степени отклонения
свойств газа от свойств идеального
газа:
![]() Дж/моль
(для неидеальных газов),
Дж/моль
(для неидеальных газов),
где
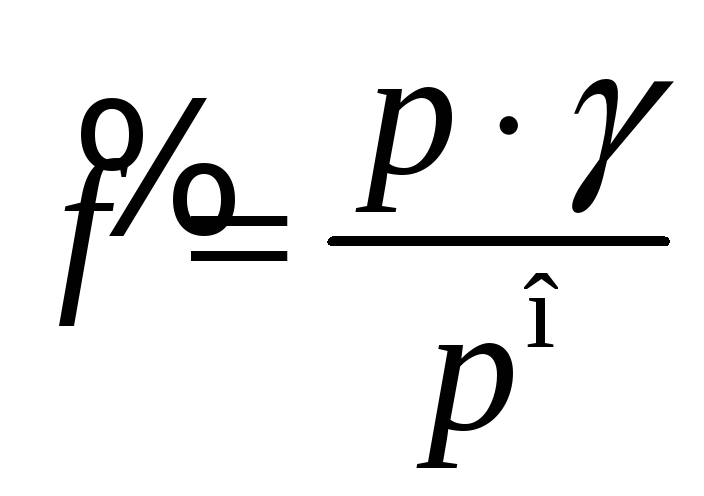
относительная фугитивность неидеального
газа.
относительная фугитивность неидеального
газа.
Химический потенциал компонента
идеальной газовой смеси зависит не от
общего давления системы
![]() ,
а от парциального давления данного
компонента
,
а от парциального давления данного
компонента
![]() , где
, где
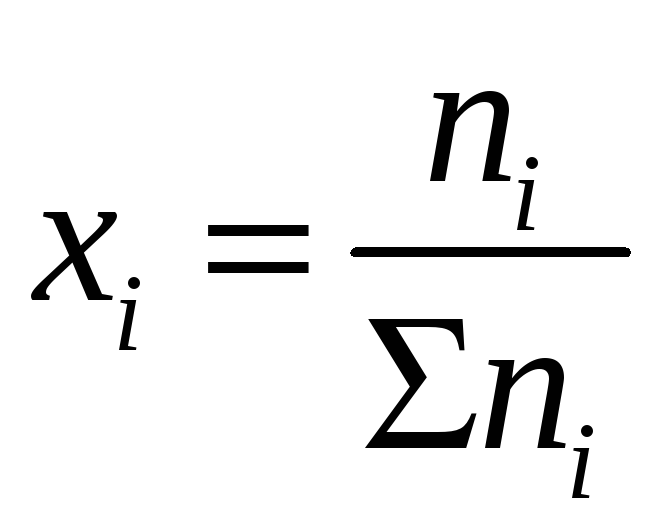 мольная доля
компонента в смеси:
мольная доля
компонента в смеси:
![]() Дж/моль
(для идеальной газовой смеси),
Дж/моль
(для идеальной газовой смеси),
где
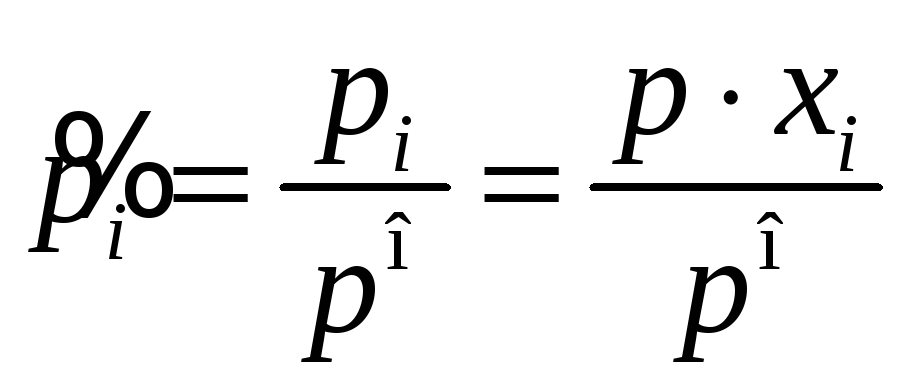 ,
а
,
а
![]()
энергия одного моля компонента при
величине его мольной доли
энергия одного моля компонента при
величине его мольной доли
![]() =1,
то есть чистого вещества при давлении
=1,
то есть чистого вещества при давлении
![]() .
.
Соответствующее выражение для компонента неидеальной газовой смеси отличается от выражения для компонента идеальной смеси наличием коэффициента активности, то есть поправкой на неидеальность:
![]() Дж/моль
(для неидеальной газовой смеси),
Дж/моль
(для неидеальной газовой смеси),
где
![]() .
.
Химический потенциал компонента жидкого или твердого идеального раствора зависит от физико-химической природы компонента и содержания его в смеси:
![]() Дж/моль
(для идеального раствора),
Дж/моль
(для идеального раствора),
где
![]()
энергия одного моля чистого вещества
(когда
энергия одного моля чистого вещества
(когда
![]() =1)
при температуре
=1)
при температуре
![]() .
Содержание компонента в растворе может
быть выражено не только в мольных долях,
но и в любых других единицах, например,
в молях компонента в литре раствора (
.
Содержание компонента в растворе может
быть выражено не только в мольных долях,
но и в любых других единицах, например,
в молях компонента в литре раствора (![]() моль/л), или в молях компонента в килограмме
растворителя (
моль/л), или в молях компонента в килограмме
растворителя (![]() моль/кг растворителя), например:
моль/кг растворителя), например:
![]() Дж/моль
(для идеального раствора),
Дж/моль
(для идеального раствора),
где
![]()
энергия одного моля вещества при
концентрации его в растворе равной 1
моль/л и температуре
энергия одного моля вещества при
концентрации его в растворе равной 1
моль/л и температуре
![]() .
.
Для
неидеальных растворов вместо мольной
доли компонента или его концентрации
в других единицах приходится использовать
так называемую активность,
равную
произведению концентрации на коэффициент
активности (![]() ),
который равен единице в идеальном
растворе и отличается от единицы в
неидеальном растворе:
),
который равен единице в идеальном
растворе и отличается от единицы в
неидеальном растворе:
![]() Дж/моль
(для неидеального раствора),
Дж/моль
(для неидеального раствора),
где
![]() ,
,
![]() ,
,
![]() и т.д.
и т.д.
Поскольку
равновесие в гетерогенной системе
является динамическим и молекулы
составляющих веществ непрерывно
переходят из одной фазы в другую и
обратно, постоянство во времени
термодинамических потенциалов системы
имеет одно весьма важное следствие.
Рассмотрим переход
![]() молей составляющего вещества из жидкой
фазы в газовую. Если этот переход
происходит в условиях равновесия при
постоянном объеме и температуре, энергия
Гельмгольца жидкой фазы уменьшится на
молей составляющего вещества из жидкой
фазы в газовую. Если этот переход
происходит в условиях равновесия при
постоянном объеме и температуре, энергия
Гельмгольца жидкой фазы уменьшится на
![]() ,
а энергия газовой фазы увеличится на
,
а энергия газовой фазы увеличится на
![]() .
Суммарное изменение энергии Гельмгольца
системы при равновесии равно нулю:
.
Суммарное изменение энергии Гельмгольца
системы при равновесии равно нулю:
![]() +
+
![]() =
0, но поскольку
=
0, но поскольку
![]()
![]() ,
то в равновесии химические потенциалы
любого компонента в жидкой и газовой
фазах оказываются равными друг другу:
,
то в равновесии химические потенциалы
любого компонента в жидкой и газовой
фазах оказываются равными друг другу:
![]()
![]() .
В общем случае химические потенциалы
компонента, находящегося в разных фазах,
при равновесии равны между собой:
.
В общем случае химические потенциалы
компонента, находящегося в разных фазах,
при равновесии равны между собой:
![]() и
т.д.
и
т.д.
![]() и
т.д.
и
т.д.
![]() и
т.д.
и
т.д.
и т.д. для всех остальных компонентов.
Эта система равенств называется химическим условием гетерогенного равновесия. Поскольку любое изменение температуры или давления, меняющее значения химических потенциалов, приводит к установлению нового равновесия, очевидно, что изменения химических потенциалов составляющих веществ в разных фазах также равны между собой:
![]() и
т.д.
и
т.д.
![]() и
т.д.
и
т.д.
![]() и
т.д.
и
т.д.
и т.д. для всех остальных компонентов.
Если
химический потенциал компонента в
какой-либо фазе, например в жидкой,
больше, чем в газовой, самопроизвольно
протекает переход компонента в фазу, в
которой его потенциал меньше, то есть
в газовую. При этом энергия системы
уменьшается:
![]()
![]() +
+
![]() <
0. По мере перехода вещества в газовую
фазу его химический потенциал в жидкой
фазе уменьшается за счет уменьшения
содержания его в растворе, а в газовой
растет из-за увеличения его парциального
давления. Как только потенциалы
сравняются, переход вещества прекратится
и наступит равновесие.
<
0. По мере перехода вещества в газовую
фазу его химический потенциал в жидкой
фазе уменьшается за счет уменьшения
содержания его в растворе, а в газовой
растет из-за увеличения его парциального
давления. Как только потенциалы
сравняются, переход вещества прекратится
и наступит равновесие.
2. Правило фаз Гиббса
Правило фаз устанавливает число параметров, то есть независимых переменных, описывающих термодинамическую систему. Число независимых переменных равно общему числу переменных минус число уравнений, их связывающих. Пусть термодинамическая система находящаяся в равновесии состоит из (К) компонентов (число составляющих веществ минус число химических реакций между ними) и (Ф) фаз, причем каждый компонент присутствует во всех фазах. Для описания состава такой системы необходимо указать содержание не всех, а (К1) компонента в каждой фазе (содержание последнего компонента однозначно определяется содержанием остальных). Всего, следовательно, (К1)Ф значений концентраций. Если из внешних условий на систему влияют только температура и давление, общее число переменных, описывающих систему, становится равным (К1)Ф + 2. Не все они, однако, являются независимыми, поскольку из химического условия равновесия для первого компонента следует:
![]() ,
,
![]() ,
,
![]() ,
,
![]() и т.д., всего (Ф-1) равенств.
и т.д., всего (Ф-1) равенств.
Эти равенства связывают не только химические потенциалы, но и концентрации, поскольку химические потенциалы зависят от концентраций первого компонента во всех фазах. Такое же число уравнений связывает концентрации всех остальных компонентов. Поскольку число компонентов в системе равно К, общее число таких уравнений составляет (Ф1)К, а число параметров, описывающих систему, называемое числом степеней свободы, равно разности:
С = (К1)Ф + 2 (Ф1)К, или
С = К Ф + 2.
Это соотношение и носит название правила фаз.
Если из внешних условий на систему влияет, например, только температура, а давление остается постоянным, общее число переменных, описывающих систему, становится равным (К1)Ф + 1, а правило фаз принимает вид:
С = К Ф + 1.
В общем случае, когда на систему влияет n переменных, правило фаз формулируется как:
С = К Ф + n.
РАБОТА № 10
ИССЛЕДОВАНИЕ РАВНОВЕСИЯ ЖИДКОСТЬ ПАР В ОДНОКОМПОНЕНТНОЙ СИСТЕМЕ
Целью работы является экспериментальное определение зависимости давления насыщенного пара над жидкостью от температуры для индивидуального вещества и вычисление термодинамических характеристик процесса его испарения.
1. Теоретическая часть
1.1. Уравнение Клаузиуса-Клапейрона
Рассмотрим
гетерогенную систему, находящуюся в
равновесии при данной температуре и
давлении (![]() ,
,
![]() ).
Условием равновесия такой системы
является постоянство во времени ее
изобарно-изотермического потенциала:
).
Условием равновесия такой системы
является постоянство во времени ее
изобарно-изотермического потенциала:
![]() .
.
Поскольку
изобарно-изотермическим потенциалом
называется выражение
![]() ,
его полный
дифференциал имеет вид:
,
его полный
дифференциал имеет вид:
![]() .
(1)
.
(1)
В то же время объединенное выражение первого и второго начал термодинамики для равновесных процессов записывается как:
![]() ,
или
,
или
![]() .
(2)
.
(2)
Совместное решение этих двух уравнений, то есть подстановка dU из (2) в выражение (1) дает зависимость энергии Гиббса системы от температуры и давления:
![]() .
.
Условием
равновесия является
равенство
изменения химических потенциалов
компонента в равновесных фазах с
изменением температуры или давления
![]() .
Это равноценно условию
.
Это равноценно условию
![]() ,
поскольку в рассматриваемой однокомпонентной
системе химический потенциал равен
мольной энергии Гиббса компонента.
Следовательно:
,
поскольку в рассматриваемой однокомпонентной
системе химический потенциал равен
мольной энергии Гиббса компонента.
Следовательно:
![]() ,
,
где
![]() и
и
![]()
мольные энтропии, а
мольные энтропии, а
![]() и
и
![]()
мольные объемы компонента в фазах I и
II, соответственно. Отсюда:
мольные объемы компонента в фазах I и
II, соответственно. Отсюда:
![]() ,
или
,
или
![]() .
.
Для равновесных процессов изменение энтропии равно приведенной теплоте:
![]() ,
,
где ΔН – теплота перехода одного моля компонента из фазы I в фазу II при температуре Т. Окончательно связь между давлением и температурой гетерогенной системы, находящейся в равновесии, называемая уравнением Клаузиуса-Клапейрона, принимает вид:
![]() ,
,
где
![]()
теплота перехода одного моля компонента
из фазы I в фазу II, а
теплота перехода одного моля компонента
из фазы I в фазу II, а
![]()
температура, при которой этот переход
происходит.
температура, при которой этот переход
происходит.
Рассмотрим
обратимый переход компонента из жидкой
фазы в газовую. Теплота перехода в данном
случае равна мольной теплоте испарения,
температура перехода является температурой
кипения,
![]()
мольный объем пара, а
мольный объем пара, а
![]()
мольный объем жидкости. Поскольку
мольный объем пара много больше мольного
объема жидкости (
мольный объем жидкости. Поскольку
мольный объем пара много больше мольного
объема жидкости (![]() >>
>>![]() ),
уравнение Клаузиуса-Клапейрона для
равновесия ЖИДК.
ПАР
принимает
вид:
),
уравнение Клаузиуса-Клапейрона для
равновесия ЖИДК.
ПАР
принимает
вид:
![]() .
.
Если
считать пар идеальны газом, то
![]() и,
окончательно:
и,
окончательно:
![]() . (3)
. (3)
Испарение
протекает с поглощением тепла (![]() ),
поэтому
),
поэтому
![]() .
Следовательно, с повышением температуры
давление насыщенного пара, то есть пара,
находящегося в равновесии с жидкостью
растет, и тем быстрее, чем больше теплота
испарения ΔНиспар..
.
Следовательно, с повышением температуры
давление насыщенного пара, то есть пара,
находящегося в равновесии с жидкостью
растет, и тем быстрее, чем больше теплота
испарения ΔНиспар..
Аналогичный
вид имеет уравнение Клаузиуса-Клапейрона
для равновесия ТВ.
ПАР при возгонке. В этом случае
![]() ,
,
![]() ,
а
,
а
![]() ,
причем
,
причем
![]() >>
>>
![]() ,
поэтому:
,
поэтому:
![]() . (4)
. (4)
Возгонка также протекает с поглощением тепла, но поскольку теплота возгонки равна сумме теплот плавления и испарения:
ΔНвозг. = ΔНплавл. + ΔНиспар. , то всегда ΔНвозг. > ΔНиспар. ,
поскольку ΔНплавл. тоже положительна. Следовательно, с ростом температуры давление насыщенного пара над твердой фазой растет с температурой быстрее, чем над жидкой.
В применении к равновесию ТВ. ЖИДК. уравнение Клаузиуса-Клапейрона записывается следующим образом:
![]() . (5)
. (5)
Теплота
плавления
величина положительная, поэтому знак
производной давления по температуре
зависит от того, увеличивается или
уменьшается мольный объем вещества при
плавлении. Для большинства веществ
![]() (при плавлении объем вещества растет,
а плотность уменьшается) и для них
наблюдается увеличение температуры
плавления с ростом давления, однако
плавление воды, висмута, галлия и
некоторых других веществ сопровождается
уменьшением объема и ростом плотности.
Для них
(при плавлении объем вещества растет,
а плотность уменьшается) и для них
наблюдается увеличение температуры
плавления с ростом давления, однако
плавление воды, висмута, галлия и
некоторых других веществ сопровождается
уменьшением объема и ростом плотности.
Для них
![]() ,
разность
,
разность
![]() оказывается отрицательной и производная
оказывается отрицательной и производная
![]() имеет знак минус. Следовательно,
температура их плавления с ростом
давления уменьшается. Знак
имеет знак минус. Следовательно,
температура их плавления с ростом
давления уменьшается. Знак
![]() для превращений одной кристаллической
модификации в другую, то есть для
равновесий ТВ.
ТВ. зависит как от знака
для превращений одной кристаллической
модификации в другую, то есть для
равновесий ТВ.
ТВ. зависит как от знака
![]() перехода, так и от соотношения мольных
объемов кристаллических модификаций
перехода, так и от соотношения мольных
объемов кристаллических модификаций
![]() и
и
![]() .
.
1.2. Диаграммы состояния однокомпонентных систем
Рис
.1. Диаграмма состояния однокомпонентной
системы (H2O)
 юбая
однокомпонентная система характеризуется
давлением, температурой и мольным
объемом. Поскольку независимыми являются
только две переменные, а третья (обычно
объем) находится из уравнения состояния,
диаграммы для однокомпонентных систем
получают, откладывая значения температуры
системы и ее давления по двум
перпендикулярным осям. Каждая точка
диаграммы, называемая фигуративной
точкой, выражает условия, при которых
находится система, а также ее состояние.
Такие диаграммы включают три отдельные
области, отвечающие условиям существования
трех отдельных фаз
твердой, жидкой и газообразной (рис. 1).
Любая фигуративная точка в области
существования одной из фаз, например,
точка (а) на рис.1. соответствует однофазной
системе, в данном случае газу. Поскольку
число фаз равно единице, система обладает
двумя степенями свободы: С = К
Ф + 2 = 1
1 + 2 = 2. Это означает, что давление и
температура в этих условиях являются
независимыми переменными и произвольное
изменение как температуры, так и давления,
возможно без изменения числа фаз.
юбая
однокомпонентная система характеризуется
давлением, температурой и мольным
объемом. Поскольку независимыми являются
только две переменные, а третья (обычно
объем) находится из уравнения состояния,
диаграммы для однокомпонентных систем
получают, откладывая значения температуры
системы и ее давления по двум
перпендикулярным осям. Каждая точка
диаграммы, называемая фигуративной
точкой, выражает условия, при которых
находится система, а также ее состояние.
Такие диаграммы включают три отдельные
области, отвечающие условиям существования
трех отдельных фаз
твердой, жидкой и газообразной (рис. 1).
Любая фигуративная точка в области
существования одной из фаз, например,
точка (а) на рис.1. соответствует однофазной
системе, в данном случае газу. Поскольку
число фаз равно единице, система обладает
двумя степенями свободы: С = К
Ф + 2 = 1
1 + 2 = 2. Это означает, что давление и
температура в этих условиях являются
независимыми переменными и произвольное
изменение как температуры, так и давления,
возможно без изменения числа фаз.
Линия ОК, на диаграмме разделяющая области существования газовой и жидкой фаз, представляет собой местоположение точек, соответствующих равновесию между жидкостью и паром, то есть является графиком зависимости давления насыщенного пара над жидкостью от температуры. Эта зависимость описывается уравнением Клаузиуса-Клапейрона для равновесия ЖИДК. ГАЗ (3). Любая фигуративная точка, лежащая на линии ОК, например, точка (б) на рис.1 соответствует двухфазной системе, состоящей из жидкости и ее насыщенного пара (кипящая жидкость). Такая система характеризуется лишь одной степенью свободы: С = К Ф + 2 = 1 2 + 1 = 1. Это означает, что в условиях сосуществования двух фаз независимо меняется только один параметр либо давление, либо температура. Вторая переменная меняется в зависимости от изменения параметра в соответствии с уравнением Клаузиуса-Клапейрона (3). Так, с ростом температуры неизбежно увеличивается давление насыщенного пара, а с ростом давления над жидкостью увеличивается температура ее кипения.
Линия ОВ на диаграмме, (рис .1) является графиком зависимости давления насыщенного пара над твердой фазой от температуры. Математически эта зависимость выражается уравнением для равновесия ТВ. ГАЗ (4). В любой фигуративной точке на линии ОВ система также моновариантна, то есть число степеней свободы в этих условиях равно единице. При произвольном изменении температуры давление насыщенного пара над твердой фазой меняется в соответствии с уравнением (4).
Линия ОА является графиком зависимости температуры плавления вещества от давления. Эта зависимость описывается уравнением (5) и в любой ее точке система также моновариантна. Произвольное изменение давления приводит к соответствующему изменению температуры плавления.
Точка (О) на диаграмме соответствует сосуществованию всех трех фаз и называется тройной точкой. Число степеней свободы в этой точке равно нулю: С = К Ф + 2 = 1 3 + 2 = 0. Система в этих условиях инвариантна. Любое изменение температуры или давления неизбежно вызывает исчезновение одной или двух фаз.
2. Изучение зависимости давления насыщенного пара от температуры
Зависимость
давления насыщенного пара над жидкой
фазой от температуры выражается
уравнением (3). В интегральной форме эта
зависимость получается после разделения
переменных и интегрирования, считая
![]() величиной постоянной (в достаточно
широком интервале температур пренебрегать
зависимостью ее от температуры нельзя):
величиной постоянной (в достаточно
широком интервале температур пренебрегать
зависимостью ее от температуры нельзя):
![]()
![]() .
.
Значение
постоянной интегрирования находится
из условия
![]() при
при
![]()
температура кипения при стандартном
давлении (
температура кипения при стандартном
давлении (![]() )
называется нормальной температурой
кипения (
)
называется нормальной температурой
кипения (![]() ).
Следовательно:
).
Следовательно:
![]() ,
,
поскольку
![]()
изменение энтропии при испарении одного
моля вещества при стандартном давлении
и нормальной температуре кипения. Если
подставить вместо константы интегрирования
ее значение, можно получить интегральную
форму зависимости давления насыщенного
пара над жидкостью от температуры в
форме:
изменение энтропии при испарении одного
моля вещества при стандартном давлении
и нормальной температуре кипения. Если
подставить вместо константы интегрирования
ее значение, можно получить интегральную
форму зависимости давления насыщенного
пара над жидкостью от температуры в
форме:
![]() ,
или
,
или
![]() ,
,
Рис.2.
Зависимость давления насыщенного пара
над жидкостью от температуры.
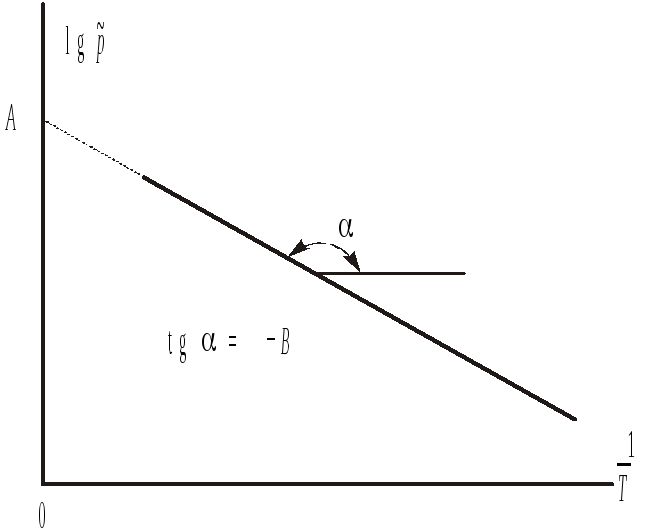 де
де
![]()
относительное безразмерное давление
насыщенного пара,
относительное безразмерное давление
насыщенного пара,
![]() ,
а
,
а
![]() .
Таким образом, зависимость давления
насыщенного пара от температуры является
линейной в координатах
.
Таким образом, зависимость давления
насыщенного пара от температуры является
линейной в координатах
![]() (рис .2). Экспериментальным путем эта
зависимость может быть получена
несколькими способами. Для жидкостей
средней летучести обычно применяют
динамический метод, основанный на том,
что давление насыщенного пара над
жидкостью при температуре ее кипения
равно внешнему давлению, поскольку
любая жидкость закипает
при той температуре, при которой давление
насыщенного пара над ней становится
равным внешнему давлению.
Зависимость между
(рис .2). Экспериментальным путем эта
зависимость может быть получена
несколькими способами. Для жидкостей
средней летучести обычно применяют
динамический метод, основанный на том,
что давление насыщенного пара над
жидкостью при температуре ее кипения
равно внешнему давлению, поскольку
любая жидкость закипает
при той температуре, при которой давление
насыщенного пара над ней становится
равным внешнему давлению.
Зависимость между
![]() и
и
![]() получают, доводя жидкость до кипения
при различных значениях внешнего
давления и определяя температуры кипения
соответствующие давлению. В этом случае
независимой переменной оказывается
внешнее давление, а зависимой
температура кипения. Из наклона графика
получают, доводя жидкость до кипения
при различных значениях внешнего
давления и определяя температуры кипения
соответствующие давлению. В этом случае
независимой переменной оказывается
внешнее давление, а зависимой
температура кипения. Из наклона графика
![]() получают мольную теплоту испарения:
получают мольную теплоту испарения:
![]() ,
(6)
,
(6)
а из отсекаемого отрезка мольную энтропию испарения:
![]() .
(7)
.
(7)
3. Описание установки
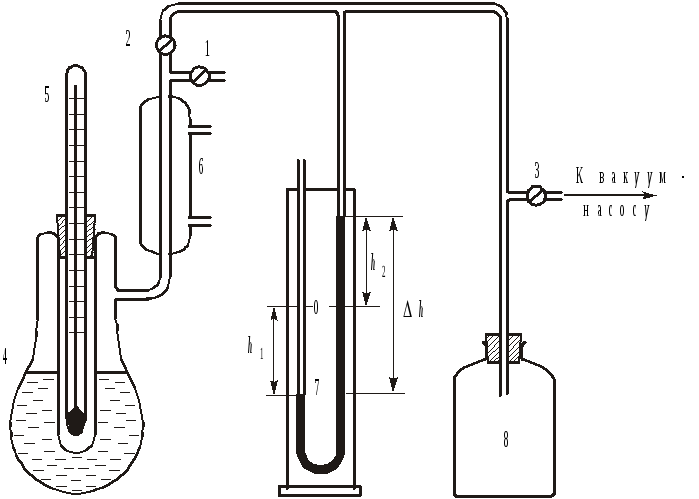
Рис. 3. Схема установки: 1, 2, 3 краны; 4 парообразователь; 5 термометр; 6 обратный холодильник; 7 ртутный манометр; 8 демпферный сосуд.
Установка
для определения температур кипения
жидкости при различных значениях
внешнего давления состоит из
парообразователя (4) с обратным
холодильником (6), ртутного манометра
(7) и демпферного сосуда (8), играющего
роль маностата. С помощью нагревателя
жидкость в парообразователе доводится
до кипения. Образующийся пар конденсируется
в обратном холодильнике и стекает
обратно в парообразователь. Разрежение
в установке создается с помощью масляного
вакуумного насоса, подключаемого через
кран 3. Изменение давления производится
сообщением системы с атмосферой с
помощью крана 1. Поскольку манометр
является открытым, разность уровней
ртути в коленах показывает превышение
атмосферного давления над давлением в
системе:
![]() ,
откуда давление в системе легко
определяется как:
,
откуда давление в системе легко
определяется как:
![]() .
.
4. Ход работы и обработка полученных данных:
4.1. Закрыть краны 1 и 3, открыть кран 2.
4.2. Включить вакуумный насос и дать ему поработать 1-2 мин.
4.3. Открыть кран 3 и довести уровень ртути в правом колене манометра до ~350 мм.
4.4. Закрыть кран 3 и, выключив насос, убедиться в герметичности установки (за 10 мин уровень ртути в манометре не должен упасть более чем на 2 мм.).
4.5. Включить нагреватель и вести наблюдение за температурой по термометру.
4.6.
После закипания жидкости в парообразователе
и установления постоянной температуры
снять показание термометра и значения
уровней ртути в коленах манометра (![]() и
и
![]() ).
Внести данные в та6л. 2.
).
Внести данные в та6л. 2.
4.7. Увеличить давление в системе плавным поворотом крана 1 и кратковременным сообщением системы с атмосферой таким образом, чтобы уровень ртути в правом колене понизился на ~5 мм.
4.8. Дождаться закипания жидкости при новом значении давления и по достижении постоянной температуры внести значения температуры кипения и уровней ртути в табл. 2.
4.9. Как описано в пп. 4.7 и 4.8, провести не менее 15 определений температуры кипения, увеличивая давление в системе, как рекомендуется в табл.1.
Таблица 1
|
Номер определения |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
|
Уменьшить уровень, мм |
0 |
5 |
5 |
10 |
10 |
15 |
15 |
25 |
25 |
30 |
30 |
40 |
40 |
40 |
до 0 |
4.10. Выключить нагреватель, прекратить подачу воды в обратный холодильник.
4.11. Заполнить табл. 2.
Таблица 2
|
№ опыта |
t, °С |
h1, мм |
h2, мм |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Примечание:
*
![]() , T
=
t
+ 273
, T
=
t
+ 273
4.12.
Построить графики зависимости давления
насыщенного пара от температуры в
координатах
![]() и
и
![]() .
.
4.13.
Методом наименьших квадратов вычислить
параметры
![]() и
и
![]() зависимости
зависимости
![]() от
от
![]() и по формулам (6) и (7) вычислить
и по формулам (6) и (7) вычислить
![]() и
и
![]() .
.
Контрольные вопросы к теме: "Равновесие жидкость пар в однокомпонентной системе"
1. Что такое химический потенциал? Чем определяется химический потенциал газа и жидкости?
2. Условия самопроизвольности протекания термодинамических процессов, условия равновесия в гетерогенной системе.
3. Понятия "термодинамическая система", "компонент системы", "составляющее вещество", "параметр системы", "фаза".
4. Вывод уравнения Клаузиуса-Клапейрона и его анализ для различных фазовых равновесий.
5. Диаграмма состояния однокомпонентной системы и ее анализ.
6. Правило фаз Гиббса, его вывод.
7. Определение термодинамических параметров процесса испарения путем исследования зависимости давления насыщенного пара от температуры.
