
Физика. Краткая теория и примеры решения задач. Методическое пособие 2016
..pdf
77. Два источника колебаний, лежащие в точках с координатами х1=0 м х2=10 м, колеблются по одинаковому закону s 0.05sin 16 t (смещение из положения равновесия – в метрах, время – в секундах). Написать уравнение колебаний в точке А, координата которой равна хА=13 м. Скорость распространения волн равна 320 м/с. Волны считать плоскими.
78. Определить разность фаз Δφ колебаний двух точек среды, находящихся на расстоянии l=0.1 м друг от друга, если в среде распространяется плоская волна вдоль линии, соединяющей эти точки. Скорость распространения волны υ=314 м/с, частота колебаний источника
ν=1000 Гц.
79. Два точечных когерентных источника звуковых волн одинаковой мощности находятся в воздухе на расстояниях l1=2.5 м и l2=2.4 м от микрофона. Определить отношение амплитуд результирующего и исходного
колебаний, если длина волны λ=0.3 м. |
|
|
|||
80. |
Для |
звуковой |
волны, |
описываемой |
уравнением |
s10 4 cos(6280 t 19x) , где амплитуда выражена в метрах, круговая частота
–в с-1, волновое число – в м-1, найти: а) скорость распространения волны υ; б) амплитуду скорости частиц среды υmax и её отношение к скорости
распространения волны max ; в) длину волны λ и отношение амплитуды
A
смещения частиц среды к длине волны .
Раздел 2. ГИДРОДИНАМИКА. УПРУГИЕ СВОЙСТВА ТВЁРДЫХ ТЕЛ.
МОЛЕКУЛЯРНАЯ ФИЗИКА. ОСНОВЫ ТЕРМОДИНАМИКИ
Гидродинамика
Объёмный QV и массовый Qm расход жидкости или газа:
QV dVdt S ; Qm dmdt S .
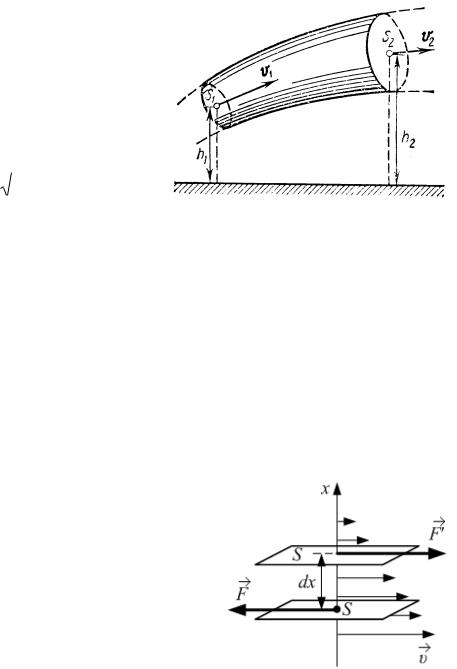
Здесь dV – объём ( dm – масса) газа или жидкости плотностью , протекающий со скоростью за время dt через сечение площадью S трубки тока.
Уравнение неразрывности струи для несжимаемой жидкости или газа:
S1 1 S2 2 ,
где S1 и S2 – площади поперечного сечения трубки тока в двух местах; υ1 и υ2
– соответствующие скорости течений (рис. 2.1).
31
Уравнение Бернулли для идеальной (без вязкости) несжимаемой идеальной жидкости или газа:
|
|
|
|
|
|
|
2 |
|
|
|
|
2 |
|
|
|
2 |
|
|
||||||
|
|
gh |
|
|
|
1 |
p |
gh |
|
|
2 |
p |
, |
или |
gh |
|
p const , |
|||||||
|
|
1 |
|
|
|
2 |
1 |
2 |
2 |
2 |
|
|
|
2 |
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
где |
|
p |
dF |
|
– |
статическое |
давление, |
|
– скорость |
течения, |
p |
gh – |
||||||||||||
|
|
|
|
|||||||||||||||||||||
|
|
|
|
dS |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
г |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
гидростатическое давление; |
h – |
высота |
сечения над некоторым |
уровнем, |
||||||||||||||||||||
pд |
|
|
2 |
|
|
– |
динамическое |
|
давление. |
|
|
|
|
|
|
|
||||||||
2 |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Индексы «1» и «2» относятся к двум |
|
|
|
|
|
|
|
|||||||||||||||||
любым сечениям трубки тока для |
|
|
|
|
|
|
|
|||||||||||||||||
стационарного течения (рис. 2.1). |
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
Скорость истечения жидкости |
|
|
|
|
|
|
|
|||||||||||||||
из малого отверстия в открытом |
|
|
|
|
|
|
|
|||||||||||||||||
широком сосуде: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2gh , |
|
|
|
|
|
|
|
|
|
|
|
||
где h – глубина, на которой находится |
|
|
|
Рис. 2.1 |
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
отверстие |
|
|
относительно |
|
уровня |
|
|
|
|
|
|
|
||||||||||||
жидкости в сосуде. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
Закон Архимеда: на тело, погружённое в жидкость или газ, действует |
||||||||||||||||||||||
выталкивающая сила FАрх. , равная весу вытесненной жидкости (газа): |
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
FАрх. Vпогр. g , |
|
|
|
|
|||||
где Vпогр. – |
объём погружённой |
|
в жидкость |
части |
тела, – |
плотность |
||||||||||||||||||
жидкости (газа).
Формула Ньютона для вязкой жидкости (газа). Сила F вязкого трения, действующая между двумя слоями стационарно текущего газа или жидкости, прямо пропорциональна площади S слоёв и
градиенту |
скорости |
d |
направленного |
||||
|
|
|
|
||||
dx |
|||||||
|
|
|
|||||
движения слоёв (рис. 2.2): |
|
|
|
|
|
||
|
F |
d |
S , |
|
|||
|
|
|
|||||
|
|
|
dx |
|
|||
где η – коэффициент динамической вязкости. |
|||||||
Знак «минус» показывает, что сила вязкости |
|||||||
тормозит слой жидкости, движущийся быстрее. |
|||||||
Формула Пуазейля. Объёмный расход |
|||||||
жидкости |
(газа), протекающей |
через трубку |
|||||
(капилляр) длиной l и радиусом R, на концах |
Рис. 2.2 |
|
|
которой создана разность давлений p : |
|
32

QV R4 p , 8 l
где η – динамическая вязкость (коэффициент внутреннего трения) жидкости (газа).
Кинематическая вязкость:
|
|
, |
|
|
|
|
|
где – динамическая вязкость, – плотность жидкости (газа). |
|||
Число Рейнольдса для потока жидкости (газа) в длинных трубках: |
|||
Re d |
|
d |
, |
|
|||
|
|
|
|
где – средняя по сечению трубки скорость течения жидкости; d – диаметр трубки, – динамическая вязкость, – кинематическая вязкость,
– плотность жидкости (газа).
Число Рейнольдса для шарика диаметром d, движущегося в вязкой
жидкости или газе со скоростью :
Re d d .
Число Рейнольдса Re есть функция скорости тела, линейной величины d, определяющей размеры тела, плотности и динамической вязкости η жидкости, то есть Re f , ,d, . При малых значениях чисел Рейнольдса, меньших некоторого критического значения Reкр. , движение жидкости
является ламинарным (слоистым, без перемешивания). При значениях движение жидкости переходит в турбулентное (вихревое).
Критическое число Рейнольдса для движения шарика в жидкости Reкр. 0.5 ; для потока жидкости в длинных трубках Reкр.
Формула Стокса. Сила сопротивления F, действующая со стороны
|
|
|
вязкой жидкости (или газа) на движущийся в ней со скоростью |
шарик |
|
радиусом r: |
|
|
|
|
|
FС 6 r , |
|
|
где – динамическая вязкость среды. Формула справедлива при ламинарном обтекании шарика.
Упругие свойства твёрдых тел
Относительная продольная деформация при продольном растяжении
(или сжатии) тела:
|| l , l
где l x – абсолютное удлинение, l – начальная длина тела (рис. 2.3).
33
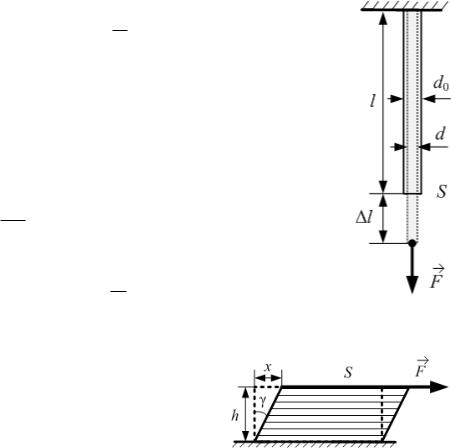
Относительное поперечное сжатие при продольной деформации
(рис.2.3):
d , d0
где d d d0 – изменение диаметра стержня при деформации.
Коэффициент Пуассона материала:
,
||
где || – относительная продольная деформация; – относительное
поперечное сжатие.
Нормальное механическое напряжение:
FS ,
где F – сила, перпендикулярная поперечному сечению тела площадью S (рис. 2.3).
Закон Гука для деформации сжатия-растяжения:
E |
, |
или |
F k l k x . |
|| |
|
|
|
Здесь || – относительное удлинение, E – модуль Юнга материала, k – жёсткость (коэффициент жёсткости), равный для стержня величине k ESl .
Тангенциальное механическое напряжение
F ,
|
|
S |
|
Рис. 2.3 |
|
где F – касательная сила, действующая вдоль слоя тела |
|||||
|
|||||
площадью S (рис. 2.4). |
|
|
|||
Относительная деформация при сдвиге |
|
|
|||
(относительный сдвиг) для малых деформаций |
|
|
|||
(рис. 2.4): |
|
|
|||
tg |
x |
. |
|
|
|
|
|
|
|||
|
h |
Рис. 2.4 |
|
||
Здесь x – абсолютный сдвиг параллельных |
|
||||
|
|
||||
слоев тела относительно друг друга; h – расстояние между слоями.
Закон Гука для деформации сдвига:
G ,
где G – модуль модуль сдвига.
Связь между модулем Юнга E и модулем сдвига G:
G |
E |
|
|
, |
|
2 1 |
||
где – коэффициент Пуассона материала.
34
Закон Гука для деформации кручения:
M Kкр. ,
где М – момент силы, закручивающий однородный круглый стержень на угол φ; Kкр. – постоянная кручения.
Потенциальная энергия растянутого или сжатого стержня
-при однородной деформации:
|
|
|
k ( l)2 |
|
k x2 |
|
|||||||
W |
p |
|
|
|
|
|
|
|
|
|
; |
|
|
|
|
2 |
|
2 |
|
||||||||
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
E 2 |
|
|
|
|
|||
|
|
W |
|
|
|
|
| | |
|
V |
|
|||
|
|
p |
|
|
2 |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- при неоднородной деформации: |
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
Wp wdV , |
|
|||||||||
|
|
|
|
|
|
|
V |
|
|
|
|
||
где l x – абсолютное удлинение; |
k – |
жёсткость; |
Е – модуль Юнга; || – |
||||||||||
относительная продольная деформация; V – объём тела; w – объёмная плотность энергии, равная, по определению, энергии, приходящейся на
единичный объём: w |
dW |
. |
|
|
|
|
|
||
|
dV |
|
|
|
Объёмная плотность энергии упругой деформации |
||||
|
|
|
E 2 |
|
|
|
w |
| | |
, |
|
|
2 |
||
|
|
|
|
|
где Е – модуль Юнга; || – относительная продольная деформация.
Молекулярная физика
Относительная атомная масса элемента (они приводятся в таблице
Д. И. Менделеева) – это масса m |
атома данного элемента, отнесённая к |
1 |
|
||||||||||||||
|
|
|
|||||||||||||||
|
|
|
|
|
a |
|
|
|
|
|
|
|
12 |
|
|||
массы |
m |
атома изотопа углерода 12C : |
|
|
|
|
|
|
|
|
|||||||
|
0C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ar |
|
|
ma |
|
|
|
|
|
|
||
|
|
|
|
|
|
1 |
m |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
12 |
0C |
|
|
|
|
|
|||
|
Относительная молекулярная |
|
масса |
вещества – |
это масса |
m0 |
|||||||||||
|
|
|
|
|
|
|
|
|
|
1 |
массы m0C |
|
|
|
|
||
молекулы данного вещества, отнесённая к |
|
атома изотопа |
|||||||||||||||
12 |
|||||||||||||||||
углерода 12C : |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
M r |
|
|
m0 |
|
, или M r |
ni Ari |
|
|
|
|
|||||
|
|
|
1 |
m |
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
i |
|
|
|
|
|||
|
|
|
12 |
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
0C |
|
|
|
|
|
|
|
|
|
|
||||
35
где ni – число атомов i-го химического элемента, входящего в состав молекулы данного вещества; Ari – относительная атомная масса этого
элемента.
Количество вещества определяется числом структурных элементов (молекул, атомов, ионов и т. п.), содержащихся в системе или теле. Количество вещества выражается в молях ( ). По закону Авогадро, один моль вещества содержит столько же структурных элементов, сколько
содержится атомов в 12 граммах изотопа углерода 12C . Один моль вещества содержит число структурных элементов N, равное числу Авогадро N A .
Количество вещества равно
|
N |
, |
или |
|
m |
, |
|
|
|||||
|
N A |
|
|
|
||
где m – масса тела (системы); – молярная масса (масса моля вещества).
Молярная масса вещества (масса моля):
m N |
|
, или |
|
m |
, |
A |
|
||||
0 |
|
|
|
||
|
|
|
|
||
где m0 – масса одной молекулы; N A – число Авогадро, m – масса вещества,
–количество вещества.
Связь молярной массы с относительной молекулярной массой M r :
M r k ,
где k 10 3 кг / моль .
Масса m вещества равна связана с числом молекул N:
|
m m0 N , |
||||
где m0 |
– масса одной молекулы. |
|
|
|
|
Массовая доля смеси газов: |
|
|
|
|
|
|
|
mi |
|
mi |
, |
|
mi |
|
|||
|
i |
|
m |
||
|
|
|
|||
|
|
i |
|
|
|
где mi |
– масса i-го компонента смеси, |
m mi – масса всей смеси. |
|||
i
Средняя молярная масса смеси газов:
|
|
k |
|
|
|
mi |
|
|
|
i |
, |
|
|||
i |
|
k |
|
|
|
i |
|
|
|
i |
|
где mi – масса, i – количество вещества i-го компонента смеси; k – число компонентов смеси.
36

Уравнение состояния идеального газа (уравнение Менделеева-
Клапейрона) связывает параметры газа – давление |
p, объём V и |
||||
термодинамическую температуру T : |
|
|
|
|
|
p V R T , или |
p V |
m |
R T , или |
p n k T , |
|
|
|||||
|
|
|
|
||
где m – масса газа; – его молярная масса; – количество вещества; R – универсальная газовая постоянная, k – постоянная Больцмана, n – концентрация молекул газа.
Универсальная газовая постоянная R связана с постоянной Больцмана ( N A – число Авогадро):
Rk N A .
Концентрация частиц (молекул, атомов и т. п.) однородной системы – это число частиц в единице объёма:
n VN .
Здесь N – число частиц; V – объём.
Закон Дальтона для смеси газов. Давление p смеси равно сумме парциальных давлений pi всех компонент смеси:
k
p pi ,
i
где k – число компонент смеси.
Основы термодинамики
Первое начало термодинамики. Количество теплоты δQ, сообщённое системе, идёт на приращение её внутренней энергии и dU на работу δA системы против внешних сил:
δQ=dU+δA, |
|
или |
|
Q A U . |
Теплоёмкость тела: |
|
|
|
|
|
C |
тела |
Q |
, |
|
|
dT |
|
|
|
|
|
|
|
где Q – количество теплоты, |
сообщённое |
телу, dT – соответствующее |
||
изменение температуры тела.
Удельная теплоёмкость вещества – это теплоёмкость единицы массы:
c |
Q |
, |
|
||
m dT |
где Q – количество теплоты; m – масса вещества; dT – соответствующее изменение его температуры.
Молярная теплоёмкость вещества – это теплоёмкость одного моля:
37

|
|
|
|
C |
|
Q |
|
|
|
|
Q |
, |
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
dT |
|
m |
|
dT |
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
где |
Q – количество |
теплоты; |
|
|
m |
|
|
– |
|
количество |
вещества; dT – |
||||||||||||
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
соответствующее изменение его температуры. |
|
|
|
|
|
|
|
||||||||||||||||
|
Связь между молярной C и удельной c теплоёмкостями: |
||||||||||||||||||||||
|
|
|
|
|
|
|
C c , |
|
|
|
|
|
|
|
|||||||||
где – молярная масса. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Молярная теплоемкость идеального газа при постоянном объёме |
||||||||||||||||||||||
CV |
и при постоянном давлении CP (по определению): |
|
|
|
|||||||||||||||||||
|
|
Q |
|
dU |
|
|
|
|
|
dU |
|
|
Q |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CV |
|
|
dT |
dT |
|
; CP |
|
. |
||||||||||||||
|
|
T |
|
|
|
|
|
T |
|
|
P |
||||||||||||
|
|
|
V |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Здесь Q – теплота, сообщённая одному молю газа в соответствующем
процессе; dU dU – изменение внутренней энергии одного моля газа; dT –
изменение его температуры.
Степени свободы; число степеней свободы i – это число независимых координат, однозначно определяющих положение тела (или молекулы) в пространстве. Для одноатомных молекул i=3, так как трёх координат (x, y, z) достаточно для того, чтобы однозначно задать положение материальной точки
втрёхмерном пространстве. При температурах, не слишком низких и не слишком высоких, для двухатомных молекул i=5; для многоатомных – i=6
(с учётом вращательных степеней свободы).
Показатель Пуассона (показатель адиабаты) – это отношение теплоёмкости CP при постоянном давлении к теплоёмкости CV при
постоянном объёме (здесь i – число степеней свободы молекул):
CP i 2 .
CV i
Молярные теплоемкости идеального газа при постоянном объёме
CV и постоянном давлении CP можно выразить через число степеней свободы молекулы i или через показатель Пуассона ( R – универсальная газовая постоянная):
C |
|
|
R |
|
, |
или |
C |
|
|
i |
R ; |
|||
|
|
|
|
|
||||||||||
V |
|
|
1 |
|
V |
2 |
|
|
||||||
|
|
|
|
|
|
|
|
|
||||||
CP |
|
R |
, |
или |
CP |
|
i 2 |
R . |
||||||
1 |
|
|||||||||||||
|
|
|
|
|
|
|
|
2 |
|
|
||||
Уравнение Майера
CP CV R .
38
Внутренняя энергия идеального газа
U CV T ,
где m – количество вещества.
Работа, связанная с изменением объёма газа, в общем случае:
|
V2 |
A p dV ; |
A pdV , |
|
V1 |
где V1 – начальный объём газа; V2 – его конечный объём.
Термический коэффициент полезного действия (КПД) в общем случае:
A Q1 Q2 ,
Q1 Q1
где Q1 – количество теплоты, полученное рабочим телом (газом) от нагревателя; Q2
– количество теплоты, переданное рабочим телом охладителю, А – работа за цикл.
КПД цикла Карно (рис. 2.5):
|
Карно |
|
T1 T2 |
, |
|
T1 |
|||||
|
|
|
|||
|
|
|
Рис. 2.5 |
где T1 – температура нагревателя; T2 – температура охладителя.
Энтропия по определению Клаузиуса. Функция состояния системы,
дифференциал dS которой в обратимом процессе равен приведённой теплоте, является энтропией:
dS Q . T
Здесь δQ – теплота, полученная системой; Т – её температура.
Изменение энтропии в общем случае:
S 2 Q ,
1 T
где 1 и 2 – пределы интегрирования, соответствующие начальному и конечному состояниям системы. Так как процесс равновесный, то интегрирование проводится по любому пути.
Изменение энтропии для процессов с идеальным газом (см. также табл. 3):
S CV ln T2 R ln V2 .
T1 V1
Удельная теплота парообразования:
39

L Q , m
где m масса вещества; Q – теплота, необходимая для его испарения.
Таблица 2
Уравнения процессов с идеальным газом, первое начало термодинамики для них, термодинамические величины и их изменения
при этих процессах
Процесс |
T=const |
|
|
|
|
|
|
V=const |
|
|
p=const |
|
|
|
|
|
S=const |
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
Изотерма |
|
|
Изохора |
|
|
Изобара |
|
|
|
|
Адиабата |
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
Уравнение |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
процесса |
|
|
|
|
|
|
|
|
|
|
|
p1 |
|
|
p2 |
|
|
|
|
V1 |
|
|
|
V2 |
|
|
|
|
|
p1V1 |
p2V2 |
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
T V 1 |
||||||||||||||||||||||||
|
p V p V |
|
|
|
|
|
|
|
|
|
|
|
|
T V |
|||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||
|
1 1 |
|
|
2 2 |
|
|
T T |
|
|
T T |
|
|
|
|
1 1 |
|
|
|
|
2 |
2 |
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
2 |
|
|
1 |
|
|
|
|
2 |
|
|
|
|
|
|
1 |
|
|
|
1 |
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T p |
|
|
T p |
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
1 |
|
|
2 |
2 |
|
|
|
|||||||||
Первое начало |
Q A |
|
Q U |
Q A U |
|
|
|
A U |
|
|
|
|
|||||||||||||||||||||||||||||||||||||
термодинамики |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Работа газа |
RT ln |
V |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
p1 V1 |
|
|
|
1 |
|
|||||||||||||||||
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
A |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
p V |
|
|
|
|
|
|
|
|
V1 |
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
V1 |
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
1 |
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R T |
|
|
|
|
V2 |
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
p |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|||||||||||||||||||||
|
RT ln |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R T1 |
|
|
|||||||||||||||||||||
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
p2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V1 |
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 1 V |
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CV T |
|
|
|
|
||||||||||
Изменение |
|
|
|
|
|
|
|
|
|
|
CV T |
|
CV T |
|
|
|
CV T |
|
|
|
|
|
|
|
|||||||||||||||||||||||||
внутренней |
0 |
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
U |
|
|
|
|
|
|
|
|
|
|
1V p |
|
1 p V |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
энергии |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Количество |
RT ln |
V2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
CP T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
теплоты |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
CV T |
|
|
p V |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
Q |
|
|
|
|
V1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
RT ln |
|
p1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
p2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Изменение |
R ln |
V2 |
|
|
|
CV ln |
|
T2 |
|
CP ln |
T2 |
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
||||||||||||||||||
энтропии |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
T1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
V |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
S |
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
p |
|
|
|
|
|
|
|
p2 |
|
|
|
|
|
|
|
V |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
R ln |
|
|
CV ln |
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
1 |
|
|
|
|
|
|
|
P |
ln |
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
p1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
p |
|
|
|
|
|
|
V |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Удельная теплота плавления:
40
