
- •Степень электролитической диссоциации
- •Сильные и слабые электролиты
- •Классификация электролитов в зависимости от степени электролитической диссоциации (памятка)
- •1.4 Схема электролитической диссоциации электролита с ковалентными связями, роль воды в этом процессе.
- •1.5 Определение водородного показателя. Его математическая выражение, какая реакция среды возникает при различных уровнях значения рН
- •1.7 Общее определение реакций нейтрализации и гидролиза, в каких случаях эти реакции протекают обратимо или необратимо
- •Гидролиз солей
- •Степень гидролиза
- •Константа гидролиза
- •Соли, образованные сильным основанием и сильной кислотой
- •Соли, образованные слабым основанием и сильной кислотой
- •Соль, образованная сильным основанием и слабой кислотой
- •Соли, образованные слабым основанием и слабой кислотой
- •Влияние различных факторов на протекание гидролиза
- •2.Тема овр.
- •Окислительно-восстановительные свойства вещества и степени окисления входящих в него атомов
- •Важнейшие восстановители и окислители
- •2.2 Дайте определение следующим понятиям: окислени, восстановление, окислитель , восстановитель.
- •2.3 Дайте определение понятия степень окисления и укажите, каким способом и с какой целью ее определяют для элементов, входящих в состав химического соединения.
- •Расчет степени окисления
- •2.4 Объясните, какая зависимость существует между ов спсобностью химического элемента и его металличностью (неметаличностью, электроотрицательностью и величиной его степени окисления)
- •2.5 Как определяется возможная роль в овр химического элемента или атома в составе молекулы (только окислитель, только восстановитель, окислительно-восстановительная двойственность)
- •Внутримолекулярные окислительно- восстановительные реакции
- •3.Тема Электрохимические системы, электродные потенциалы и химические источники электрического тока
- •3.3 Дайте определение понятия равновесный электродный потенциал ; приведите схему и условия его образования
- •3.6 Опишите устройство и принцип действия биметаллических гальванических элементов ну и тд.Эдс расчет пример. Гальванические элементы. Направление окислительно-восстановительных реакций
- •4 .Тема Реакции окисления металлов
- •4.1 Укажите какую роль в овр могут играть атомы металлов и объясните почему. Перечислите класс(разновидность) веществ, способных выступать в роли окислителей металлов
- •4.2 Какое явление называется пассивацией металлов; объясните что является его причиной и при каких условиях она возможна.
- •Пассивация[править | править вики-текст]
- •4.3 Объясните по какому признаку кислоты в реакциях с металлами делятся на кислоты-окислители и кислоты-неокислители; приведите примеры кислот обоих разновидностей и их реакций с металлами
- •5 Тема Способы выражения концентрации раствора
- •5.2 Дайте определения моля вещества, эквивалента элемента, простого вещества , эквивалента сложного вещества. Приведите по одному конкретному примеру для расчета этих величин.
- •6 Тема Физико-химические свойства растворов неэлектролитов
- •7 Тема. Органические соединения. Http://orgchem.Tsu.Ru/1stroenie.Htm Если чего не хватает!!!!!
- •7.1 Изложите основные положения теории строения химических соединений Бутлерова.
- •7.2 Дайте общую классификацию соединений на ряды ( по строению углеродной цепи) и классы. Классификация органических соединений
- •7.3 Дайте определение следующих понятий: Углеводороды, Производные углеводородов, Полифункциональные соединения.
- •Гомологический ряд
- •Изомерия углеродной цепи (углеродного скелета)[
- •5. Пространственная изомерия
- •6. Оптическая изомерия
- •I. Классификация по механизму реакции
- •1. Гомолитические (радикальные) реакции
- •2. Гетеролитические (ионные)
- •7.7 Опишите сущность индуктивного и мезомерного электронных эффектов в молекулах органических соединений. Индуктивный эффект
- •Сводная таблица заместителей и их электронных эффектов
- •Мезомерный эффект
- •Сводная таблица заместителей и их электронных эффектов
- •7.8 Охарактеризуйте сущность явления пи/пи и p/пи- сопряжения в молекулах органических соединений.
- •7.9 Охарактеризуйте особенности строения, виды изомерии, характерные химические свойства (типичные реакции) алканов. Укажите направления их использования.
- •Реакции радикального замещения Галогенирование
- •Сульфохлорирование (реакция Рида
- •Нитрование
- •Реакции окисления
- •Термические превращения алканов
- •Конверсия метана
- •Реакции электрофильного замещения
- •7.10 Охарактеризуйте особенности строения, виды изомерии, характерные химические свойства (типичные реакции) алкенов. Укажите направления их использования.
- •Электронное строение двойной связи
- •Химические свойства[править | править вики-текст]
- •Реакции электрофильного присоединения[править | править вики-текст]
- •Галогенирование[править | править вики-текст]
- •Гидрогалогенирование[править | править вики-текст]
- •Гидроборирование[править | править вики-текст]
- •Гидратация[править | править вики-текст]
- •Алкилирование[править | править вики-текст]
- •Прочие реакции электрофильного присоединения[править | править вики-текст]
- •Реакции радикального присоединения[править | править вики-текст]
- •Реакции присоединения карбенов[править | править вики-текст]
- •Гидрирование (реакция Сабатье-Сандеран)[править | править вики-текст]
- •Реакции радикального замещения[править | править вики-текст]
- •Окисление[править | править вики-текст]
- •Окисление неорганическими окислителями[править | править вики-текст]
- •Окисление в присутствии солей палладия[править | править вики-текст]
- •Эпоксидирование[править | править вики-текст]
- •Озонолиз[править | править вики-текст]
- •Реакция карбонилирования
- •Реакции полимеризации
- •7.11 Охарактеризуйте особенности строения, виды изомерии, характерные химические свойства (типичные реакции) алкинов. Укажите направления их использования
- •7.12 Охарактеризуйте особенности строения, виды изомерии, характерные химические свойства (типичные реакции) аренов. Укажите направления их использования
- •Изомерия
- •Химические свойства
- •Электрофильное замещение в бензоле
Сульфохлорирование (реакция Рида
 При
облучении УФ-излучением алканы реагируют
со смесью SO2 и
Cl2,
После того, как с уходом хлороводорода
образуется алкильный радикал,
присоединяется диоксид серы. Образовавшийся
сложный радикал стабилизируется захватом
атома хлора с разрушением очередной
молекулы последнего.
При
облучении УФ-излучением алканы реагируют
со смесью SO2 и
Cl2,
После того, как с уходом хлороводорода
образуется алкильный радикал,
присоединяется диоксид серы. Образовавшийся
сложный радикал стабилизируется захватом
атома хлора с разрушением очередной
молекулы последнего.
Инициирование цепного процесса:
{\displaystyle {\mathsf {Cl_{2}{\xrightarrow {h\nu }}2Cl\cdot }}}
Развитие цепного процесса:
{\displaystyle {\mathsf {RH+Cl\cdot \rightarrow R\cdot +HCl}}}
{\displaystyle {\mathsf {R\cdot +SO_{2}\rightarrow RSO_{2}\cdot }}}
{\displaystyle {\mathsf {RSO_{2}\cdot +Cl_{2}\rightarrow RSO_{2}Cl+Cl\cdot }}}
Образовавшиеся сульфонилхлориды широко применяются в производстве ПАВ.
Нитрование
Основная статья: Реакция Коновалова
Алканы реагируют с 10 % раствором азотной кислоты или оксидом азота NO2 в газовой фазе при температуре 140 °C и небольшом давлении с образованием нитропроизводных:
{\displaystyle {\mathsf {RH+HNO_{3}\rightarrow RNO_{2}+H_{2}O}}}
Имеющиеся данные указывают на свободнорадикальный механизм. В результате реакции образуются смеси продуктов.
Реакции окисления
Автоокисление
Окисление алканов в жидкой фазе протекает по свободно-радикальному механизму и приводит к образованию гидропероксидов, продуктов их разложения и взаимодействия с исходным алканом. Схема основной реакции автоокисления:
{\displaystyle {\mathsf {RH+O_{2}\rightarrow R\cdot +HOO\cdot }}}{\displaystyle {\mathsf {R\cdot +O_{2}\rightarrow ROO\cdot }}}{\displaystyle {\mathsf {ROO\cdot +RH\rightarrow ROOH+R\cdot }}}Горение
Основным химическим свойством предельных углеводородов, определяющих их использование в качестве топлива, является реакция горения. Пример:
{\displaystyle {\mathsf {CH_{4}+2O_{2}\rightarrow CO_{2}+2H_{2}O+\Delta Q}}}Значение Q достигает 46 000 — 50 000 кДж/кг.
В случае нехватки кислорода вместо углекислого газа получается оксид углерода(II) или уголь (в зависимости от концентрации кислорода).
Каталитическое окисление
В реакциях каталитического окисления алканов могут образовываться спирты, альдегиды, карбоновые кислоты.
При мягком окислении СН4 в присутствии катализатора кислородом при 200 °C могут образоваться:
метанол: {\displaystyle {\mathsf {2CH_{4}+O_{2}\rightarrow 2CH_{3}OH}}}
формальдегид: {\displaystyle {\mathsf {CH_{4}+O_{2}\rightarrow HCHO+H_{2}O}}}
муравьиная кислота: {\displaystyle {\mathsf {2CH_{4}+3O_{2}\rightarrow 2HCOOH+2H_{2}O}}}
Окисление также может осуществляться воздухом. Процесс проводится в жидкой или газообразной фазе. В промышленности так получают высшие жирные спирты и соответствующие кислоты.
Реакция окисления алканов диметилдиоксираном:

Механизм реакций получения кислот путём каталитического окисления и расщепления алканов показан ниже на примере получения из бутана уксусной кислоты:
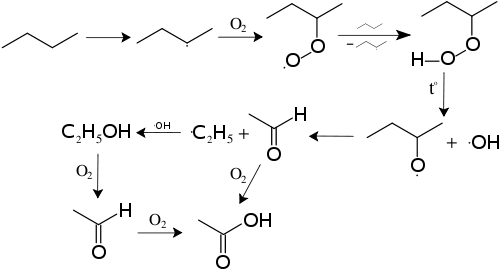
Термические превращения алканов
Реакции разложения происходят лишь под влиянием больших температур. Повышение температуры приводит к разрыву углеродной связи и образованию свободных радикалов.
Примеры:
{\displaystyle {\mathsf {CH_{4}{\xrightarrow[{}]{^{o}t>1000^{o}C}}C+2H_{2}}}}
{\displaystyle {\mathsf {C_{2}H_{6}\rightarrow 2C+3H_{2}}}}
Крекинг
При нагревании выше 500 °C алканы подвергаются пиролитическому разложению с образованием сложной смеси продуктов, состав и соотношение которых зависят от температуры и времени реакции. При пиролизе происходит расщепление углерод-углеродных связей с образованием алкильных радикалов.
В 1930—1950 гг. пиролиз высших алканов использовался в промышленности для получения сложной смеси алканов и алкенов, содержащих от пяти до десяти атомов углерода. Он получил название «термический крекинг». С помощью термического крекинга удавалось увеличить количество бензиновой фракции за счёт расщепления алканов, содержащихся в керосиновой фракции (10—15 атомов углерода в углеродном скелете) и фракции солярового масла (12—20 атомов углерода). Однако октановое число бензина, полученного при термическом крекинге, не превышает 65, что не удовлетворяет требованиям условий эксплуатации современных двигателей внутреннего сгорания.
В настоящее время термический крекинг полностью вытеснен в промышленности каталитическим крекингом, который проводят в газовой фазе при более низких температурах — 400—450 °C и низком давлении — 10—15 атм на алюмосиликатном катализаторе, который непрерывно регенерируется сжиганием образующегося на нём кокса в токе воздуха. При каталитическом крекинге в полученном бензине резко возрастает содержание алканов с разветвлённой структурой.
Для метана:
2CH4 → C2H2 + 3H2 — при 1500 °C.
{\displaystyle {\mathsf {2CH_{4}{\xrightarrow[{}]{^{o}t>1500^{o}C}}C_{2}H_{2}+3H_{2}}}}
Дегидрирование
1) В углеродном скелете 2 (этан) или 3 (пропан) атома углерода — получение (терминальных) алкенов, так как других в данном случае не может получиться; выделение водорода:
Условия протекания: 400—600 °C, катализаторы — Pt, Ni, Al2O3, Cr2O3, например, образование этилена из этана:
{\displaystyle {\mathsf {CH_{3}{\text{-}}CH_{3}\rightarrow CH_{2}{\text{=}}CH_{2}+H_{2}}}}
2) В углеродном скелете 4 (бутан, изобутан) или 5 (пентан, 2-метилбутан, неопентан) атомов углерода — получение алкадиенов, например, бутадиена-1,3 и бутадиена-1,2 из бутана:
{\displaystyle {\mathsf {CH_{3}{\text{-}}CH_{2}{\text{-}}CH_{2}{\text{-}}CH_{3}\rightarrow CH_{2}{\text{=}}CH{\text{-}}CH{\text{=}}CH_{2}+2H_{2}}}}
{\displaystyle {\mathsf {CH_{3}{\text{-}}CH_{2}{\text{-}}CH_{2}{\text{-}}CH_{3}\rightarrow CH_{2}{\text{=}}C{\text{=}}CH{\text{-}}CH_{3}+2H_{2}}}}
3) В углеродном скелете 6 (гексан) и более атомов углерода — получение бензола и его производных:
{\displaystyle {\mathsf {CH_{3}(CH_{2})_{5}CH_{3}\rightarrow C_{6}H_{5}CH_{3}+4H_{2}}}}
