- •Степень электролитической диссоциации
- •Сильные и слабые электролиты
- •Классификация электролитов в зависимости от степени электролитической диссоциации (памятка)
- •1.4 Схема электролитической диссоциации электролита с ковалентными связями, роль воды в этом процессе.
- •1.5 Определение водородного показателя. Его математическая выражение, какая реакция среды возникает при различных уровнях значения рН
- •1.7 Общее определение реакций нейтрализации и гидролиза, в каких случаях эти реакции протекают обратимо или необратимо
- •Гидролиз солей
- •Степень гидролиза
- •Константа гидролиза
- •Соли, образованные сильным основанием и сильной кислотой
- •Соли, образованные слабым основанием и сильной кислотой
- •Соль, образованная сильным основанием и слабой кислотой
- •Соли, образованные слабым основанием и слабой кислотой
- •Влияние различных факторов на протекание гидролиза
- •2.Тема овр.
- •Окислительно-восстановительные свойства вещества и степени окисления входящих в него атомов
- •Важнейшие восстановители и окислители
- •2.2 Дайте определение следующим понятиям: окислени, восстановление, окислитель , восстановитель.
- •2.3 Дайте определение понятия степень окисления и укажите, каким способом и с какой целью ее определяют для элементов, входящих в состав химического соединения.
- •Расчет степени окисления
- •2.4 Объясните, какая зависимость существует между ов спсобностью химического элемента и его металличностью (неметаличностью, электроотрицательностью и величиной его степени окисления)
- •2.5 Как определяется возможная роль в овр химического элемента или атома в составе молекулы (только окислитель, только восстановитель, окислительно-восстановительная двойственность)
- •Внутримолекулярные окислительно- восстановительные реакции
- •3.Тема Электрохимические системы, электродные потенциалы и химические источники электрического тока
- •3.3 Дайте определение понятия равновесный электродный потенциал ; приведите схему и условия его образования
- •3.6 Опишите устройство и принцип действия биметаллических гальванических элементов ну и тд.Эдс расчет пример. Гальванические элементы. Направление окислительно-восстановительных реакций
- •4 .Тема Реакции окисления металлов
- •4.1 Укажите какую роль в овр могут играть атомы металлов и объясните почему. Перечислите класс(разновидность) веществ, способных выступать в роли окислителей металлов
- •4.2 Какое явление называется пассивацией металлов; объясните что является его причиной и при каких условиях она возможна.
- •Пассивация[править | править вики-текст]
- •4.3 Объясните по какому признаку кислоты в реакциях с металлами делятся на кислоты-окислители и кислоты-неокислители; приведите примеры кислот обоих разновидностей и их реакций с металлами
- •5 Тема Способы выражения концентрации раствора
- •5.2 Дайте определения моля вещества, эквивалента элемента, простого вещества , эквивалента сложного вещества. Приведите по одному конкретному примеру для расчета этих величин.
- •6 Тема Физико-химические свойства растворов неэлектролитов
- •7 Тема. Органические соединения. Http://orgchem.Tsu.Ru/1stroenie.Htm Если чего не хватает!!!!!
- •7.1 Изложите основные положения теории строения химических соединений Бутлерова.
- •7.2 Дайте общую классификацию соединений на ряды ( по строению углеродной цепи) и классы. Классификация органических соединений
- •7.3 Дайте определение следующих понятий: Углеводороды, Производные углеводородов, Полифункциональные соединения.
- •Гомологический ряд
- •Изомерия углеродной цепи (углеродного скелета)[
- •5. Пространственная изомерия
- •6. Оптическая изомерия
- •I. Классификация по механизму реакции
- •1. Гомолитические (радикальные) реакции
- •2. Гетеролитические (ионные)
- •7.7 Опишите сущность индуктивного и мезомерного электронных эффектов в молекулах органических соединений. Индуктивный эффект
- •Сводная таблица заместителей и их электронных эффектов
- •Мезомерный эффект
- •Сводная таблица заместителей и их электронных эффектов
- •7.8 Охарактеризуйте сущность явления пи/пи и p/пи- сопряжения в молекулах органических соединений.
- •7.9 Охарактеризуйте особенности строения, виды изомерии, характерные химические свойства (типичные реакции) алканов. Укажите направления их использования.
- •Реакции радикального замещения Галогенирование
- •Сульфохлорирование (реакция Рида
- •Нитрование
- •Реакции окисления
- •Термические превращения алканов
- •Конверсия метана
- •Реакции электрофильного замещения
- •7.10 Охарактеризуйте особенности строения, виды изомерии, характерные химические свойства (типичные реакции) алкенов. Укажите направления их использования.
- •Электронное строение двойной связи
- •Химические свойства[править | править вики-текст]
- •Реакции электрофильного присоединения[править | править вики-текст]
- •Галогенирование[править | править вики-текст]
- •Гидрогалогенирование[править | править вики-текст]
- •Гидроборирование[править | править вики-текст]
- •Гидратация[править | править вики-текст]
- •Алкилирование[править | править вики-текст]
- •Прочие реакции электрофильного присоединения[править | править вики-текст]
- •Реакции радикального присоединения[править | править вики-текст]
- •Реакции присоединения карбенов[править | править вики-текст]
- •Гидрирование (реакция Сабатье-Сандеран)[править | править вики-текст]
- •Реакции радикального замещения[править | править вики-текст]
- •Окисление[править | править вики-текст]
- •Окисление неорганическими окислителями[править | править вики-текст]
- •Окисление в присутствии солей палладия[править | править вики-текст]
- •Эпоксидирование[править | править вики-текст]
- •Озонолиз[править | править вики-текст]
- •Реакция карбонилирования
- •Реакции полимеризации
- •7.11 Охарактеризуйте особенности строения, виды изомерии, характерные химические свойства (типичные реакции) алкинов. Укажите направления их использования
- •7.12 Охарактеризуйте особенности строения, виды изомерии, характерные химические свойства (типичные реакции) аренов. Укажите направления их использования
- •Изомерия
- •Химические свойства
- •Электрофильное замещение в бензоле
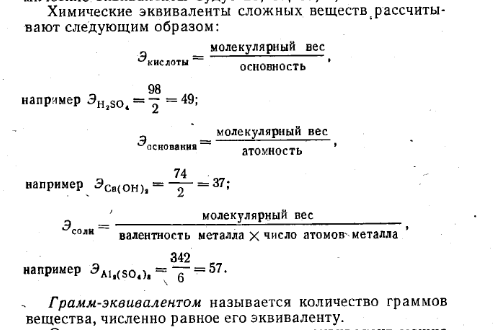
5.2 Дайте определения моля вещества, эквивалента элемента, простого вещества , эквивалента сложного вещества. Приведите по одному конкретному примеру для расчета этих величин.
http://www.sev-chem.narod.ru/spravochnik/teoriya/eq.htm
Моль вещества (n) — это количество вещества, содержащее столько молекул, атомов, ионов, электронов или других структурных единиц, сколько содержится их в 12 г изотопа углерода 12C.
Число структурных единиц, содержащихся в 1 моле вещества равно 6,02 • 1023.Эточисло называется числом Авогадро (NA)
Исходя из этого, любое количество вещества можно выразить определенным числом молей (ню). Например, в образце вещества содержится 12,04 1023 молекул. Следовательно, количество вещества в этом образце составляет:

В общем
виде: ![]()
где N - число частиц данного вещества; NA - число частиц в одном моле вещества (постоянная Авогадро).
Молярная масса вещества (M) – масса одного моля этого вещества. По величине она равна относительной молекулярной массе Mr (для веществ атомного строения – относительной атомной массе Ar). Молярная масса имеет размерность г/моль. Например, молярная масса метана CH4 определяется следующим образом:
Мr(CH4) = Ar(C) + 4 Ar(H) = 12+4 =16
M(CH4)=16 г/моль, т.е. 16 г CH4 содержат 6,021023 молекул. Молярную массу вещества можно вычислить, если известны его масса m и количество (число молей) , по формуле:
![]()
Соответственно, зная массу и молярную массу вещества, можно рассчитать число его молей:
![]()
или найти массу вещества по числу молей и молярной массе:
m = M .
Необходимо отметить, что значение молярной массы вещества определяется его качественным и количественным составом, т.е. зависит от Mr и Ar. Поэтому разные вещества при одинаковом количестве молей имеют различные массы m.
Пример:
Вычислить массы метана CH4 и этана С2H6, взятых в количестве = 2 моль каждого.
Решение:
Молярная масса метана равна 16 г/моль, а этана С2Н6 – 30 г/моль. Отсюда:
m(CH4) = 2 моль 16 г/моль = 32 г; m(С2Н6) = 2 моль 30 г/моль = 60 г.
Таким образом, моль - это порция вещества, содержащая одно и то же число частиц, но имеющая разную массу для разных веществ, т.к. частицы вещества (атомы и молекулы) не одинаковы по массе.
 (CH4)
= (С2Н6),
но m(CH4) <
m(С2Н6)
(CH4)
= (С2Н6),
но m(CH4) <
m(С2Н6)
Химическим эквивалентом элемента называется реальная или условная частица, которая может присоединять, замещать, высвобождать или каким – либо другим образом быть равноценна одному атому (иону) водорода в ионообменных реакциях или одному электрону в окислительно-восстановительных реакциях.
Исходя из определения, эквивалент для водорода равен 1 атому:
Э (Н) = 1 атом водорода.
Эквивалент – это реальная или условная частица, которая в кислотно-основных реакциях присоединяет (или отдает) один ион Н+ или ОН–, в окислительно-восстановительных реакциях принимает (или отдает один электрон, реагирует с одним атомом водорода или с одним эквивалентом другого вещества.)
H3PO4 + 2KOH K2HPO4 + 2H2O.
В ходе этой реакции только два атома водорода замещаются на атомы калия, иначе, в реакцию вступают два иона Н+ (кислота проявляет основность 2). Тогда по определению эквивалентом H3PO4 будет являться условная частица 1/2H3PO4, т.к. если одна молекула H3PO4 предоставляет два иона Н+, то один ион Н+ дает половина молекулы H3PO4.
Эквивалентом элемента (Э) называют такое его количество, которое соединяется с 1 молем атомов водорода или замещает то же количество атомов водорода в химических реакциях.
Эквивалент элемента Э можно вычислить, исходя из его атомной массы А и валентности В по формуле Э = А/В. Например, эквивалент кислорода равен 8, так как валентность кислорода всегда равна двум: Э0 = 16/2 = 8.
Масса 1 эквивалента элемента называется его эквивалентной массой.
Эквиваленты выражаются в молях, а эквивалентные массы — в г/моль.
Эквивалент
не является постоянной величиной, а
зависит от валентности элемента в том
или ином соединении. Например,
в соединениях NH3,
H2S и НСl эквивалент (Э) и
эквивалентная масса (тэ) азота,
серы и хлора равныЭ(N)
- 1/3 моль; Э(S) - 1/2 моль; Э(Сl) = 1 моль и mэ(N) = 1/3
х 14 = 4,67 г/моль; mЭ(S) = 1/2
х 32 = 16 г/моль; тЭ(Cl) =
1 х 35,5 = 35,5 г/моль. В
соединении SO2 сера
четырёхвалентна и её эквивалентная
масса равна тэ(S) = 64/4=16