
- •Степень электролитической диссоциации
- •Сильные и слабые электролиты
- •Классификация электролитов в зависимости от степени электролитической диссоциации (памятка)
- •1.4 Схема электролитической диссоциации электролита с ковалентными связями, роль воды в этом процессе.
- •1.5 Определение водородного показателя. Его математическая выражение, какая реакция среды возникает при различных уровнях значения рН
- •1.7 Общее определение реакций нейтрализации и гидролиза, в каких случаях эти реакции протекают обратимо или необратимо
- •Гидролиз солей
- •Степень гидролиза
- •Константа гидролиза
- •Соли, образованные сильным основанием и сильной кислотой
- •Соли, образованные слабым основанием и сильной кислотой
- •Соль, образованная сильным основанием и слабой кислотой
- •Соли, образованные слабым основанием и слабой кислотой
- •Влияние различных факторов на протекание гидролиза
- •2.Тема овр.
- •Окислительно-восстановительные свойства вещества и степени окисления входящих в него атомов
- •Важнейшие восстановители и окислители
- •2.2 Дайте определение следующим понятиям: окислени, восстановление, окислитель , восстановитель.
- •2.3 Дайте определение понятия степень окисления и укажите, каким способом и с какой целью ее определяют для элементов, входящих в состав химического соединения.
- •Расчет степени окисления
- •2.4 Объясните, какая зависимость существует между ов спсобностью химического элемента и его металличностью (неметаличностью, электроотрицательностью и величиной его степени окисления)
- •2.5 Как определяется возможная роль в овр химического элемента или атома в составе молекулы (только окислитель, только восстановитель, окислительно-восстановительная двойственность)
- •Внутримолекулярные окислительно- восстановительные реакции
- •3.Тема Электрохимические системы, электродные потенциалы и химические источники электрического тока
- •3.3 Дайте определение понятия равновесный электродный потенциал ; приведите схему и условия его образования
- •3.6 Опишите устройство и принцип действия биметаллических гальванических элементов ну и тд.Эдс расчет пример. Гальванические элементы. Направление окислительно-восстановительных реакций
- •4 .Тема Реакции окисления металлов
- •4.1 Укажите какую роль в овр могут играть атомы металлов и объясните почему. Перечислите класс(разновидность) веществ, способных выступать в роли окислителей металлов
- •4.2 Какое явление называется пассивацией металлов; объясните что является его причиной и при каких условиях она возможна.
- •Пассивация[править | править вики-текст]
- •4.3 Объясните по какому признаку кислоты в реакциях с металлами делятся на кислоты-окислители и кислоты-неокислители; приведите примеры кислот обоих разновидностей и их реакций с металлами
- •5 Тема Способы выражения концентрации раствора
- •5.2 Дайте определения моля вещества, эквивалента элемента, простого вещества , эквивалента сложного вещества. Приведите по одному конкретному примеру для расчета этих величин.
- •6 Тема Физико-химические свойства растворов неэлектролитов
- •7 Тема. Органические соединения. Http://orgchem.Tsu.Ru/1stroenie.Htm Если чего не хватает!!!!!
- •7.1 Изложите основные положения теории строения химических соединений Бутлерова.
- •7.2 Дайте общую классификацию соединений на ряды ( по строению углеродной цепи) и классы. Классификация органических соединений
- •7.3 Дайте определение следующих понятий: Углеводороды, Производные углеводородов, Полифункциональные соединения.
- •Гомологический ряд
- •Изомерия углеродной цепи (углеродного скелета)[
- •5. Пространственная изомерия
- •6. Оптическая изомерия
- •I. Классификация по механизму реакции
- •1. Гомолитические (радикальные) реакции
- •2. Гетеролитические (ионные)
- •7.7 Опишите сущность индуктивного и мезомерного электронных эффектов в молекулах органических соединений. Индуктивный эффект
- •Сводная таблица заместителей и их электронных эффектов
- •Мезомерный эффект
- •Сводная таблица заместителей и их электронных эффектов
- •7.8 Охарактеризуйте сущность явления пи/пи и p/пи- сопряжения в молекулах органических соединений.
- •7.9 Охарактеризуйте особенности строения, виды изомерии, характерные химические свойства (типичные реакции) алканов. Укажите направления их использования.
- •Реакции радикального замещения Галогенирование
- •Сульфохлорирование (реакция Рида
- •Нитрование
- •Реакции окисления
- •Термические превращения алканов
- •Конверсия метана
- •Реакции электрофильного замещения
- •7.10 Охарактеризуйте особенности строения, виды изомерии, характерные химические свойства (типичные реакции) алкенов. Укажите направления их использования.
- •Электронное строение двойной связи
- •Химические свойства[править | править вики-текст]
- •Реакции электрофильного присоединения[править | править вики-текст]
- •Галогенирование[править | править вики-текст]
- •Гидрогалогенирование[править | править вики-текст]
- •Гидроборирование[править | править вики-текст]
- •Гидратация[править | править вики-текст]
- •Алкилирование[править | править вики-текст]
- •Прочие реакции электрофильного присоединения[править | править вики-текст]
- •Реакции радикального присоединения[править | править вики-текст]
- •Реакции присоединения карбенов[править | править вики-текст]
- •Гидрирование (реакция Сабатье-Сандеран)[править | править вики-текст]
- •Реакции радикального замещения[править | править вики-текст]
- •Окисление[править | править вики-текст]
- •Окисление неорганическими окислителями[править | править вики-текст]
- •Окисление в присутствии солей палладия[править | править вики-текст]
- •Эпоксидирование[править | править вики-текст]
- •Озонолиз[править | править вики-текст]
- •Реакция карбонилирования
- •Реакции полимеризации
- •7.11 Охарактеризуйте особенности строения, виды изомерии, характерные химические свойства (типичные реакции) алкинов. Укажите направления их использования
- •7.12 Охарактеризуйте особенности строения, виды изомерии, характерные химические свойства (типичные реакции) аренов. Укажите направления их использования
- •Изомерия
- •Химические свойства
- •Электрофильное замещение в бензоле
1. Гомолитические (радикальные) реакции
Например, галогенирование алканов (реакция цепная)
CH4 + Cl2 hν → CH3Cl + HCl (1 стадия) ;
CH3Cl + Cl2 hν → CH2Cl2 + HCl (2 стадия);
СH2Cl2 + Cl2 hν → CHCl3 + HCl (3 стадия);
CHCl3 + Cl2 hν → CCl4 + HCl (4 стадия).
Внимание! В реакциях замещения алканов легче всего замещаются атомы водорода у третичных атомов углерода, затем у вторичных и, в последнюю очередь, у первичных.
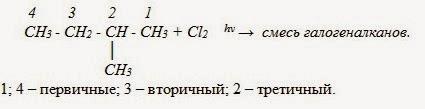
2. Гетеролитические (ионные)
Гетеролитический распад ковалентной полярной связи приводит к образованию нуклеофилов (анионов) и электрофилов (катионов):
а)
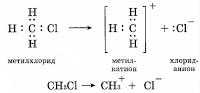
б) H2O → H+ + OH-
Образовавшиеся ионы вступают в дальнейшие превращения, например:
CH3+ + OH- → CH3OH
электрофил нуклеофил
Ионные реакции делятся по характеру реагента, действующего на молекулу, наэлектрофильные и нуклеофильные.
Электрофил E (любящий электроны) – это частица, которая атакует атом углерода органического соединения, отнимая у него электронную пару (является акцептором электронов). Примеры частиц – электрофилов: H3O+, H+, HCl, HNO3, NO2+, AlCl3 и др
Нуклеофил N (любящий ядро) – это частица, которая атакует атом углерода, предоставляя ему электронную пару (является донором электронов). Такие частицы, как правило, обладают основными свойствами. К ним относятся: OH-, Cl-, S2-, NH3, H2O, R-OH, CH3O- и др
Нуклеофильные реакции – это реакции органических веществ с нуклеофилами, т.е. анионами или молекулами, которые предоставляют электронную пару на образование новой связи:
СH3Br(субстрат) + NaOH(реагент-нуклеофил) → CH3OH + NaBr
Электрофильные реакции – реакции органических соединений с электрофильными реагентами, т.е. катионами или молекулами, которые имеют свободную орбиталь, готовые принять электронную пару для образования новой связи
C6H6 (субстрат) + HO:- NO2+(реагент –электрофил) → C6H5–NO2 + H – OH
7.7 Опишите сущность индуктивного и мезомерного электронных эффектов в молекулах органических соединений. Индуктивный эффект
Если влияние заместителя передается при участии -связей, то происходит постепенное изменение электронного состояния связей. Такая поляризация называется индуктивным эффектом (I), изображается стрелкой в направлении смещения электронной плотности:
СН3-СН2Cl,
HOСН2-СН2Cl,
СН3-СН2COOH,
СН3-СН2NO2 и т.д.
Индуктивный эффект обусловлен стремлением атома или группы атомов подавать или оттягивать на себя электронную плотность, в связи с чем он может быть положительным или отрицательным. Отрицательный индуктивный эффект проявляют элементы, более электроотрицательные, чем углерод, т.е. галогены, кислород, азот и другие, а также группы с положительным зарядом на элементе, связанном с углеродом. Отрицательный индуктивный эффект уменьшается справа налево в периоде и сверху вниз в группе периодической системы:
F > O > N,
F > Cl > Br > J.
В случае заместителей с полным зарядом отрицательный индуктивный эффект увеличивается с возрастанием электроотрицательности атома, связанного с углеродом:
>O+- >> N+< .
В случае сложных заместителей отрицательный индуктивный эффект определяется природой атомов, составляющих заместитель. Кроме этого, индуктивный эффект зависит от характера гибридизации атомов. Так, электроотрицательность атомов углерода зависит от гибридизации электронных орбиталей и изменяется в следующем направлении:
sp3 < sp2 < sp.
Положительный индуктивный эффект проявляют элементы, менее электроотрицательные, чем углерод; группы с полным отрицательным зарядом; алкильные группы. +I-эффект уменьшается в ряду:
(СН3)3С- > (CH3)2CH- > CH3-CH2- > CH3- > H-.
Индуктивный эффект заместителя быстро затухает по мере увеличения длины цепи.
Таблица
