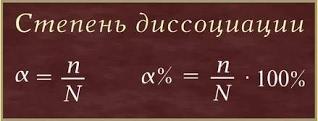- •Степень электролитической диссоциации
- •Сильные и слабые электролиты
- •Классификация электролитов в зависимости от степени электролитической диссоциации (памятка)
- •1.4 Схема электролитической диссоциации электролита с ковалентными связями, роль воды в этом процессе.
- •1.5 Определение водородного показателя. Его математическая выражение, какая реакция среды возникает при различных уровнях значения рН
- •1.7 Общее определение реакций нейтрализации и гидролиза, в каких случаях эти реакции протекают обратимо или необратимо
- •Гидролиз солей
- •Степень гидролиза
- •Константа гидролиза
- •Соли, образованные сильным основанием и сильной кислотой
- •Соли, образованные слабым основанием и сильной кислотой
- •Соль, образованная сильным основанием и слабой кислотой
- •Соли, образованные слабым основанием и слабой кислотой
- •Влияние различных факторов на протекание гидролиза
- •2.Тема овр.
- •Окислительно-восстановительные свойства вещества и степени окисления входящих в него атомов
- •Важнейшие восстановители и окислители
- •2.2 Дайте определение следующим понятиям: окислени, восстановление, окислитель , восстановитель.
- •2.3 Дайте определение понятия степень окисления и укажите, каким способом и с какой целью ее определяют для элементов, входящих в состав химического соединения.
- •Расчет степени окисления
- •2.4 Объясните, какая зависимость существует между ов спсобностью химического элемента и его металличностью (неметаличностью, электроотрицательностью и величиной его степени окисления)
- •2.5 Как определяется возможная роль в овр химического элемента или атома в составе молекулы (только окислитель, только восстановитель, окислительно-восстановительная двойственность)
- •Внутримолекулярные окислительно- восстановительные реакции
- •3.Тема Электрохимические системы, электродные потенциалы и химические источники электрического тока
- •3.3 Дайте определение понятия равновесный электродный потенциал ; приведите схему и условия его образования
- •3.6 Опишите устройство и принцип действия биметаллических гальванических элементов ну и тд.Эдс расчет пример. Гальванические элементы. Направление окислительно-восстановительных реакций
- •4 .Тема Реакции окисления металлов
- •4.1 Укажите какую роль в овр могут играть атомы металлов и объясните почему. Перечислите класс(разновидность) веществ, способных выступать в роли окислителей металлов
- •4.2 Какое явление называется пассивацией металлов; объясните что является его причиной и при каких условиях она возможна.
- •Пассивация[править | править вики-текст]
- •4.3 Объясните по какому признаку кислоты в реакциях с металлами делятся на кислоты-окислители и кислоты-неокислители; приведите примеры кислот обоих разновидностей и их реакций с металлами
- •5 Тема Способы выражения концентрации раствора
- •5.2 Дайте определения моля вещества, эквивалента элемента, простого вещества , эквивалента сложного вещества. Приведите по одному конкретному примеру для расчета этих величин.
- •6 Тема Физико-химические свойства растворов неэлектролитов
- •7 Тема. Органические соединения. Http://orgchem.Tsu.Ru/1stroenie.Htm Если чего не хватает!!!!!
- •7.1 Изложите основные положения теории строения химических соединений Бутлерова.
- •7.2 Дайте общую классификацию соединений на ряды ( по строению углеродной цепи) и классы. Классификация органических соединений
- •7.3 Дайте определение следующих понятий: Углеводороды, Производные углеводородов, Полифункциональные соединения.
- •Гомологический ряд
- •Изомерия углеродной цепи (углеродного скелета)[
- •5. Пространственная изомерия
- •6. Оптическая изомерия
- •I. Классификация по механизму реакции
- •1. Гомолитические (радикальные) реакции
- •2. Гетеролитические (ионные)
- •7.7 Опишите сущность индуктивного и мезомерного электронных эффектов в молекулах органических соединений. Индуктивный эффект
- •Сводная таблица заместителей и их электронных эффектов
- •Мезомерный эффект
- •Сводная таблица заместителей и их электронных эффектов
- •7.8 Охарактеризуйте сущность явления пи/пи и p/пи- сопряжения в молекулах органических соединений.
- •7.9 Охарактеризуйте особенности строения, виды изомерии, характерные химические свойства (типичные реакции) алканов. Укажите направления их использования.
- •Реакции радикального замещения Галогенирование
- •Сульфохлорирование (реакция Рида
- •Нитрование
- •Реакции окисления
- •Термические превращения алканов
- •Конверсия метана
- •Реакции электрофильного замещения
- •7.10 Охарактеризуйте особенности строения, виды изомерии, характерные химические свойства (типичные реакции) алкенов. Укажите направления их использования.
- •Электронное строение двойной связи
- •Химические свойства[править | править вики-текст]
- •Реакции электрофильного присоединения[править | править вики-текст]
- •Галогенирование[править | править вики-текст]
- •Гидрогалогенирование[править | править вики-текст]
- •Гидроборирование[править | править вики-текст]
- •Гидратация[править | править вики-текст]
- •Алкилирование[править | править вики-текст]
- •Прочие реакции электрофильного присоединения[править | править вики-текст]
- •Реакции радикального присоединения[править | править вики-текст]
- •Реакции присоединения карбенов[править | править вики-текст]
- •Гидрирование (реакция Сабатье-Сандеран)[править | править вики-текст]
- •Реакции радикального замещения[править | править вики-текст]
- •Окисление[править | править вики-текст]
- •Окисление неорганическими окислителями[править | править вики-текст]
- •Окисление в присутствии солей палладия[править | править вики-текст]
- •Эпоксидирование[править | править вики-текст]
- •Озонолиз[править | править вики-текст]
- •Реакция карбонилирования
- •Реакции полимеризации
- •7.11 Охарактеризуйте особенности строения, виды изомерии, характерные химические свойства (типичные реакции) алкинов. Укажите направления их использования
- •7.12 Охарактеризуйте особенности строения, виды изомерии, характерные химические свойства (типичные реакции) аренов. Укажите направления их использования
- •Изомерия
- •Химические свойства
- •Электрофильное замещение в бензоле



1 Тема.Реакции в растворах электролитов
Изложите основные положения теории электролитической диссоциации. Какие веществ называются электролитами и неэлектролитами .
1. Электролиты при растворении в воде распадаются (диссоциируют) на ионы – положительные и отрицательные.
2. Под действием электрического тока ионы приобретают направленное движение: положительно заряженные частицы движутся к катоду, отрицательно заряженные – к аноду. Поэтому положительно заряженные частицы называются катионами, а отрицательно заряженные – анионами.
3. Направленное движение происходит в результате притяжения их противоположно заряженными электродами (катод заряжен отрицательно, а анод – положительно).
4. Ионизация – обратимый процесс: параллельно с распадом молекул на ионы (диссоциация) протекает процесс соединения ионов в молекулы (ассоциация).
Основываясь на теории электролитической диссоциации, можно дать следующие определения для основных классов соединений:
Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только ионы водорода. Например,
HCl
→ H+ +
Cl-;
CH3COOH ![]() H+ +
CH3COO-.
H+ +
CH3COO-.
Основность кислоты определяется числом катионов водорода, которые образуются при диссоциации. Так, HCl, HNO3 – одноосновные кислоты, H2SO4, H2CO3 – двухосновные, H3PO4, H3AsO4 – трехосновные.
Основаниями называют электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы. Например,
KOH
→ K+ +
OH-,
NH4OH ![]() NH4+ +
OH-.
NH4+ +
OH-.
Растворимые в воде основания называются щелочами.
Кислотность основания определяется числом его гидроксильных групп. Например, KOH, NaOH – однокислотные основания, Ca(OH)2 – двухкислотное, Sn(OH)4 – четырехкислотное и т.д.
Солями называют электролиты, при диссоциации которых образуются катионы металлов (а также ион NH4+) и анионы кислотных остатков. Например,
CaCl2→ Ca2+ + 2Cl-, NaF → Na+ + F-.
Электролиты, при диссоциации которых одновременно, в зависимости от условий, могут образовываться и катионы водорода, и анионы – гидроксид-ионы называются амфотерными. Например,
H2O ![]() H+ +
OH-,
Zn(OH)2
H+ +
OH-,
Zn(OH)2 ![]() Zn2+ +
2OH-,
Zn(OH)2
Zn2+ +
2OH-,
Zn(OH)2 ![]() 2H+ +
ZnO22- или
Zn(OH)2 +
2H2O
2H+ +
ZnO22- или
Zn(OH)2 +
2H2O ![]() [Zn(OH)4]2- +
2H+.
[Zn(OH)4]2- +
2H+.
Вещества, растворы которых проводят электрический ток, относятся к электролитам.
Электролитами являются соли, кислоты и основания.
Вещества, растворы которых не проводят электрический ток, называют неэлектролитами. Неэлектролитами являются многие органические вещества, например сахар, глюкоза, спирт.
Причиной электропроводности растворов кислот, оснований, солей является наличие в растворе ионов, которые образуются при растворении этих веществ в воде.
Процесс распада электролита на ионы называетсяэлектролитической диссоциацией.
Положительно заряженные ионы называют катионами (при помещении в раствор электродов движутся к отрицательно заряженному электроду - катоду).
Отрицательно заряженные ионы называют анионами(движутся к положительно заряженному электроду - аноду)
По какому признаку электролиты делятся на сильные и слабые, какие классы химических соединений относятся к сильным и слабым электролитам.
Степень электролитической диссоциации
Поскольку электролитическая диссоциация - процесс обратимый, то в растворах электролитов наряду с их ионами присутствуют и молекулы. Другими словами, различные электролиты, согласно теории С. Аррениуса, диссоциируют на ионы в различной степени. Полнота распада (сила электролита) характеризуется количественной величиной – степенью диссоциации.
Степень диссоциации (α – греческая буква альфа) - это отношение числа молекул, распавшихся на ионы (n), к общему числу растворенных молекул (N):
Степень диссоциации электролита определяется опытным путем и выражается в долях единицы или в процентах. Если α = 0, то диссоциация отсутствует, а если α = 1 или 100%, то электролит полностью распадается на ионы. Если же α = 20%, то это означает, что из 100 молекул данного электролита 20 распалось на ионы.
Степень диссоциации зависит от природы электролита и растворителя, от концентрации электролита, температуры.
1. Зависимость степени диссоциации от природы: чем полярнее химическая связь в молекуле электролита и растворителя, тем сильнее выражен процесс диссоциации электролита на ионы и тем выше значение степени диссоциации.
2. Зависимость степени диссоциации от концентрации электролита: с уменьшением концентрации электролита, т.е. при разбавлении его водой, степень диссоциации всегда увеличивается.
3. Зависимость степени диссоциации от температуры: степень диссоциации возрастает при повышении температуры (повышение температуры приводит к увеличению кинетической энергии растворённых частиц, что способствует распаду молекул на ионы).
Сильные и слабые электролиты
В зависимости от степени диссоциации различают электролиты сильные и слабые. Электролиты со степенью диссоциации больше 30% обычно называют сильными, со степенью диссоциации от 3 до 30% — средними, менее 3% — слабыми электролитами.
Классификация электролитов в зависимости от степени электролитической диссоциации (памятка)
|
Классификация электролитов |
Сильные электролиты |
Средние электролиты |
Слабые электролиты |
|
Значение степени диссоциации (α) |
α>30% |
3%≤α≤30% |
α<3% |
|
Примеры |
1. Растворимые соли; 2. Сильные кислоты (НСl, HBr, HI, НNО3, НClO4, Н2SO4(разб.)); 3. Сильные основания – щёлочи. |
H3PO4 H2SO3 |
1. Почти все органические кислоты (CH3COOH, C2H5COOH и др.); 2. Некоторые неорганические кислоты (H2CO3, H2S и др.); 3. Почти все малорастворимые в воде соли, основания и гидроксид аммония (Ca3(PO4)2; Cu(OH)2; Al(OH)3; NH4OH); 4. Вода. |
1.3 Схема электролитической диссоциации электролита с ковалентными связями; роль воды в процессе
Следовательно, в результате диссоциации в растворе появляются ионы, которые являются предпосылкой для появления у раствора или расплава такого физического свойства как электропроводимость. Как же происходит процесс растворения?. Разрушение ионной кристаллической решётки происходит под воздействием растворителя, например воды. Полярные молекулы воды настолько снижают силы электростатического притяжения между ионами в кристаллической решётке, что ионы становятся свободными и переходят в раствор. При расплавлении , когда происходит нагревание кристалла, ионы начинают совершать интенсивные колебания в узлах кристаллической решётки, в результате чего она разрушается, образуется расплав, который состоит из ионов. Теорию электролитической диссоциации создал в 1884-1887 гг. шведский химик Аррениус .Эта классическая теория позволила как электропроводимость расплавов и растворов, так и протекание химических реакций в растворах между расплавленными или растворёнными веществами.
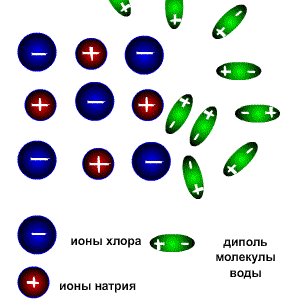
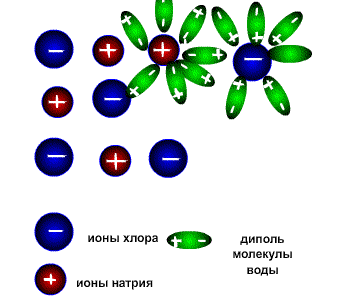
Схема электролитической диссоциации.
![]()
Молекулы воды являются дипольными, т.е. один конец молекулы заряжен отрицательно, другой-положительно. Молекула отрицательным полюсом подходит к иону натрия, положительным-к иону хлора; окружают ионы со всех сторон и вырывают из кристалла, причём, только с его поверхности Уравнение диссоциации можно записать следующим образом:
|
NaCl |
Электролитическую диссоциацию вызывает не только вода, но и неводные полярные растворители, такие как Жидкий аммиак и жидкий диоксид серы. Однако именно для воды характерно свойство ослаблять электростатическое притяжение между ионами в решётке выражено особенно ярко. Свободные ионы, оказавшиеся в водном растворе окружаются полярными молекулами воды: вокруг ионов образуется гидратная оболочка, т.е. протекает процесс гидратации.