
- •Государственное бюджетное образовательное учреждение
- •Список сокращений
- •Введение
- •Глава 1. Физиологические и биохимические особенности соединительной ткани
- •1.1. Организация межклеточного матрикса
- •Типы коллагенов, их локализация
- •Связывающие молекулы между коллагеном и различными типами клеток
- •Клетки соединительной ткани
- •Скелетные ткани
- •1.3.2. Хрящ как предшественник кости
- •1.3.3. Костная ткань – особый вид соединительной ткани
- •1.3.3.1. Химический состав костной ткани
- •1.3.3.2. Факторы, влияющие на метаболизм костной ткани
- •1.4. Жировая ткань
- •Глава 2. Кровь – вариант соединительной ткани
- •2.1. Физиологические функции крови
- •2.2. Плазма крови
- •2.3. Клетки крови
- •2.4 Эритроциты – важнейшие форменные элементы крови
- •2.4.1. Строение мембран эритроцитов
- •2.4.2. Особенности метаболизма эритроцитов
- •2.4.3. Структура и свойства гемоглобина
- •Свойства гемоглобина
- •2.4.4. Этапы образования гемоглобина
- •2.4.4.1. Обмен железа
- •2.4.4.2. Синтез гема
- •2.4.5.Болезни анаболизма гемоглобина
- •2.4.5.1.Анемии как следствие нарушений обмена железа
- •2.4.5.2. Порфирии
- •Локализация повреждений ферментов при различных порфириях и их следствие
- •2.4.5.3.Гемоглобинопатии
- •2.4.5.4. Дисгемоглобинемии
- •2.4.5.5. Нарушение транспорта гемоглобина в плазме крови
- •2.4.6. Старение и распад эритроцитов
- •2.4.6.1. Метаболизм билирубина у здорового человека
- •2.4.7. Особенности патогенеза желтух
- •2.4.7.1. Гемолитическая желтуха
- •2.4.7.2.Паренхиматозная желтуха
- •2.4.7.3.Механическая желтуха
- •Сравнительная характеристика биохимических показателей при различных видах желтух
- •Глава 3. Мышечная ткань, строение, метаболизм
- •3.1. Скелетная мышечная ткань
- •3.1.1. Структурные компоненты скелетного мышечного волокна
- •3.1.2. Энергоисточники скелетных мышечных волокон
- •3.2. Метаболизм миокарда и гладких мышц в норме и при патологии
- •Глава 4. Основы нейробиохимии
- •4.1. Кислородное и энергетическое обеспечение нервной ткани
- •4.2. Особенности метаболизма липидов
- •4.3. Судьба аминокислот и белков в цнс
- •4.4. Природа химических сигналов
- •4.5. Механизмы регуляции системы кровь –мозг
- •Глава 1.
- •Глава 2.
- •Глава 3.
- •Глава 4.
- •Словарь использованных терминов
2.4.3. Структура и свойства гемоглобина
Практически весь объём цитоплазмы эритроцита занимает гемоглобин (Hb), представляющий 98% протеинов красных кровяных телец. Он включает в свой состав 4 молекулы гема с катионами железа, его глобин содержит 4 полипептидные цепи. Среди аминокислот в нём преобладают лейцин, валин, лизин (на их долю приходится до 1/3 всех мономеров). В норме уровень Нb в крови у мужчин – 140-180 г/л, у женщин – 120-160 г/л. В разные периоды жизни зародыша и ребёнка активно работают различные гены, ответственные за синтез специфических полипептидных цепей глобина. Выделяют 6 субъединиц: α, β, γ, δ, ε, ζ (альфа, бета, гамма, дельта, эпсилон, дзета соответственно). Первая и последняя из них включают по 141, остальные по 146 аминокислотных остатков. Друг от друга они отличаются не только количеством мономеров, но и их составом. Принцип образования вторичной структуры у всех цепей однотипен: они сильно (до 75% длины) спирализованы и удерживаются в такой форме за счет водородных связей. Компактная укладка этой молекулы в пространстве приводит к формированию третичной структуры; при этом создаётся карман, куда и вкладывается гем. Получившийся комплекс стабилизируется за счет гидрофобных взаимодействий между белком и простетической группой. Эта глобула объединяется с тремя сходными субъединицами, образуя четвертичную структуру, имеющую форму тетраэдра. Высокая растворимость Нb сохраняется только при наличии различных пар цепей. Если же объединяются одинаковые субъединицы, то происходит их быстрая денатурация, укорачивающая жизнь эритроцита.
В зависимости от природы включённых протомеров различают следующие виды нормальных гемоглобинов. Впервые 20 суток существования эмбриона в ретикулоцитах образуется HbP (Primitive) в виде двух вариантов: HbGower 1, состоящий из дзета– и эпсилон–цепей, соединённых попарно, и HbGower 2, в котором дзета– последовательности уже заменены на альфа. Переключение генеза одного вида структуры на другой осуществляется медленно: вначале появляются отдельные клетки, продуцирующие иной вариант. Они дают стимул клонам новых клеток, синтезирующих другой вид полипептида. Позднее такие эритробласты начинают преобладать и постепенно вытесняют старые. На 8-й неделе жизни зародыша включается синтез гемоглобина F=α2γ2, по мере же приближения акта родов появляются ретикулоциты, содержащие HbA=α2δ2. У новорожденных на его долю приходится 20-30%, у здорового взрослого человека его вклад составляет 96-98% от общей массы этого белка. Кроме того, в отдельных эритроцитах присутствуют гемоглобин HbA2=α2δ2 (1,5-3%) и фетальный гемоглобин HbF (обычно не более 2%). Однако в некоторых регионах, в том числе у здоровых аборигенов Забайкалья концентрация последнего вида бывает повышена до 4%.
Свойства гемоглобина
Всем известные гемопротеины (Hb, миоглобин, цитохромы, пероксидаза, каталаза) близки по строению не только простетической группы, но и апопротеина. Определённая общность в пространственной укладке обусловливает и сходство в функционировании – взаимодействии с газами, в основном с кислородом, CO2, СO, NO. Главное свойство Hb – способность обратимо присоединять в лёгких (до 94%) и эффективно отдавать в тканях кислород. Но поистине уникальным для этого белка является сочетание прочности связывания O2 при высоких его парциальных напряжениях и лёгкости диссоциации этого комплекса в области пониженных давлений. Кроме того, скорость распада оксигемоглобина зависит от температуры, рН среды. При накоплении углекислоты, лактата и других кислых продуктов происходит более быстрая отдача кислорода (эффект Бора). Также действует и лихорадка. При алкалозе, гипотермии следует обратное смещение, улучшаются условия насыщения Нb кислородом в лёгких, но полнота выхода газа в ткани уменьшается. Подобное явление наблюдается при гипервентиляции, замерзании и т. д. Попадая в условия острой гипоксии, эритроциты активируют гликолиз, что сопровождается увеличением содержания 2,3-ДФГК, последняя снижает сродство гемопротеида к кислороду, активирует дезоксигенацию крови в тканях. Интересно, что фетальный гемоглобин не способен взаимодействовать с ДФГК, сохраняя повышенное сродство к кислороду и в артериальной, и в венозной крови.
В зависимости от взаимоотношений с различными газами и некоторыми соединениями Нb принимает следующие формы:
1. Дезоксигемоглобин – свободная от газов форма протеина.
2.Оксигемоглобин _ продукт включения кислорода в молекулу белка. Одна молекула Нb способна удерживать 4 молекулы газа.
3.Карбгемоглобин уносит из тканей СО2, связавшийся с лизином этого протеина.
4. Монооксид углерода, проникая с атмосферным воздухом в легкие, быстро преодолевает альвеолярно-капиллярную мембрану, растворяется в плазме крови, диффундирует в эритроциты и вступает во взаимодействие с окси–и/или дезокси–Hb:
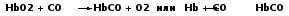
Образовавшийся карбоксигемоглобин не способен присоединять к себе кислород, а угарного газа может связывать 4 молекулы.
5. Важным производным Нb является метгемоглобин, в молекуле которого атом железа находится в степени окисления 3+. Такая форма гемопротеида образуется при действии на него различных окислителей, в результате в крови уменьшается количество функционально важного оксиНb, что нарушает доставку кислорода к тканям, вызывая в них развитие гипоксии.
6. Концевые аминокислоты в цепях глобина способны реагировать с моносахаридами, в первую очередь с глюкозой. В настоящее время выделяют несколько подвидов Нb А (от 0 до 1с), в которых к валину бета-цепей прикреплены олигосахариды. Особенно легко реагирует последний подвид гемопротеида. У образовавшегося при этом без участия фермента гликозилированного гемоглобина увеличивается сродство к кислороду. В норме на долю подобной формы гемоглобина приходится не более 5% от его общего количества. При сахарном диабете его концентрация возрастает в 2-3 раза, что благоприятствует возникновению тканевой гипоксии.
