
Журнал неврологии и психиатрии / 2009 / NEV_2009_07_09
.pdf
Опыт применения галантамина (реминил) в лечении болезни Альцгеймера на стадии тяжелой деменции
Д.м.н., проф., зав. отд. С.И. ГАВРИЛОВА1, к.м.н., в.н.с. И.В. КОЛЫХАЛОВ2, д.м.н., в.н.с. Я.Б. КАЛЫН, д.м.н., в.н.с. Н.Д. СЕЛЕЗНЕВА
Galantamine (reminyl) in the treatment of severe Alzheimer’s disease
S.I. GAVRILOVA, I.V. KOLYKHALOV, YA.B. KALYN, N.D. SELEZNEVA
Отдел по изучению болезни Альцгеймера и ассоциированных с ней расстройств Научного центра психического здоровья РАМН, Москва
Галантамином (реминилом) лечили 25 больных с болезнью Альцгеймера (БА) на стадии умеренно-тяжелой и тяжелой деменции. В течение 1-го месяца пациенты получали реминил в дозе 8 мг в сутки, со 2-го месяца доза повышалась до 16 мг в сутки, у 6 пациентов начиная с 3-го месяца дозировка была повышена до 24 мг в сутки. Общая продолжительность курса терапии составила 26 нед. Дополнительно получали антипсихотическую терапию 15 больных. Проведенное исследование показало, что реминил оказывает позитивное воздействие на когнитивные функции, а также на поведенческие и психотические симптомы деменции, в частности, бредовые расстройства, агрессиию, раздражительность, расторможенность, апатию, аберрантное моторное поведение, расстройства сна и аппетита. Терапевтическая редукция указанных расстройств приводит к заметному снижению как физической, так и моральной нагрузки на лиц, ухаживающих за больными. Установленные терапевтические эффекты реминила и его хорошая переносимость позволяют рекомендовать применение этого препарата у пациентов с БА на стадии тяжелой деменции.
Ключевые слова: болезнь Альцгеймера, когнитивные, поведенческие и психотические расстройства, тяжелая деменция, лечение, галантамин (реминил).
Twenty-five patients with Alzheimer’s disease (AD) in moderate-severe and severe stages received galantamine in dosage 8 mg daily during the 1st month with the following increasing to 16 mg daily. Six patients received 24 mg per day from the 3rd month. The total duration of therapy was 26 weeks. 15 patients received in addition the antipsychotic therapy. Reminyl had a positive effect on cognitive functions and psychotic symptoms of dementia, in particular delusions, aggression and irritability, apathy, aberrant motor behavior, eating and sleep disorders. The therapeutic reduction of these disorders resulted in the distinct reduction of physical and mental burden on the caregivers. The therapeutic effects of reminyl and its good tolerability allow to recommend this drug for treatment of severe stages of AD.
Key words: Alzheimer’s disease, cognitive, behavioral and psychotic disorders, severe dementia, treatment, galantamine (reminyl).
|
Психопатологические и поведенческие расстройства |
ние, симптомы депрессии, а также физическая агрессия и |
|
являются неотъемлемой частью синдрома деменции, обу- |
возбуждение. По мере нарастания тяжести когнитивного |
||
словленной болезнью Альцгеймера (БА). Уже в 1906 г. |
дефицита неуклонно растет также частота и выраженность |
||
Алоис Альцгеймер, описывая синдром афато-апракто- |
психотических и поведенческих симптомов БА [13]. По |
||
агностической деменции, получившей позднее наимено- |
мнению B. Jost и G. Grossberg [10], на протяжении всего |
||
вание БА, отметил, что психотические и поведенческие |
течения БА не менее чем у 80% больных развиваются та- |
||
симптомы являются такими же характерными проявле- |
кого рода симптомы. |
||
ниями болезни, как и когнитивные расстройства. Именно |
Существующие в настоящее время средства лечения |
||
эти симптомы вызывают наибольший стресс у тех лиц, |
БА (ингибиторы ацетилхолинэстеразы (АХЭ), мемантин, |
||
которые ухаживают за больными, и становятся наиболее |
церебролизин) способны стабилизировать на ограничен- |
||
серьезным аргументом в пользу принятия решения о по- |
ное время (от 1 года до 3 лет) или замедлить прогрессиро- |
||
мещении пациента в психиатрическую больницу или спе- |
вание когнитивного дефицита и нарастание тяжести де- |
||
циальное учреждение по уходу за дементными больными |
менции, если лечение начинается на стадии мягкой де- |
||
(интернат психоневрологического профиля). Среди пове- |
менции. На стадии умеренно выраженной деменции ре- |
||
денческих и психотических симптомов деменции чаще |
зультаты применения этих средств оказываются еще более |
||
всего встречаются бредовые и (реже) галлюцинаторные |
скромными. Однако даже при адекватной патогенетиче- |
||
расстройства, спутанность, апатия, аберрантное поведе- |
ской терапии у пациентов с БА неизбежно развивается |
||
|
|
|
|
|
© Коллектив авторов, 2009 |
1e-mail: sigavrilova@yandex.ru |
|
|
Zh Nevrol Psikhiatr Im SS Korsakova 2009;109:7:57 |
2e-mail: ikolykhalov@yandex.ru |
|
|
|
||
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 7, 2009 |
57 |

ЛЕЧЕНИЕ НЕРВНЫХ И ПСИХИЧЕСКИХ ЗАБОЛЕВАНИЙ
тяжелая деменция (исключение составляют лишь те пациенты, которые вследствие различных причин умирают на более ранних стадиях болезни). Некоторые специалисты и руководства по ведению больных с БА рекомендуют прекратить терапию ингибиторами АХЭ, как только пациент достигает тяжелой стадии болезни, и ограничиваться назначением мемантина и симптоматической терапии с применением антипсихотиков, антидепрессантов и/или гипнотиков.
Результаты выполненных ранее многочисленных исследований ингибиторов АХЭ, в частности галантамина, свидетельствуют о том, что назначение этих препаратов на стадии мягкой и умеренной деменции позволяет не только уменьшить тяжесть когнитивных расстройств и функционального дефицита в повседневных видах деятельности, но и оказывается достоверно эффективным по отношению к целому ряду поведенческих и психотических симптомов, таких как тревога, апатия, расторможенность, что подтверждается достоверной редукцией общего показателя шкалы NPI [3], которая позволяет оценивать не только выраженность различных поведенческих и психопатологических симптомов деменции, но и степень нагрузки на лиц, ухаживающих за больными [15, 21]. Аналогичные результаты были получены при изучении эффективности другого ингибитора АХЭ — ривастигмина — у пациентов с БА, находившихся в интернате с сестринским уходом [4]. При терапии ривастигмином тяжесть поведенческих и психотических симптомов уменьшилась у 58% пациентов.
Специальное исследование эффективности еще одного ингибитора АХЭ — донепезила — на стадии тяжелой БА было предпринято B. Winblad и соавт. [23]. В полугодовом двойном слепом плацебо-контролируемом исследовании была изучена эффективность донепезила у большой группы пациентов (248 человек) с тяжелой БА (MMSE<10) [7], находившихся в 50 шведских гериатрических учреждениях с квалифицированным сестринским уходом. Было установлено, что этот ингибитор АХЭ в большей мере сохраняет поведенческую активность и когнитивные функции таких пациентов по сравнению с группой аналогичных пациентов, получавших плацебо. В указанном исследовании было также отмечено относительно небольшое влияние донепезила на поведенческие и психотические симптомы деменции [3]. Однако авторы предположили, что этот эффект мог быть в значительной мере замаскирован сопутствующим назначением психоактивных препаратов, широко применяемых в учреждениях для хронических больных. По их мнению, этот вопрос требует дальнейшего более тщательного изучения. Донепезил у больных с тяжелой деменцией не влиял на продолжительность жизни пациентов (не увеличивал ее).
Аналогичных исследований эффективности применения галантамина (реминила) на стадии тяжелой БА до сих пор не предпринималось, хотя определенные фармакологические характеристики препарата, обусловленные его двойным механизмом действия как ингибитора АХЭ и аллостерического потенцирующего лиганда никотиновых рецепторов, также как и данные о клинических эффектах препарата в отношении психотических расстройств на стадии мягкой и умеренной деменции дают основание для предположения о возможной эффективности галантамина и на стадии тяжелой деменции, особенно в отношении поведенческих и психотических симптомов болезни.
Цель настоящей работы состояла в анализе опыта клинического применения препарата галантамин (реминил) у пациентов с умеренно-тяжелой и тяжелой деменцией, обусловленной БА.
Материал и методы
Клиническое исследование выполнялось как простое, открытое, в невыборочной группе из 25 больных (7 мужчин и 18 женщин, средний возраст которых был 72,0±1,5 года) с БА на стадии умеренно-тяжелой и тяжелой деменции, имевших психотические и поведенческие расстройства.
Раннее начало БА было у 10 пациентов, позднее — у
15.
Критерии включения в исследование были следующие: 1) женщины (в постменопаузальном периоде) и мужчины в возрасте от 50 до 85 лет; 2) клинический диагноз «вероятной» БА по критериям NINCDS/ADRDA [14]; 3) диагноз БА по МКБ-10; 4) 6—7-я стадия деменции по шкале глобального ухудшения Райсберга (GDS) [17]; 5) оценка от 5 до 11 баллов по MMSE; 6) оценка по шкале Хачински ≤4 баллов; 7) способность пациента выполнять простые психометрические тесты. Необходимым условием включения больных в исследование было получение письменного информированного согласия пациента и/или опекающего его лица на проведение исследования.
Из исследования исключались больные, имеющие: 1) неврологические заболевания (врожденные и/или приобретенные метаболические энцефалопатии, токсические и лекарственные энцефалопатии, болезнь Паркинсона, мультиинфарктную деменцию, инсульт, эпилепсию, инфекционные заболевания, демиелинизирующие и наслед- ственно-дегенеративные заболевания ЦНС); 2) неопластические и/или травматические повреждения головного мозга; 3) системные заболевания; 4) психические болезни; 5) тяжелую органную патологию, злокачественные опухоли, ВИЧ-инфекцию, сахарный диабет в стадии декомпенсации, другие эндокринные заболевания; 6) алкоголизм и/или лекарственную зависимость; 7) медикаментозную или иную интоксикацию; 8) оценку >18 по шкале Гамильтона для депрессии; 9) артериальную гипертензию с уровнем систолического давления свыше 180 мм рт.ст.
В течение 1-го месяца пациенты получали реминил в дозе 8 мг в сутки (в 2 приема), со 2-го месяца доза повышалась до 16 мг в сутки, у 6 пациентов начиная с 3-го месяца дозировка была повышена до 24 мг в сутки. Общая продолжительность терапии составила 26 нед. Дополнительно получали антипсихотическую терапию 15 больных (3 — атипичными антипсихотиками и 12 — нейролептиками).
К началу исследования среднегрупповые показатели когнитивного функционирования по краткой шкале оценки психического статуса — Mini-Mental State Examination (MMSE) [7] составляли 8,6±0,3 балла, по шкале Severe Impairment Battery (SIB) [20] — 47,7±3,9 балла, по шкале выраженности поведенческих и психотических симптомов деменции — Neuropsychiatric Inventory (NPI) — 32,0±2,7 балла.
Оценка состояния пациентов осуществлялась до начала терапии и к моменту окончания лечения (26-я неделя) по указанным выше шкалам и по шкале общего клинического впечатления — Clinical Global Impression (CGI).
58 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 7, 2009 |
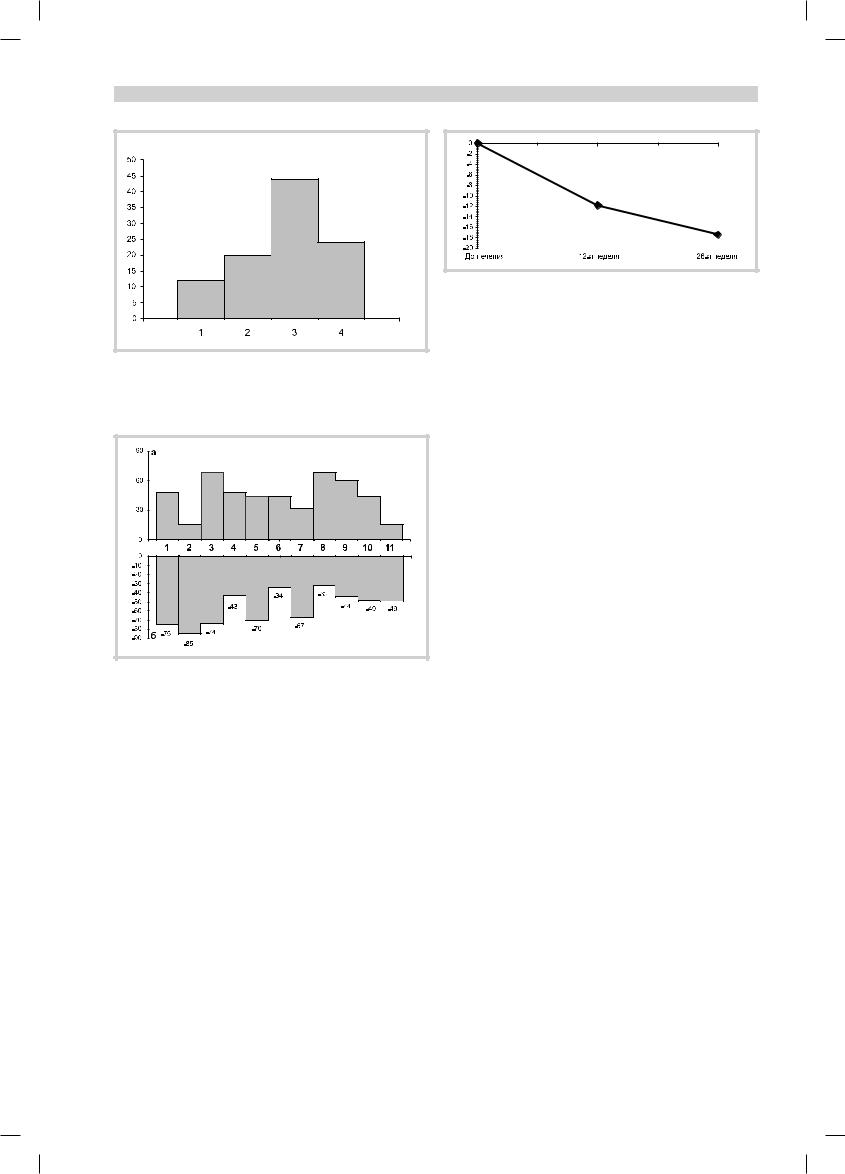
Рис. 1. Эффективность терапии реминилом по шкале CGI. |
По оси ординат — число больных в %. |
1 — минимальное ухудшение, 2 — отсутствие эффекта, 3 — минимальное |
улучшение, 4 — умеренное улучшение. |
Рис. 2. Частота поведенческих и психотических нарушений по |
шкале NPI (% к общему числу больных) к началу исследования |
(а) и их редукция (в % по сравнению с исходной оценкой) к кон- |
цу терапии (б). |
По оси ординат — %. По оси абсцисс: 1 — бредовые расстройства, 2 — агрессия, 3 — тревога, 4 — расторможенность, 5 — раздражительность, 6 — нарушение аппетита, 7 — галлюцинации, 8 — депрессия, 9 — апатия, 10 — аберрантное моторное поведение, 11 — расстройства сна.
Кроме того, по шкалам MMSE и NPI состояние пациентов дополнительно оценивалось к окончанию 12-й недели лечения.
Для установления достоверности результатов терапии использовались методы непараметрической статистики — вычисление критерия Вилкоксона (для выборок с любым распределением признаков).
Результаты
В соответствии со шкалой CGI положительный эффект терапии был отмечен в 68% случаев, при этом у 24% больных улучшение было оценено как умеренно выраженное. У 20% пациентов изменений состояния не наблюдалось, а у 12% больных состояние минимально ухудшилось (рис. 1). Улучшение в состоянии больных отмеча-
ЛЕЧЕНИЕ БОЛЕЗНИ АЛЬЦГЕЙМЕРА |
Рис. 3. Терапевтическая динамика выраженности поведенческих |
и психотических расстройств по шкале NPI (изменение средне- |
группового показателя по сравнению с исходной оценкой). |
лось за счет редукции поведенческих и психотических расстройств, одновременно снижалась физическая и моральная нагрузка на лиц, опекающих больных. Так, у 6 пациентов улучшилась способность к ориентировке в месте (в пределах квартиры), 4 стали проявлять инициативу в повседневной жизни (например, проситься в туалет, отвечать на телефонные звонки), 2 пациента стали лучше выполнять гигиенические процедуры и самостоятельно пользоваться ложкой.
Динамика состояния когнитивных функций в процессе лечения
Терапевтическая динамика когнитивного функционирования по шкале MMSE была следующей: до лечения
— 8,6±0,3 балла, после 12 нед терапии — 9,9±0,5 (р<0,05), после 26 нед — 9,7±0,7. По шкале SIB соответствующие показатели были: до лечения — 47,7±3,9 балла, после 26 нед — 49,3±4,3 балла.
Таким образом, к окончанию курса терапии установлено улучшение показателей когнитивного функционирования, при этом по шкале ММSЕ к окончанию 12-й недели терапии отмечалось достоверное улучшение состояния когнитивных функций по сравнению с исходным уровнем, но к моменту окончания лечения эти различия оказались уже недостоверными. По шкале SIB к окончанию терапии реминилом установлено незначительное (недостоверное) улучшение когнитивных функций по сравнению с исходным уровнем.
Динамика выраженности психотических и поведенческих расстройств в процессе лечения
У всех пациентов, включенных в исследование, до начала терапии были очень выражены поведенческие нарушения, оцениваемые по шкале NPI (рис. 2). Наиболее часто наблюдались аберрантное моторное поведение и агрессия (у 68% больных) и раздражительность (у 60%). Тревога, апатия и нарушение поведения в ночное время имели место у 44% больных, бредовые и депрессивные расстройства — у 48%, галлюцинации и расстройства аппетита отмечались лишь у 16% больных.
В процессе терапии отмечалось достоверное уменьшение суммарной оценки выраженности психотических и поведенческих симптомов деменции по шкале NPI как к 12-й неделе, так и к окончанию терапии — 26 нед (см. таблицу, рис. 2 и 3).
Анализ динамики отдельных групп симптомов, представленных в шкале NPI, показал, что к окончанию терапии достоверное улучшение отмечено по большинству (8 из 11) показателей шкалы. Достоверно уменьшилась
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 7, 2009 |
59 |

ЛЕЧЕНИЕ НЕРВНЫХ И ПСИХИЧЕСКИХ ЗАБОЛЕВАНИЙ
Терапевтическая динамика выраженности психотических и поведенческих нарушений по шкале NPI, баллы (M±m)
Расстройства |
До лечения |
12-я неделя |
26-я неделя |
Бредовые |
6,0±0,9 |
3,0±0,8* |
1,6±0,7* |
Галлюцинации |
8,3±1,7 |
3,0±2,0 |
1,3±0,9 |
Ажитация/агрессия |
4,9±0,8 |
2,9±0,6* |
1,3±0,3* |
Депрессия/дисфории |
4,6±0,9 |
3,3±0,7 |
2,7±0,7 |
Тревога |
6,0±1,2 |
4,0±0,9* |
1,8±0,5* |
Апатия/индифферентность |
7,6±0,8 |
5,9±1,0 |
5,0±1,0* |
Расторможенность |
7,3±1,0 |
3,4±1,1* |
2,4±1,1* |
Раздражительность/неустойчивость настроения |
5,5±0,8 |
3,9±0,9* |
3,1±0,8* |
Отклоняющееся от нормы моторное поведение |
7,8±0,8 |
5,8±1,0* |
5,3±1,1* |
Расстройство сна и поведения в ночное время |
7,4±0,8 |
4,4±1,0* |
3,7±1,0* |
Расстройство аппетита |
6,5±1,0 |
4,0±0,8 |
3,3±1,1 |
Суммарная оценка |
32,0±2,7 |
20,2±2,5* |
14,6±3,0* |
Стрессовая нагрузка на лицо, ухаживающее за больным |
14,6±1,3 |
10,5±1,5* |
8,3±1,8* |
Примечание. * — Достоверные различия по сравнению с оценкой до начала терапии на уровне р<0,05.
выраженность бредовых расстройств, агрессии, тревоги, апатии, расторможенности, раздражительности, аберрантного моторного поведения и расстройств сна. Причем достоверная положительная динамика по большинству из этих показателей отмечалась уже через 12 нед лечения. Не установлено, однако, достоверных различий по показателям шкалы NPI, оценивающих выраженность галлюцинаторных и депрессивных расстройств, а также расстройств аппетита, хотя их выраженность также уменьшилась.
Уход за больными, страдающими тяжелой деменцией, сопровождается большой стрессовой (моральной и физической) нагрузкой на лиц, непосредственно ухаживающих за ними, поэтому важно было оценить, может ли применение реминила на этой стадии болезни снизить ее. Анализ динамики показателей соответствующих пунктов шкалы NPI подтвердил, что применение реминила способствует достоверному снижению стрессовой нагрузки на лиц, ухаживающих за пациентами с тяжелой БА. Уже к 12-й неделе терапии стрессовая нагрузка снизилась на 27,1%, а к моменту окончания терапевтического курса уже на 43,2% по сравнению с исходным уровнем (см. таблицу).
Нежелательные явления
В период терапии реминилом нежелательные явления отмечались у 29% больных. Наиболее часто наблюдалось ощущение тошноты при начале терапии или при повышении дозы реминила. У 1 пациента такие явления отмечались в начале приема препарата (на 2-й день лечения при дозе 8 мг в сутки) и прошли через 3 дня. У 2 больных тошнота возникла при переходе к дозе 16 мг в сутки и у 2 пациентов — при переходе к дозе 24 мг в сутки. Эти явления наблюдались 5—7 дней, а затем больные адаптировались к дозе препарата, и ее снижения не потребовалось.
Обсуждение
Во многих исследованиях было показано положительное влияние ингибиторов АХЭ на поведенческие и психотические симптомы деменции, обусловленной БА (на стадии мягкой и умеренной деменции). Большинство данных о влиянии ингибиторов АХЭ на поведенческие и психотические проявления деменции было получено в
исследованиях, направленных на изучение влияния указанных лекарственных средств на когнитивные расстройства.
Эффекты ингибиторов АХЭ в отношении поведенческих расстройств были впервые изучены в открытых исследованиях такрина [12] и ривастигмина [19], а также в двойных слепых плацебо-контролируемых исследованиях метрифоната [16], а позднее донепезила [6, 9]. В этих исследованиях было установлено, что такрин уменьшал апатию, беспокойство, расторможенность и аберрантное моторное поведение, метрифонат достоверно уменьшал зрительные галлюцинации, а ривастигмин редуцировал расстройства настроения и галлюцинации. В открытом исследовании, проведенном в группе из 746 пациентов с мягкой/умеренной БА на протяжении 6 мес, отмечалось, что после лечения ривастигмином были отменены или заметно снижены дозы нейролептиков, транквилизаторов и антидепрессантов, ранее назначавшихся пациентам в связи с поведенческими и психотическими расстройствами [22]. По данным H. Feldman и соавт. [6], терапия донепезилом приводила к уменьшению суммарной оценки по шкале NPI и редукции таких симптомов, как беспокойство, депрессия и апатия у пациентов с умеренной и тяжелой деменцией. Позже С. Holmes и соавт. [9] сообщили о существенном положительном влиянии донепезила на поведенческие и психотические симптомы при лечении большой группы (134 человека) пациентов с БА на стадии мягкой и умеренной деменции.
Галантамин, в отличие от других ингибиторов АХЭ, осуществляет не только ингибирование АХЭ, но и аллостерическую модуляцию никотиновых рецепторов, чем, возможно, обусловлены еще более выраженные эффекты препарата в отношении поведенческих и психотических симптомов БА. В двойном слепом плацебоконтролируемом исследовании с участием 978 пациентов с БА, лечившихся в течение 5 мес галантамином (в дозах от 16 до 24 мг в сутки), отмечалось достоверное уменьшение частоты и тяжести расстройств по 10 психотическим и поведенческим признакам шкалы NPI по сравнению с плацебо [21]. Эти данные нашли подтверждение в исследовании A. Monsch и соавт. [15], которые установили помимо этого снижение нагрузки на ухаживающих за больными лиц.
60 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 7, 2009 |

ЛЕЧЕНИЕ БОЛЕЗНИ АЛЬЦГЕЙМЕРА
Относительно возможных механизмов, которые определяют воздействие галантамина на поведенческие и психотические симптомы, существуют различные предположения. Повышение активности лимбической системы за счет ингибирования АХЭ может само по себе уменьшить поведенческие нарушения [8]. Кроме того, за счет аллостерической модуляции никотиновых рецепторов при воздействии галантамина может уменьшаться аберрантное моторное поведение и ажитация, подобно тому, как психостимуляторы уменьшают признаки гиперактивности у детей с расстройством дефицита внимания [18]. К этому можно добавить, что активация никотиновых рецепторов в лобных областях уменьшает ажитацию, расторможенность и апатию, которые связаны с поражением медиальных лобных структур [1, 2]. Кроме того, галантамин может оказывать воздействие на психотические расстройства путем опосредованного влияния на другие нейротрансмиттерные системы [5, 11].
Опыт клинического применения реминила у пациентов с БА на стадии тяжелой деменции показал, что препарат оказывает только ограниченное позитивное влияние на когнитивные функции у данной категории пациентов. Однако у этих пациентов отмечается достоверный положительный эффект в отношении поведенческих и психотических симптомов деменции, в частности, бредовых расстройств, агрессии, раздражительности, расторможенности, апатии, аберрантного моторного поведения, расстройств сна и аппетита. Терапевтическая редукция указанных расстройств приводит в свою очередь к заметному снижению как физической, так и моральной нагрузки на лиц, которые проживают с больными и осуществляют уход за ними. Установленные терапевтические эффекты галантамина и его хорошая переносимость позволяют рекомендовать применение этого препарата у пациентов с БА не только на стадии мягкой и умеренной, но и тяжелой деменции.
ЛИТЕРАТУРА
1.Arneric S.P. Neurobiology and clinical pathophysiology of neuronal nico13. Kozman M.N., Wattis J., Curran S. Pharmacological management of behav-
tinic acetylcholine receptors, in Nicotine in Psychiatry: Psychopathology and Emerging Therapeutics. Ed. M. Piasecki. Newhouse PA. Washington 2000; 3—35.
2.Craig A.H., Cummings J.L., Fairbanks L. et al. Cerebral blood flow correlates of apathy in Alzheimer’s disease. Arch Neurol 1996; 53: 1116—1120.
3.Cummings J.L., Mega M., Gray K. et al. The Neuropsychiatric Inventory: comprehensive assessment of psychopathology in dementia. Neurology 1994; 44: 12: 2308—2314.
4.Cummings J.L. Use of cholinesterase inhibitors in clinical practice: evidence based recommendations. Am J Geriat Psychiat 2003; 11: 2: 131—145.
5.Dani J.A. Overview of nicotinic receptors and their roles in the central nervous system. Biol Psychiat 2001; 49: 166—174.
6.Feldman H., Gauthier S., Hecker J. et al. A 24-week, randomized, doubleblind study of donepezil in moderate to severe Alzheimer’s disease. Neurology 2001; 57: 613—620.
7.Folstein M.F., Folstein S.E., McHugh P.R. Mini-Mental State. A practical method of grading the cognitive state of patients for the clinician. J Psychiat Res 1975; 12: 189—198.
8.Guela C., Mesulam M.-M. Cholinergic systems and related neuropathological predilection patterns in Alzheimer disease. Ed. R.D. Terry, R. Katzman, K.L. Bick. New York 1994; 263—291.
9.Holmes C., Wilkinson D., Dean C. et al. The efficacy of donepezil in the treatment of neuropsychiatric symptoms in Alzheimer’s disease. Neurology 2004; 63: 214—219.
10.Jost B.C., Grossberg G.T. The evolution of psychiatric symptoms in Alzheimer’s disease: a natural history study. Am J Geriatr Psychiat 1996; 4: 4: 383—384.
11.Kaiser S., Wonnacott S. Nicotinic receptor modulation of neurotransmitter release, in Neuronal Nicotinic Receptors: Pharmacology and Therapeutic Opportunities. Ed. S.P. Arneric, J.D. Brioni. New York 1998; 141—149.
12.Kaufer D.I., Cummings J.L., Christine D. Effect of tacrine on behavioral symptoms in Alzheimer’s disease: an open-label study. J Geriat Psychiat Neurol 1996; 9: 1—6.
ioural and psychological disturbance in dementia. Hum Psychopharmacol Clin Exp 2006; 21: 1—12.
14.McKhann G., Drachman D., Folstein et al. Clinical diagnosis of Alzheimer’s disease: report of the NINCDS/ADRDA Work Group under the auspices of Department of Health and Human Services Task Force on Alzheimer’s disease. Neurology 1984; 34: 939—944.
15.Monsch A.U., Heiter-Reiffenstuhl I., Braendle D. Galantamine reduces behavioural and psychological disturbances and related caregiver burden in Alzheimer’s disease patients. In: 6th Congress of the European Federation of Neurological Societies. Vienna 2002.
16.Morris J.C., Cyrus P.A., Orazem J. et al. Metrifonate benefits cognitive, behavioral, and global function in patients with Alzheimer’s disease. Neurology 1998; 50: 1222—1230.
17.Reisberg B., Ferris S.H., de Leon M.J. et al. The global deterioration scale (GDS). An instrument for the assessment of primary degenerative dementia. Am J Psychiat 1982; 139: 1136—1139.
18.Rezvani A.H., Levin E.D. Cognitive effects of nicotine. Biol Psychiat 2001; 49: 258—267.
19.Rosler M., Retz W., Retz-Junginger P., Dennler H.J. Effects of two-year treatment with the cholinesterase inhibitor rivastigmine on behavioural symptoms in Alzheimer’s disease. Behav Neurol 1998; 11: 211—216.
20.Saxton J., McGonigle-Gibson K.L., Swihart A.A., Miller V.J. Boller Assessment of the severely-impaired patient: description and validation of a new neuropsychological test battery. Psychological Assessment. A J Consult Clin Psychol 1990; 2: 298—303.
21.Tariot P.N., Solomon P.R., Morris J.C. et al. A 5-month, randomized, place- bo-controlled trial of galantamine in AD. Neurology 2000; 54: 2269— 2276.
22.Verny M., Fremont P., Bourrin J.C. et al. Reduced psychotropic drug use in patients with Alzheimer’s disease receiving rivastigmine: results of the EXELAN study. J Drug Ass 2004; 7: 1—10.
23.Winblad B., Kilander L., Eriksson S. et al. Donepezil in patients with severe Alzheimer’s disease: double-blind, parallel-group, placebo-controlled study. Lancet 2006; 1: 367: 9516: 1057—1065.
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 7, 2009 |
61 |
