
Журнал неврологии и психиатрии / 2009 / NEV_2009_02_10
.pdf
ЭКСПЕРИМЕНТАЛЬНО-ТЕОРЕТИЧЕСКИЕ ВОПРОСЫ
Роль аполипопротеина Е у больных боковым амиотрофическим склерозом (клинико-генетическое исследование)
Е.В. КУТАКОВА, М.Н. ЗАХАРОВА, С.Н. ИЛЛАРИОШКИН, С.А. КЛЮШНИКОВ, И.А. ЗАВАЛИШИН, И.А. ИВАНОВА-СМОЛЕНСКАЯ
The role of apolipoprotein E in patients with amyotrophic lateral sclerosis (a clinical and genetic study)
E.V. KUTAKOVA, M.N. ZAKHAROVA, S.N. ILLARIOSHKIN, S.A. KLYUSHNIKOV, I.A. ZAVALISHIN, I.A. IVANOVA-SMOLENSKAYA
Научный центр неврологии РАМН, Москва
Обследовали 62 больных спорадической формой бокового амиотрофического склероза (БАС) в возрасте от 20 до 75 лет (средний 49,5±14,2 года). Неврологический дефицит и скорость прогрессирования заболевания оценивались по шкале ALS FRS (от 12 до 37 баллов). Для идентификации полиморфных аллелей гена аполипопротеина Е (апоЕ) участки ДНК амплифицировались в полимеразной цепной реакции. В качестве нормального распределения частоты генотипов использовались данные литературы для 207 лиц славянской популяции России. Большая продолжительность жизни при БАС была связана с медленным типом прогрессирования заболевания и более поздним присоединением бульбарных нарушений, что чаще отмечалось при спинальной форме БАС и у более молодых больных. Статистически значимых различий в распределении генотипов апоЕ между группой пациентов и контролем не было выявлено. Среди носителей аллеля апоЕ-е2 в группе больных БАС чаще встречались молодые больные (p<0,004), чаще выявлялась спинальная форма БАС (р<0,05), ниже был риск развития бульбарной формы заболевания (отношение шансов = 4,2; 95% доверительный
интервал [–15,48; –2,94]). Таким образом, генотип апоЕ не является самостоятельным фактором риска развития БАС, но наличие аллеля aпоЕ-e2 может рассматриваться как относительный нейропротективный фактор при развитии нейродегенеративного процесса. Данные о «защитной» роли аллеля апоЕ-е2 при БАС совпадают с данными при других нейродегенеративных заболеваниях.
Ключевые слова: нейродегенеративные заболевания, боковой амиотрофический склероз, аполипопротеин Е, генетический
полиморфизм.
The apolipoprotein E (apoE) gene plays an important role in forming predisposition and modulating the course of Alzheimer’s disease, primary parkinsonism and some other human neurodegenerative disorders. In this study, for the first time in the Russian population, we performed the analysis of genetic association of apoE gene variants in 62 patients with a sporadic form of amyotrophic lateral sclerosis (ALS) aged from 20 to 75 years (49,5±14,2); age at disease onset was from 18 to 74 years (47,1±15,2). No statistically significant differences in the distribution of apoE genotypes between patients and controls were found. It was shown that the frequency of the apoE-e2 allele was significantly higher in the young group characterized by more benign course of ALS (spinal variant, slow rate of progression of ALS and longer survival) as well as in patients with a more “benign” spinal form of the disease. On the contrary, the chance of carrying the apoE-e4 allele is higher in the older age group in which a prognostically more severe bulbar form is also more prevalent. Therefore, the apoE-e2 allele may be regarded as a neuroprotective factor in the development of neurodegenerative process in patients with ALS.
Key words: neurodegenerative diseases, amyotrophic lateral sclerosis, apolipoprotein E, genetic polymorphism.
|
Боковой амиотрофический склероз (БАС) — нейро- |
подходом при изучении роли генетической составляющей |
||
дегенеративное заболевание, обусловленное поражением |
в патогенезе мультифакториальных заболеваний человека |
|||
верхнего и нижнего мотонейронов, а также вовлечением в |
является анализ генетических ассоциаций — исследова- |
|||
процесс нисходящих пирамидных путей [2, 6]. Заболева- |
ние взаимоотношения изучаемой болезни с полиморфиз- |
|||
ние характеризуется необратимостью и прогрессирую- |
мами в соответствующих генах-кандидатах [5, 15]. |
|||
щим, фатальным течением, что обусловливает актуаль- |
При исследовании патогенеза БАС в качестве гена- |
|||
ность исследований данной проблемы. |
кандидата рассматривается ген аполипопротеина Е |
|||
|
БАС относится к мультифакториальным заболевани- |
(апоЕ), расположенный на хромосоме 19q13.2 [3, 12, 16, |
||
ям и является результатом взаимодействия генетических и |
22]. Существует три изоформы белкового продукта данно- |
|||
средовых факторов [1, 5]. В настоящее время ведущим |
го гена, кодируемые аллелями е2, е3 и е4. Эти изоформы, |
|||
|
|
|
различные по аминокислотному составу, отличаются вы- |
|
|
|
|
раженностью междоменного взаимодействия и стабиль- |
|
© Коллектив авторов, 2009 |
||||
ностью молекулы [11, 13, 16]. Стабильность молекулы |
||||
|
|
|
||
Zh Nevrol Psikhiatr Im SS Korsakova 2009;109:2:51 |
апоЕ увеличивается в ряду апоЕ-е4<апоЕ-е3<апоЕ-е2, а |
|||
выраженность междоменных взаимодействий в ряду |
||||
|
|
|
||
51

ЭКСПЕРИМЕНТАЛЬНО-ТЕОРЕТИЧЕСКИЕ ВОПРОСЫ
апоЕ-е4>апоЕ-е3>апоЕ-е2, напротив, уменьшается. Предполагается, что с взаимодействием концевых участков молекулы апоЕ-е4 связано проявление ряда патологических эффектов данной изоформы в нервной системе: увеличение продукции β-амилоида, потенцирование амилоидиндуцированного высвобождения лизосомальных ферментов, усиление протеолитических процессов в нейроне, запуск программы апоптоза [10, 11, 13, 16, 21]. Обсуждается роль апоЕ в качестве «патологического шаперона», который, связываясь с β-амилоидом (основным компонентом амилоидных бляшек), переводит его в нерастворимую форму, склонную к избыточной агрегации [4, 10, 13]. Следует добавить, что одной из главных функций аполипопротеина Е является участие в обеспечении нейропластичности [10, 11, 22], что реализуется за счет участия апоЕ в процессах спрутинга, синаптогенеза и регенерации нейрональных мембран [16, 19]. Эффективнее всего указанные функции осуществляются изоформой апоЕ-е2 как самой стабильной молекулой, а наименее эффективно — апоЕ-е4 [11, 17, 19]. Не случайно с аллелем апоЕ-е2 связывают реализацию нейропротекторных механизмов, снижающих интенсивность процессов нейродегенерации [2, 4, 5, 8, 11, 12].
Убедительная связь апоЕ с нейродегенеративной патологией продемонстрирована при болезни Альцгеймера (БА). Так, в различных популяциях мира выявлена выраженная ассоциация аллеля апоЕ-е4 с данным заболеванием, а также «неблагоприятный» дозозависимый эффект аллеля е4 в отношении возраста манифестации БА (каждая копия апоЕ-е4 приближает начало болезни на 7—9 лет) [12, 16, 20]. Подтверждением патогенетической значимости ассоциаций аллелей апоЕ и БА являются данные [20] о взаимосвязи различных генетических вариантов апоЕ с особенностями клинической картины заболевания, интенсивностью депонирования β-амилоида в сенильных бляшках и стенках церебральных сосудов, реакцией на проводимое лечение. Повышенная частота аллеля апоЕ-е4 обнаружена также у больных кортико-базальной дегенерацией, болезнью Пика и прогрессирующим надъядерным параличом [18]. При деменции с тельцами Леви у носителей апоЕ-е4 выявлена более высокая плотность телец Леви по сравнению с больными, имеющими другие аллели гена апоЕ [17]. Противоречивы данные о связи апоЕ-е4 с болезнью Паркинсона [3, 22], но некоторыми исследователями [14] такая связь была выявлена, особенно при комбинации апоЕ-е4 с определенным гаплотипом гена α-синуклеина. Показано также отчетливое влияние апоЕ на интенсивность течения нейродегенеративного процесса [12, 19].
Данные многочисленных исследований позволяют предполагать универсальность ключевых молекулярных механизмов развития нейродегенеративных заболеваний [5]. С учетом доказанной роли изоформ белка апоЕ в формировании белковых агрегатов при БА и других форм патологии, актуальным представляется продолжение данных исследований и применительно к одному из наиболее тяжелых нейродегенеративных заболеваний человека — БАС.
Цель исследования — анализ полиморфизма гена апоЕ у больных БАС в российской (преимущественно славянской) популяции и выявление клинических особенностей заболевания у носителей различных генотипов.
Материал и методы
Проведено клинико-генетическое обследование 62 больных (38 мужчин и 24 женщины) спорадической формой БАС в возрасте от 20 до 75 лет (49,5±14,2 года), возраст манифестации симптоматики — от 18 до 74 лет (47,1±15,2 года). Диагноз достоверного БАС устанавливался на основании стандартных критериев El. Escorial [9]. Неврологический дефицит у обследованных пациентов составил от 12 до 37 баллов по функциональной шкале неврологического дефицита (ALS FRS).
Для идентификации полиморфных аллелей гена апоЕ участки ДНК амплифицировались в полимеразной цепной реакции (ПЦР) с использованием праймеров: forward 5’-TAAGCTTGGCACGGCTGTCCAAGGA-3’, reverse 5’- ACAGAATTCGCCCCGGCCTGGTACACTGCCA-3’.
Продукты рестрикционного анализа подвергали электрофоретическому разделению в 4% агарозном геле с окраской геля бромистым этидием и визуализацией ДНК в ультрафиолете. Размеры ПЦР-продуктов, а также фрагменты рестрикции оценивали при сравнении с маркерными фрагментами ДНК pBR 50.
Анализ аллельных вариантов гена апоЕ проводили путем оценки комбинации фрагментов рестрикции различной длины. Образец электрофореграммы представлен на рис. 1.
В качестве нормального распределения частоты генотипов в соответствующих возрастных группах использовали данные Т.В. Щербатых [7] для 207 лиц из славянской популяции России.
Полученные данные анализировали с помощью пакета прикладных программ STATISTICA с использованием точного критерия Фишера, критерия χ2, отношения шансов (ОШ).
Результаты и обсуждение
На основании проведенного неврологического осмотра, данных анамнеза и соматического статуса, а также оценки степени неврологического дефицита по шкале ALS FRS были выделены подгруппы больных в зависимости от ключевых клинических показателей: возраст (до 40 лет, 41 год — 60 лет, старше 60 лет); форма заболевания (спинальная, бульбарная); темп прогрессирования (медленный, быстрый); длительность заболевания (до или свыше 24 мес).
Бульбарная форма заболевания, выявленная у 8 человек, встречалась только в старшей возрастной группе, тогда как спинальная — во всех выделенных по возрасту подгруппах.
В качестве критериев, отражающих тяжесть течения БАС, использовали темп прогрессирования заболевания и его длительность.
Рис. 1. Образец электрофореграммы ПЦР-продуктов.
52 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 2, 2009 |
ГЕНЕТИКА БАС
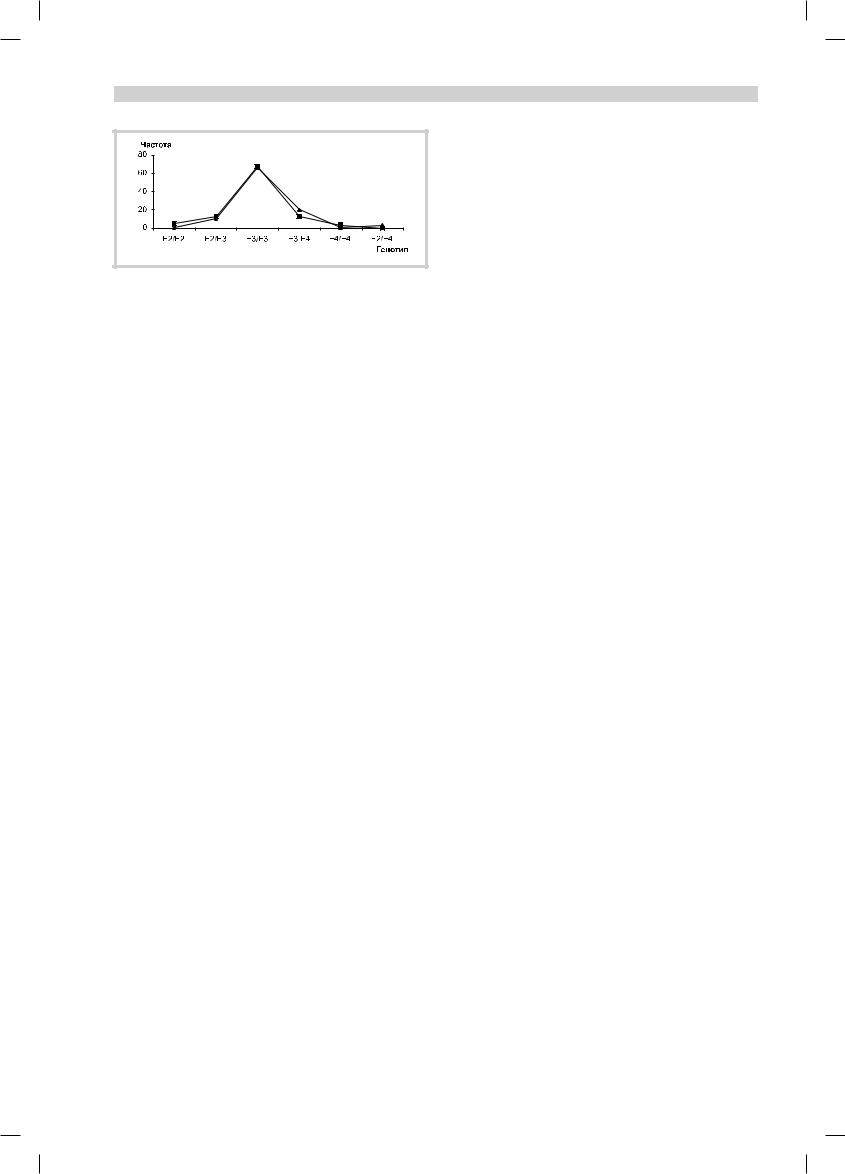
Рис. 2. Распределение частоты генотипов апоЕ в группе больных |
БАС (сплошная линия) и славянской российской популяции (пун- |
ктирная линия). |
Темп прогрессирования БАС определялся на основании нарастания неврологического дефицита, вычисляемого по шкале ALS FRS. Быстрый темп прогрессирования, которому соответствует снижение количества баллов шкалы на 10, встречался чаще у больных бульбарной формой заболевания. Для больных спинальной формой БАС более характерен медленный темп прогрессирования, что явилось особенно значимым для молодых больных, из которых у 88,2% было зарегистрировано медленное течение заболевания.
Длительность заболевания является лишь косвенным критерием тяжести течения БАС, так как при этом необходимо учитывать время выявления заболевания. Оценка по данному критерию показала, что у молодых больных заболевание протекает более благоприятно — его длительность составляет свыше 24 мес (р=0,048).
Таким образом, у молодых больных чаще развивается спинальная форма БАС, протекающая с медленным темпом прогрессирования. Более благоприятное течение БАС связано как с собственно медленным течением заболевания, так и более поздним присоединением бульбарных нарушений.
Выявленные клинические особенности заболевания были сопоставлены с носительством конкретных аллелей полиморфного локуса гена апоЕ.
На рис. 2 представлено распределение частот генотипов апоЕ в исследуемой группе и славянской российской популяции.
Как видно из рис. 2, статистически значимых различий в распределении генотипов апоЕ между группой пациентов и контролем выявлено не было (χ2=5,54; p<0,06).
Для определения ассоциаций полиморфизма гена апоЕ с клиническими особенностями заболевания проводился анализ ОШ носительства аллелей е2 и е4 гена апоЕ в подгруппах.
Была выявлена ассоциация между генотипом апоЕ и возрастом больных БАС: среди носителей е2 аллеля больше молодых больных БАС (p<0,004). Кроме того, среди носителей е4 аллеля больше лиц старше 60 лет, что говорит о более позднем дебюте заболевания (ОШ=0,3; [колеблется от –2,74 до 0,07]). Однако этот вывод можно поставить под сомнение, учитывая небольшую выборку соответствующих пациентов.
Также была выявлена ассоциация между генотипом апоЕ и формой БАС: у носителей е2 аллеля чаще развивается спинальная форма БАС (р<0,05), что подтверждается и анализом ОШ: у носителей е2 аллеля ниже риск развития бульбарной формы БАС (ОШ=4,2; [–15,48 — –2,94]). Кроме того, для носителей е2 аллеля характерна большая длительность заболевания (ОШ=0,5; [–1,98—0,29]).
Таким образом, несмотря на отсутствие статистически значимых различий в распределении частот генотипов апоЕ среди больных БАС и здоровых, нами была выявлена ассоциация полиморфизма гена апоЕ с клиническими особенностями заболевания. Установлено, что частота носительства аллеля апоЕ-е2 выше в младшей возрастной группе, для которой характерно более благоприятное течение БАС (спинальная форма заболевания, медленный темп прогрессирования и большая продолжительность жизни), а также среди лиц, страдающих спинальной формой заболевания. Напротив, шанс носительства аллеля апоЕ-е4 выше в старшей возрастной группе, где чаще встречается быстропрогрессирующая бульбарная форма заболевания.
Полученные результаты показывают, что в обследованной популяции генотип апоЕ не является самостоятельным фактором риска развития БАС. Не выявлено также прямых данных в пользу негативного модулирующего эффекта апоЕ-е4 гена на течение заболевания. При этом установлено, что аллель апоЕ-е2 может рассматриваться как относительный нейропротективный фактор при развитии нейродегенеративного процесса. Свидетельства определенной «защитной» роли апоЕ-е2 при БАС совпадают с аналогичными данными по этому аллелю и при некоторых других нейродегенеративных заболеваниях [2, 5, 18], что подтверждает наличие универсальных закономерностей развития патологического процесса при разных формах нейродегенераций у человека.
ЛИТЕРАТУРА
1.Андерсен П.М. (Andersen P.M.) Генетика бокового амиотрофического склероза. Журн неврол психиат 2001; 3: 54—63.
2.Завалишин И.А. Клиника, классификация, диагностика. В кн.: Боковой амиотрофический склероз. Руководство для врачей. Под. ред. И.А. Завалишина. М: Евразия плюс 2007; 229—255.
3.Загоровская Т.Б., Иллариошкин С.Н., Маркова Е.Д., ИвановаСмоленская И.А. Модифицирующий эффект гена аполипопротеина Е при болезни Паркинсона. Мед ген 2003; 7: 320—323.
4.Иллариошкин С.Н. Конформационные болезни мозга. М.: Янус-К, 2003.
5.Иллариошкин С.Н. Генетика. В кн.: Боковой амиотрофический склероз. Руководство для врачей. Под. ред. И.А. Завалишина. М: Евразия плюс 2007; 229—255.
6.Хондкариан О.А., Бунина Т.Л., Завалишин И.А. Боковой амиотрофический склероз. М: Медицина 1978.
7.Щербатых Т.В. Анализ генетических ассоциаций полиморфизма в генах-кандидатах с болезнью Альцгеймера и эндогенными психическими заболеваниями: Дис. ... канд. биол. наук. М 2000.
8.Beyer K. et al. Identification of a protective allele against Alzheimer disease in the APOE gene promoter. Neuroreport 2002; 13: 11: 1403—1405.
9.Brooks B.R. El Escorial World Federation of Neurology criteria for the diagnosis of amyotrophic lateral sclerosis. Subcommittee on Motor Neuron Diseases/Amyotrophic Lateral Sclerosis of the World Federation of Neurology Research Group on Neuromuscular Diseases and the El Escorial ‘Clinical limits of amyotrophic lateral sclerosis’ workshop contributors. J Neurol Sci 1994; 124: Suppl: 96—107.
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 2, 2009 |
53 |

ЭКСПЕРИМЕНТАЛЬНО-ТЕОРЕТИЧЕСКИЕ ВОПРОСЫ
10.Cedazo-Minguez A. Apolipoprotein E and Alzheimer’s disease: molecular mechanisms and therapeutic opportunities. J Cell Mol Med 2007; 11: 6: 1227—1238.
11.Chang S. et al. Lipidand receptor-binding regions of apolipoprotein E4 fragments act in concert to cause mitochondrial dysfunction and neurotoxicity. Proc Natl Acad Sci USA 2005; 102: 51: 18694—18699.
12.Higgins G.A. et al. Apolipoprotein E and Alzheimer’s disease: a review of recent studies. Pharmacol Biochem Behav 1997; 56: 4: 675—685.
17.Mann D., Brown S., Owen F. et al. Amyloid beta protein (Aβ) depositions in dementia with Lewy bodies: predominance of Aβ 42(43) and paucity of Aβ 40 compared with sporadic Alzheimer’s disease. Neuropathol Appl Neurobiol 1998; 24: 187—194.
18.Schneider J., Gearing M., Robbins R. et al. Apolipoprotein E genotype in diverse neurodegenerative disorders. Ann Neurol 1995; 38: 131—135.
19.Sporis D. et al. Association of refractory complex partial seizures with a polymorphism of ApoE genotype. J Cell Mol Med 2005; 9: 3: 698—703.
13.Huang Y. et al. Molecular and cellular mechanisms of apolipoprotein E4 20. Strittmatter W., Roses A. Apolipoprotein E and Alzheimer’s disease. Annu
neurotoxicity and potential therapeutic strategies. Curr Opin Drug Discov Devel 2006; 9: 5: 627—641.
14.Krüger R., Vieira-Saecker A., Kuhn W. et al. Increased susceptibility to sporadic Parkinson disease by a certain combined α-synuclein/apolipoprotein E genotype. Ann Neur 1999; 45: 611—617.
15.Lander E.S., Schork N.J. Genetic dissection of complex traits. Science 1994; 265: 5181: 2037—2048.
16.Mahley R.W., Weisgraber K.H., Huang Y. Apolipoprotein E4: a causative factor and therapeutic target in neuropathology, including Alzheimer’s disease. Proc Natl Acad Sci USA 2006; 103: 15: 5644—5651.
Rev Neurosci 1996; 19: 53—77.
21.Tolar M. et al. Neurotoxicity of the 22 kDa thrombin-cleavage fragment of apolipoprotein E and related synthetic peptides is receptor-mediated. J Neurosci 1997; 17: 15: 5678—5686.
22.Zareparsi S., Kay J., Camicioli R. et al. Modulation of the age at onset of Parkinson’s disease. Ann Neurol 1997; 42: 655—658.
54 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 2, 2009 |
