
Журнал неврологии и психиатрии / 2010 / NEV_2010_06_095
.pdf
КРАТКИЕ СООБЩЕНИЯ
Окислительные процессы и обмен липидов при экспериментальном паркинсоническом синдроме
Л.М. ОВСЕПЯН, Г.С. КАЗАРЯН, А.В. ЗАКАРЯН, М.В. ЛЬВОВ, М.М. МЕЛКОНЯН, Г.В. ЗАХАРЯН, А.А. АКОПДЖАНЯН
Oxidative processes and lipid metabolism in the experimental induced parkinsonian syndrome
L.M. OVSEPYAN, G.S. KAZARYAN, A.V. ZAKARYAN, M.V. LVOV, M.M. MELKONYAN, G.V. ZAKHARYAN, A.A. AKOPGANYAN
Институт молекулярной биологии Национальной академии наук Армении, Ереван
Ключевые слова: болезнь Паркинсона, перекисное окисление липидов, фосфолипиды, гликолипиды, оксидантный стресс.
Key words: Parkinsons disease, lipid peroxidation, phospholipids, glycolipids, oxydative stress.
Болезнь Паркинсона (БП) — хроническое нейродегенеративное заболевание, сопровождающееся прогрессирующей гибелью дофаминергических нейронов в головном мозге, резким снижением концентрации нейромедиатора дофамина в полосатом теле и накоплением внутриклеточных включений в нейронах (тельца Леви), главным компонентом которых является белок α-синуклеин. Одной из причин поражения нейронов при БП считают окислительный стресс [7, 13]. В результате окисления дофамина при участии моноаминооксидазы В образуется супероксидный радикал, обусловливающий развитие окислительного стресса [12, 15] с нарушением равновесия между прооксидантной и антиоксидантной системами. Известно, что при старении уменьшается продукция основных антиоксидантных ферментов, в результате чего увеличивается чувствительность к оксидантному стрессу [4], что может быть одной из причин возрастного снижения резистентности дофаминергических нигростриатных нейронов к пропаркинсоническим факторам. Таким образом, одним из перспективныx направлений в лечении БП является антиоксидантная терапия [5, 10], особенно в начальной стадии развития болезни.
Целью исследования явилось изучение процесса перекисного окисления липидов (ПОЛ), а также определение содержания фосфолипидов (ФЛ), галактозилцерамидов (ГалЦер), сульфогалактозилцерамидов (СГалЦер) и продукта их гидролитического расщепления — сфингозина в головном мозге животных с экспериментально вызванным паркинсоническим синдромом (ПС) и при введении нового синтезированного нами препарата. В структуру исследуемого вещества входят литий и аминокислота цистеин1. Препараты лития применяют при различныx нейродегенеративныx заболеванияx. Ионы лития повышают чувствительность нейронов гиппокампа и других областей мозга к действию дофамина. Литий конкурирует
1Исследуемый препарат синтезировали в ЗАО при заводе химических реактивов.
© Коллектив авторов, 2010
Zh Nevrol Psikhiatr Im SS Korsakova 2010;110:6:95
с ионами натрия, участвуя в регуляции работы кальциевых каналов в митохондриях, а также снижает активацию апоптозного каскада [11]. Цистеин оказывает выраженное антиоксидантное действие и является источником серы, инактивирующим свободные радикалы. Его рекомендуют применять при синдроме хронической усталости, рассеянном склерозе, БП и болезни Альцгеймера.
Материал и методы
Эксперименты проводили на беспородных белых старых крысах (возраст 2—2,5 года), содержащихся в условиях вивария. Модель экспериментального ПС осуществляли ежедневным внутрибрюшинным введением МФТП (1-метил-4-фенил-1,2,3,6-тетрапиридин) в дозе 25 мг/кг в течение 6 дней. Поведенческие характеристики (координация движений, тремор, ригидность мышц, олигокинезия) служили критерием развития болезни. Животные были распределены на 3 группы по 10 животных в каждой: 1-я — интактные; 2-я — животные с воспроизведенным ПС; 3-я — животные с воспроизведенным ПС, получавшие исследуемый препарат в дозе 20 мг/кг. Исследуемое вещество вводили с 6-го по 12-й дни эксперимента, через 1 ч после введения МФТП. Животных забивали на 12-й день эксперимента через 1 ч после введения препарата.
Об активности ПОЛ судили по количеству образования гидроперекисей (ГП) и малонового диальдегида (МДА). ГП определяли по цветной реакции с тиоционатом аммония при максимуме поглощения 480 нм [9]; МДА
— по реакции с тиобарбитуровой кислотой [2]; количество белка — по Лоури [14].
Экстракцию липидов осуществляли по методу Фолча. Фракционирование индивидуальных фосфолипидов проводили методом одномерной хроматографии в тонком слое силикагеля («Мерк», Германия) в системе растворителей хлороформ:метанол:аммиак в соотношении (65:35:5). Минерализацию липидного фосфора осуществляли в среде серной и азотной кислот с последующим расчетом ко-
e-mail: lhovs@yahoo.com
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 6, 2010 |
95 |
КРАТКИЕ СООБЩЕНИЯ
личества неорганического фосфора в мкг влажной ткани [6].
Выделение осадка ГалЦер и СГалЦер основано на их способности образовывать плотный белый слой на границе хлороформенного и водного слоев при обработке хлороформенно-метанолового экстракта липидов трихлоруксусной кислотой и водой. Фракционирование суммарных ГалЦер и СГалЦер проводили методом тонкослойной хроматографии (пластины «Мерк», Германия) в системе растворителей хлороформ-метанол-концентрированный аммиак (80:20:0,4). Количество ГалЦер определяли по углеводному компоненту с резорцином, а СГалЦер — по сульфатной группе в реакции с азуром [8].
Для выделения сфингозиновых оснований смесь ГалЦер и СГалЦер подвергали кислотному метанолизу смесью Н2SO4-метанол (1:20) при температуре 78—80°C в течение 6 ч, с последующей экстракцией сфингозиновых оснований диэтиловым эфиром. Количество сфингозина определяли цветной реакцией с метилоранжем при длине волны 415 нм [8].
Статистическую значимость различий оценивали методом Стьюдента.
Результаты и обсуждение
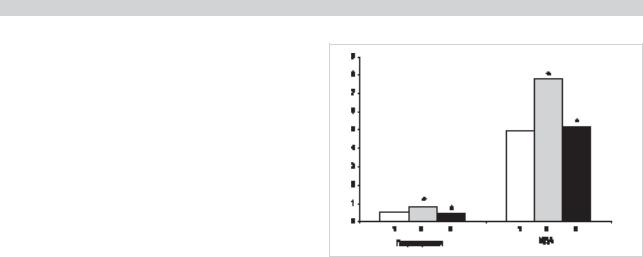
В головном мозге интактных животныx обнаружен определенный стационарный уровень интенсивности свободнорадикальных реакций; развитие ПС сопровождалось активированием процесса ПОЛ, что выражалось в увеличении содержания ГП и МДА (см. рисунок). Известно, что при БП в черной субстанции снижено число глиальныx клеток, содержащиx естественный антиоксидант — глутатионпероксидазу, а также отмечен низкий уровень глутатиона [3, 12]. Низкий уровень антиоксидантов сопровождается высоким уровнем активных форм кислорода, обладающих свойствами ингибировать сульфгидрильные группы ферментов и повреждать NН2-группы мембранных белков. В этих условиях целесообразно использование препаратов, обладающих антиоксидантными свойствами.
Было проведено изучение влияния синтезированного антиоксидантного препарата на ПОЛ в головном мозге животных с экспериментальным ПС. Введение исследуемого вещества животным с экспериментальным ПС приводит к нормализации количества перекисей, приближая их к показателям контрольных животных, что является доказательством способности препарата оказывать антиоксидантное действие (см. рисунок).
Механизмнейропротекторногодействияиспользованного нами вещества связан с тем, что в его структуру входит цистеин, который принимает участие в синтезе глутатиона. Глутатион — трипептид, образованный аминокислотами цистеином, глутаминовой кислотой и глицином. Его основной антиоксидантный эффект реализуется посредством участия в работе антиоксидантных ферментов глутатионпероксидазы и глутатионредуктазы. Глутатион, как и другие SН-содержащие белки, является акцептором активных форм кислорода и тем самым ингибирует свободнорадикальное окисление. Снижение содержания глутатиона приводит к повышению чувствительности митохондрий к окислительному стрессу.
Активные формы кислорода, вызывая ПОЛ, могут быть токсичными как для нейронов, так и олигодендро-
Содержание продуктов перекисного окисления липидов (в нмоль/мг белка) в головном мозге крыс в норме, при экспериментальном паркинсоническом синдроме и при лечении антиоксидантным препаратом.
По оси абсцисс: 1 — контроль; 2 — паркинсонизм; 3 — лечение.
* — достоверные различия между 2-й и 3-й группами на уровне p<0,001.
цитов, образующих миелин. Высокое содержание в головном мозге липидов и уникальность их структуры определяет характер развития в них ПОЛ. Известно, что изменение состава липидов в мембране клеток, наряду с метаболическими изменениями, чаще всего бывает вызвано процессами свободнорадикального окисления. Изучение спектра ФЛ в мозговой ткани при экспериментальном ПС (табл. 1) позволило обнаружить увеличение содержания лизофосфатидилхолина (ЛФM) при уменьшении содержания фосфатидилхолина (ФХ), фосфатидилсерина (ФС) и фосфатидилэтаноламина (ФЭ). Жирнокислотные остатки указанных фосфолипидов легко подвергаются окислению свободными радикалами при активировании ПОЛ.
Известно, что для БП характерно понижение митохондриального комплекса 1 в дофаминергических нигростриатных нейронах. При посмертном гистологическом исследовании мозга больных было обнаружено снижение активности фермента NАДФН-убихинон-оксидоредук- тазы [7]. Уменьшение активности фермента вызывает нарушение работы нейрональных митохондрий и снижение продукции АТФ и, как следствие, понижение активности АТФ-зависимых ферментов, в частности Nа-, К-АТФаз. В результе происходит деполяризация мембраны клеток, усиливаются интенсивность ионных потоков через мембрану и массированное поступление Са2+ в нейрон, запускающее весь каскад внутриклеточных нейродегенеративных реакций, нарушается также работа Са-насоса, откачивающего Са2+ из клетки. Образование активных форм кислорода и увеличение ионов Са2+ в митохондриях также приводит к активации фосфолипаз, отщепляющих жирные кислоты во втором положении молекулы ФЛ. Наблюдаемое уменьшение содержания ФХ, ФС, ФЭ при параллельном увеличении содержания ЛФХ, вероятно, связано с повышением активности фосфолипаз при развитии ПС.
Исследование нейтральных гликолипидов позволило обнаружить в головном мозге интактных животных 2 фракции ГалЦер и 2 фракции СГалЦер, различающиеся между собой содержанием жирных кислот (табл. 2). ГалЦер преимущественно локализованы в миелине, тогда как
96 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 6, 2010 |

БИОХИМИЯ ЭКСПЕРИМЕНТАЛЬНОГО ПАРКИНСОНИЗМА
Таблица 1. Содержание фосфолипидов (в мкг/г) в головном мозге крыс в норме, при экспериментальном паркинсоническом синдроме и лечении
Показатель |
Контроль |
ПС |
Лечение |
ЛФХ |
81,0±6,2 |
123,4±8,51* |
95,3±7,82*** |
ФХ |
616,54±20,3 |
398,8±15,41* |
506,7±17,52* |
ФС |
215,5±14,5 |
161,7±10,51** |
193,7±9,22*** |
ФЭ |
461,5±21,3 |
314,1±17,81* |
392,0±14,42** |
Сфингомиелин |
137,42±12,1 |
81,36±7,61** |
112,6±8,22** |
Примечание. Здесь и в табл. 2: 1 — достоверность различий по сравнению с контролем; 2 — достоверность различий после лечения; * — р<0,001; ** — р<0,01; *** — р<0,05.
Таблица 2. Содержание нейтральных гликолипидов и сфингозина (в мг/г) в головном мозге крыс в норме, при экспериментальном паркинсоническом синдроме и при лечении
Показатель |
Контроль |
ПС |
Лечение |
Нейтральные гликозиды |
1,26±0,09 |
0,7±0,131** |
0,98±0,07 |
СгалЦер-1 |
|||
СгалЦер-2 |
1,4±0,08 |
0,88±0,051* |
1,17±0,082** |
ГалЦер-1 |
6,51±0,4 |
3,37±0,241* |
5,66±0,232* |
ГалЦер-2 |
7,26±0,38 |
3,69±0,251* |
6,0±0,32* |
суммарное содержание |
16,43 |
8,641* |
13,812* |
Сфингозин |
3,23±0,3 |
5,2±0,241* |
3,7±0,172* |
СГалЦер определяются в немиелиновой части белого ве- |
гликолипидов и сфингомиелина, что, вероятно, связано с |
щества. ГалЦер является основным липидом миелина, с |
повышением активности ферментов, приводящих к нако- |
ним связаны тяжелые нейрональные дисфункции при не- |
плению сфингозина. Принимая во внимание, что указан- |
которых нейродегенеративных заболеваниях (болезнь |
ные ферменты являются мембранозависимыми и зависят |
Краббе, Гоше, Фарбера и др.). Результаты наших исследо- |
от уровня окислительных процессов в клетке, нами было |
ваний показали, что при ПС в головном мозге наблюдает- |
проведено исследование с введением антиоксидантного |
ся уменьшение содержания как суммарного, так и фрак- |
препарата. |
ционного состава ГалЦер и СгалЦер (см. табл. 2). |
Изучение количественного состава фосфолипидов, |
Особый интерес вызывает уменьшение содержания |
нейтральных гликолипидов и сфингозина при введении |
сфингомиелина в головном мозге животных при экспери- |
препарата позволило обнаружить частичную нормализа- |
ментальном ПС, так как обнаружено одновременное уве- |
цию количества указанных гликолипидов (см. табл. 1, 2). |
личение содержания сфингозина (см. табл. 1, 2). ГалЦер |
Протекторное действие препарата связано с сохранением |
может быть источником церамида и сфингозина наряду |
качественного и количественного содержания липидов |
со сфингомиелином. Сфингозин участвует в регуляции |
клеточных мембран, обусловливающего нормальное тече- |
пролиферации и гибели клеток в связи со способностью |
ние таких метаболических реакций, как проницаемость, |
ингибировать активность протеинкиназы С [1]. Церами- |
ионный транспорт, активность липидсвязанных фермен- |
ды и сфингозин являются медиаторами апоптоза и обра- |
тов и др. Анализ полученных данных позволил сделать |
зуются внутриклеточно как продукты катаболизма сфин- |
вывод о том, что использованный нами препарат обладает |
гомиелина (сфингомиелин/сфингомиелиназный меха- |
антиоксидантным действием и уменьшает образование |
низм) и/или расщеплением галактозил-глюкозилцерами- |
перекисей липидов. Нам представляется, что синтезиро- |
да (галакозилцерамид/глюкозидазный механизм) лизосо- |
ванный препарат может быть эффективен при различных |
мальными и цитоплазматическими гидролазами. Полу- |
патологических состояниях, характеризующихся наруше- |
ченные результаты позволяют заключить, что при ПС |
нием окислительных процессов и в связи с этим представ- |
имеет место ферментативное расщепление нейтральных |
ляет определенный научно-практический интерес. |
ЛИТЕРАТУРА
1.Алесенко А.В. Функциональная роль сфингозина в индукции проли- 9. Современные методы в биохимии. Под ред. В.Н. Ореховича. М:
ферации и гибели клеток. Биохимия 1998; 63:1: 75—82. |
Mедицина 1977; 391. |
2.Владимиров Ю.А., Арчаков А.И. Перекисное окисление в биологиче10. Шток Б.Н., Федорова Н.В. Современные принципы лечения паркин-
ских мембранах. М: Наука 1972; 346. |
сонизма. Рус мед журн 1998; 6: 13: 837—844. |
3.Гуляева Н.Б., Ерин А.Х. Роль свободнорадикальных процессов в раз11. Chribi О., Herman М., Spaulding N. Lithium inhibits aluminum-inducen
витии нейродегенеративных заболеваний (болезнь Паркинсона и Альцгеймера). Нейрохимия 1995; 2: 3—15.
4.Гусев Б.А., Панченко Л.Ф. Нейрохимия. Современные концепции свободнорадикальной теории старения. M 1997; 14: 1: 14—27.
5.Катунина Е.А. Возможности применения антиоксидантной терапии у больных болезнью Паркинсона. Эксперим и клин фармакол 2005; 68: 5: 18—20.
6.Кейтс М. Техника липидологии. М 1975; 298.
7.Крыжановский Г.Н., Карабань И.Н., Магаева С.М. и др. Болезнь Паркинсона. Татарстан 2002; 336.
8.Методы биохимических исследований. Под ред. М.И. Прохорова. Ленинград: ЛГУ 1982; 271.
apoptosis in rabbit hippocampus by preventing citochrome c translocation, Bcl-2 decreas. Bax elevation and caspase-3 activation. J Neurochem 2002;
82:1: 137—145.
12.Damier P., Hirsch E.C., Zhang P. Glutathione peroxidase, glial cells and Parkinson’s disease. Neuroscience 1993; 52: 1—6.
13.Kidd P.M. Parkinson’disease as multifactorial oxidative neurodegeneration. Altern Med Rev 2000; 5: 6: 502—529.
14.Lowry N.J., Rosenbogh A.J., Farr A.L. Protein measurement with folin phenol reagent. J Biol Chem 1951; 193: 265—275.
15.Olanow C.W. Oxidation reaction in Parkinson’s disease. Neurology 1990;
40:32—37.
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 6, 2010 |
97 |
