
Журнал неврологии и психиатрии / 2010 / NEV_2010_06_077
.pdf
ЭКСПЕРИМЕНТАЛЬНО-ТЕОРЕТИЧЕСКИЕ ВОПРОСЫ
Биоэлектрическая активность головного мозга при различных аффективных расстройствах у больных с церебральным инсультом
К.м.н., в.н.с., доц. Е.А. ПЕТРОВА, асп. Н.А. ГЕОРГИЕВСКАЯ1, к.м.н., асс. И.В. КИЧУК, асп. Н.В. ШАКЛУНОВА, к.м.н., с.н.с. М.А. САВИНА, проф., чл.-корр. В.И. СКВОРЦОВА
Bioelectrical brain activity in different affective disorders in patients with cerebral stroke
E.A. PETROVA, N.A. GEORGIEVSKAYA, I.V. KICHUK, N.V. SHAKLUNOVA, M.A. SAVINA, V.I. SKVORTSOVA
Кафедра фундаментальной, клинической неврологии и нейрохирургии Российского государственного медицинского университета;
НИИ цереброваскулярной патологии и инсульта Научного центра психического здоровья РАМН, Москва
Наблюдали 149 пациентов с ишемическим инсультом, у которых в течение года после развития инсульта наблюдались различные аффективные расстройства — депрессии, тревожные расстройства, тревожно-депрессивные расстройства. При использовании компьютерных методов обработки ЭЭГ были установлены особенности биоэлектрической активности головного мозга у больных с различными видами постинсультных аффективных расстройств в остром, раннем и позднем восстановительном периодах инсульта.
Ключевые слова: постинсультные аффективные расстройства, постинсультная депрессия, постинсультное тревожное
расстройство, ЭЭГ.
One hundred and forty-nine patients with ischemic stroke who had different affective disorders developed one year after stroke (depression, anxiety, depression-anxiety disorders) were included in the study. Based on the computer data analysis of EEG, we singled out the characteristics of bioelectrical brain activity in patients with different types of poststroke affective disorders in acute, early and late restorative periods.
Key words: poststroke affective disorders, poststroke depression, poststroke anxiety, EEG.
На процесс реабилитации больных с инсультом большое влияние могут оказывать психические расстройства, среди которых наиболее частыми в постинсультном периоде являются тревожно-депрессивные состояния. Их развитие увеличивает длительность госпитализации, замедляет восстановление утраченных неврологических функций, ухудшает качество жизни и увеличивает смертность больных в течение последующих лет. Однако своевременной диагностике постинсультных аффективных расстройств не уделяется должного внимания. Только в 10% случаев эти состояния диагностируются и назначается соответствующая коррекция [3, 22, 26, 31, 32].
В проведенных ранее исследованиях [1, 5, 21, 32—34] было установлено существование нейроанатомических и патофизиологических предпосылок развития постинсультных аффективных расстройств. К ним относят размер, расположение очага поражения и нейрохимические изменения в постинсультном периоде.
Для определения функциональной активности мозга в норме и при различных патологических состояниях используется метод электроэнцефалографии. Первые описания изменений ЭЭГ у больных с инсультом появились в 30—40-х гг. С этого времени данный метод исследования широко применяется в клинической практике в качестве
одного из прогностических критериев течения заболевания и регресса очаговых неврологических нарушений, а также для подбора адекватной терапии и оценки ее эффективности [3, 7, 11]. К настоящему времени изменение биоэлектрической активности головного мозга в остром периоде ишемического инсульта изучено достаточно полно и информативность метода доказана множеством экспериментальных и клинических исследований [16].
При поражении различных участков головного мозга выявлены определенные типы ЭЭГ [27]. При локализации очага инфаркта в коре и белом веществе головного мозга появляются выраженные изменения в фоновой α- и β-активности, формируется фокус медленной патологической активности, выраженность которого увеличивается при приближении участка поражения к поверхности мозга. -Очаг, согласно данным МРТ, всегда регистрируется при объеме поражения больше 10 см3 [16]. В контралатеральном полушарии биоэлектрическая активность мозга может оказаться близкой к норме.
При поражении подкорковых образований в ответную реакцию более заметно вовлекается и неповрежденное полушарие, что проявляется двусторонней диффузной дезорганизацией α-ритма, появлением нерегулярных θ- -волн и острых волн преимущественно на стороне по-
© Коллектив авторов, 2010 |
1e-mail: natgeorg19041979@mail.ru |
Zh Nevrol Psikhiatr Im SS Korsakova 2010;110:6:77 |
|
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 6, 2010 |
77 |

ЭКСПЕРИМЕНТАЛЬНО-ТЕОРЕТИЧЕСКИЕ ВОПРОСЫ
ражения. Фокус патологической активности может иногда отсутствовать. При мезодиэнцефальной локализации процесса генерализованные сдвиги на ЭЭГ выражены более грубо, чем при корковых или подкорковых поражениях. Отмечается грубая дезорганизация или отсутствие α-активности, нарастание амплитуды θ- -волн, фокус патологической активности выражен менее отчетливо или отсутствует. При расположении очага повреждения в среднем или продолговатом мозге нарушения почти всегда негрубые и двусторонне симметричные [11]. Исследование паттерна ЭЭГ позволило установить закономерности взаимосвязи функциональной активности мозга, его метаболизма и показателей гемодинамики [14, 18].
Значительное количество исследований было посвящено определению прогностически значимых ЭЭГкритериев восстановления после ишемического инсульта. В случае ишемического инсульта с благоприятным прогнозом на ЭЭГ пораженного полушария преобладали быстрая активность (α и β2); увеличивалась суммарная мощность спектра за счет α- и β-диапазонов частот, происходило восстановление нормальных зональных различий по α-ритму, а также отсутствовала или была минимально выражена медленноволновая активность в проекции зоны поражения [16]. У больных с неблагоприятным прогнозом чаще наблюдаются «монотонные» спектры ЭЭГ без выраженной межполушарной асимметрии, со снижением мощности спектров в сторону преобладания медленных волн [16].
Если после инсульта развиваются когнитивные нарушения, то основной характеристикой ЭЭГ, коррелирующей со снижением интеллекта, являются медленные волны частотой 7 и 1—3 Гц [19]. В литературе [6, 12, 15, 27, 35] имеется множество данных и о связи изменений биоэлектрической активности головного мозга с различными видами аффективных расстройств. Так, например, при реактивной и эндогенной депрессии наблюдалось увеличение мощности α- и β-активности в левом полушарии головного мозга, снижение мощности θ-ритма и нарушение межполушарного баланса [2, 13, 20, 23, 28]. При тревожном типе депрессии происходило увеличение мощности θ- и β-активности [4, 8, 30]. Депрессивные расстройства при болезни Паркинсона коррелировали с увеличением индекса и мощности α-ритма [10]. При генерализованных тревожных расстройствах, панических атаках и тревожном типе депрессии выявляли увеличение мощности θ- и β-активности на фоне снижения α-ритма, значимое нарушение зонального градиента α-ритма [12, 13].
Приведенные данные позволяют использовать метод ЭЭГ для изучения биоэлектрической активности головного мозга у больных с разными проявлениями постинсультных аффективных расстройств — депрессий, тревоги и депрессивно-тревожных расстройств.
Целью данной работы явилось изучение особенностей биоэлектрической активности головного мозга у больных с постинсультными тревожными и депрессивными расстройствами.
Материал и методы
Обследовали 149 пациентов, 73 мужчины и 76 женщин с впервые возникшим церебральным инсультом различной локализации. Их возраст был от 58 до 82 лет (средний 66,9±11,3 года).
Критериями исключения явились онкологические заболевания, злоупотребление алкоголем, соматическая патология в стадии декомпенсации, выраженные когнитивные нарушения.
Клиническая оценка тяжести состояния и выраженности неврологического дефицита осуществлялась с помощью шкалы NIHSS на 1—3, 7, 14, 28-е сутки и через 3, 6 и 12 мес от начала заболевания.
Диагностику депрессии, тревожных расстройств проводили в соответствии с критериями DSM-IV. Обследование и оценку психического состояния больных проводили с использованием клинико-катамнестического метода. Для стандартизованной оценки депрессии и тревоги использовали шкалу Гамильтона (HAM-D, HAM-A), краткую шкалу оценки психического статуса (MMSE) на 1—3, 14, 28-е сутки и через 3, 6, 12 мес от начала заболевания.
Уточнение локализации, размеров и характера поражения головного мозга осуществляли с помощью рентгеновской и магнитно-резонансной томографии (КТ и МРТ) головного мозга.
Регистрация ЭЭГ проводилась на 1—3, 14, 28-е сутки, а также через 3, 6, 12 мес от начала заболевания с помощью 19-канального электроэнцефалографа EEG-24 (МBN, Москва) по международной схеме отведений «1020» с ипсилатеральным ушным референтным электродом. Частотная полоса пропускания биопотенциалов головного мозга была установлена в диапазоне 0,5—70 Гц, усиление — 70 мкВ. Компьютерный анализ ЭЭГ осуществляли при помощи программ Нейрокартограф 4.0 фирмы MBN (визуальный и спектральный анализ ЭЭГ). При использовании спектрального анализа рассчитывали индексы мощности основных ритмов в пораженном и непораженном полушариях, а также коэффициент переднезаднего распределения α-ритма, коэффициент межполушарной асимметрии (%).
Статистическую обработку данных осуществляли с помощью программы Statistica 6.0. При сравнении группы контроля и различных видов постинсультных аффективных расстройств использовали параметрический критерий Стьюдента для независимых выборок, а исследование динамики их изменения проводили с помощью параметрического критерия Стьюдента для зависимых выборок. Взаимосвязь параметров ЭЭГ со степенью выраженности тревожных и депрессивных расстройств изучали при помощи ранговых корреляций по Пирсону.
Результаты и обсуждение
Аффективные расстройства были выявлены у 90 (60,4%) больных с церебральным инсультом. Среди них у 36 (40%) больных определялась постинсультная депрессия, генерализованные тревожные расстройства отмечались у 30 (33%) пациентов, сочетание тревожных и депрессивных расстройств было выявлено у 24 (27%) больных.
У 59 (39,6%) пациентов психических нарушений выявлено не было и они составили группу сравнения.
Депрессии в основном (48% случаев) возникали в остром и раннем восстановительном (41%) периодах, значительно реже — в позднем восстановительном периоде (11%) больных. Генерализованные тревожные расстройства чаще всего отмечались в остром периоде инсульта (70% пациентов), в 2,5 раза реже — в раннем восстанови-
78 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 6, 2010 |

НЕЙРОФИЗИОЛОГИЯ ИНСУЛЬТА
тельном периоде (28%) и лишь у 2% больных наблюдались в позднем восстановительном периоде.
При оценке структуры аффективных нарушений в зависимости от исходной тяжести состояния больных было получено достоверное преобладание частоты депрессии у тяжелых больных по сравнению с легкими (р<0,05). Тревожные расстройства наблюдались с одинаковой частотой у больных с разной степенью тяжести инсульта.
ЭЭГ у больных с постинсультными депрессивными расстройствами
При анализе спектральных показателей у больных с постинсультными депрессивными расстройствами в диапазоне медленноволновой активности были выявлены
следующие особенности: снижение мощности θ-ритма в пораженном и непораженном полушариях (р<0,05) по сравнению с группой без аффективных нарушений на протяжении всего периода наблюдения. При этом в данной подгруппе больных наблюдалось значимое снижение индексов мощности медленных ритмов к 3-му месяцу по сравнению с показателями в острейшем периоде заболевания (р<0,05) (рис. 1, А). При проведении корреляционного анализа спектральных данных с показателями шкалы Гамильтона (HAM-D) была получена прямая взаимосвязь индекса мощности -активности с тяжестью депрессии на 21—28-е сутки: чем выше индекс мощности -актив- ности, тем больше тяжесть депрессии (R=0,67; p=0,003) (рис. 2, А).
Рис. 1. Динамика изменений основных частотных диапазонов ЭЭГ в остром, раннем и позднем восстановительных периодах у больных с постинсультной депрессией (I) и в группе сравнения (II).
Здесь и на рис. 4:
А. Спектральные характеристики медленноволновой активности в динамике.
a — индекс мощности в пораженном полушарии; b — индекс мощности в непораженном полушарии; c — индекс мощности θ в пораженном полушарии; d — индекс мощности θ в непораженном полушарии.
Б. Спектральные характеристики α-ритма в динамике.
a — индекс мощности α1 в пораженном полушарии; b — индекс мощности α1 в непораженном полушарии; c — индекс мощности α2 в пораженном полушарии; d — индекс мощности α2 в непораженном полушарии.
В. Спектральные характеристики β-активности в динамике.
a — индекс мощности β1 в пораженном полушарии; b — индекс мощности β1 в непораженном полушарии; c — индекс мощности β2 в пораженном полушарии; d — индекс мощности β2 в непораженном полушарии.
По оси абсцисс временные периоды от начала церебрального инсульта: 1 — 1—3-е сутки, 2 — 14-е сутки, 3 — 21—28-е сутки, 4 — 3-й месяц, 5 — 6-й месяц, 6 — 12-й месяц.
* — значимые отличия относительно 1—3-х суток; ** — значимые отличия относительно группы сравнения.
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 6, 2010 |
79 |

ЭКСПЕРИМЕНТАЛЬНО-ТЕОРЕТИЧЕСКИЕ ВОПРОСЫ
А
Б
В
Рис. 2. Корреляции основных частотных диапазонов ЭЭГ со степенью тяжести депрессии по шкале Гамильтона.
А.Корреляции индекса со степенью тяжести депрессии по шкале Гамильтона на 21—28-е сутки (R=0,67; p=0,003).
По оси абсцисс — мощность -активности в пораженном полушарии на 21—28-е сутки (мкВ^2).
По оси ординат — показатели выраженности тяжести депрессии по шкале Гамильтона (балл).
Б. Корреляции индекса α со степенью тяжести депрессии по шкале Гамильтона на 6-м месяце от начала инсульта (R=–0,87; p=0,004).
По оси абсцисс — мощность α-активности в пораженном полушарии на 6-м месяце от начала инсульта (мкВ^2).
По оси ординат — показатели выраженности тяжести депрессии по шкале Гамильтона (балл).
В. Корреляции индекса β со степенью тяжести депрессии по шкале Гамильтона на 12-м месяце от начала инсульта (R=0,7; p=0,02).
По оси абсцисс — мощность β-активности в пораженном полушарии на 12-м месяце от начала инсульта (мкВ^2).
По оси ординат — показатели выраженности тяжести депрессии по шкале Гамильтона (балл).
Данные спектрального анализа показателей α-ритма у больных с постинсультными депрессивными расстройствами выявили следующие особенности: снижение мощности α-ритма в пораженном и непораженном полушариях (р<0,05) в отличие от группы сравнения на протяжении
всего периода наблюдения (рис. 1, Б). При этом в данной подгруппе больных наблюдалось значимое снижение индекса мощности α-ритма к 3-му месяцу по сравнению с показателями в острейшем периоде заболевания (р<0,05). Кроме того, отмечалось снижение коэффициента заднецентрального распределения α-ритма у больных с постинсультными депрессиями в первые 14 сут от начала ишемического инсульта. При корреляционном анализе спектральных данных с показателем шкалы Гамильтона (HAM-D) была получена обратная взаимосвязь индекса мощности α-ритма с тяжестью депрессии на 21—28-е сутки и через 6 мес от начала заболевания: чем ниже мощность α-ритма, тем выше тяжесть депрессии (R=–0,87; p=0,004) (рис. 2, Б).
У больных с постинсультными депрессиями значительно чаще встречались низкоамплитудные «размытые» или «плоские» типы ЭЭГ, значимо преобладал дву- и полимодальный α-ритм, а в группе сравнения — «одномодальный» спектр α-ритма (рис. 3, А).
При оценкe изменений в диапазоне быстроволновых ритмов β1 и β2 у больных с депрессивными расстройствами в пораженном и непораженном полушарии выявлено значимое повышение (р<0,0007) мощности β-ритмов на 3-м месяце после инсульта в отличие от группы сравнения (рис. 1, В). Представленные изменения соответствуют некоторым данным литературы о том, что при различных видах депрессивных расстройств (эндогенная форма депрессии, депрессивные расстройства при болезни Пар- кинсона)происходитувеличениемощностиβ-активности, снижение мощности θ-ритма, нарушение зонального распределения α-ритма [25, 26, 35—37]. При проведении корреляционного анализа спектральных данных с показателем шкалы Гамильтона (HAM-D) была получена прямая взаимосвязь индекса мощности β-активности ритма с тяжестью депрессии на 12-м месяце от начала заболевания: чем выше мощность β-ритма, тем выше тяжесть депрессии (R=0,69; p=0,04) (рис. 2, В). Таким образом, в подгруппе больных с постинсультными депрессиями отмечалaсь более выраженная дезорганизация основного коркового ритма.
ЭЭГ у больных с постинсультными генерализованными тревожными расстройствами
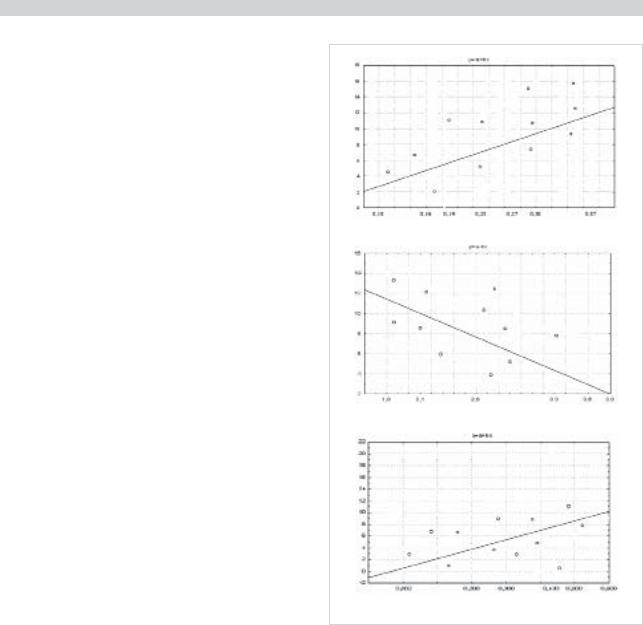
При анализе спектральных показателей у больных с постинсультными генерализованными тревожными расстройствами (ГТР) были выявлены следующие особенности: повышение мощности медленных ритмов в пораженном и непораженном полушариях по сравнению с больными без аффективных расстройств через 6 мес от начала инсульта (р<0,05). При этом в данной подгруппе больных наблюдалось снижение индексов мощности медленных ритмов к 3-му месяцу по сравнению с показателями в острейшем периоде заболевания (р<0,05) (рис. 4, А). У больных с постинсультными генерализованными тревожными расстройствами проводили корреляционный анализ спектральных данных с показателем шкалы Гамильтона (HAM-A). Получена прямая взаимосвязь индекса мощности θ-активности с тяжестью тревоги на 6-м месяце: чем выше индекс мощности θ-активности, тем выше тяжесть тревоги (R=0,67; p=0,003) (рис. 5, А).
Данные спектрального анализа показателей α-ритма у больных с ГТР выявили следующие особенности: снижение мощности α-ритма в пораженном и непораженном
80 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 6, 2010 |

НЕЙРОФИЗИОЛОГИЯ ИНСУЛЬТА
А
Б
Рис. 3. Примеры спектров ЭЭГ у больных с постинсультными аффективными расстройствами (окно программы «Нейрокартограф»).
А. Плоский спектр ЭЭГ (амплитуда α-ритма не превышает 20 мкВ).
В Б. Группа сравнения.
В. Средний спектр ЭЭГ (амплитуда α-ритма 30—70 мкВ).
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 6, 2010 |
81 |

ЭКСПЕРИМЕНТАЛЬНО-ТЕОРЕТИЧЕСКИЕ ВОПРОСЫ |
|
полушариях в отличие от группы сравнения (р<0,05) на |
расстройств на 3-м (R=–0,87; p=0,004) и 6-м (R=–0,68; |
протяжении всего времени наблюдения. При этом в дан- |
p=0,04) месяцах от начала заболевания (рис. 5, Б). |
ной подгруппе больных наблюдалось значимое снижение |
В подгруппе с постинсультными тревожными рас- |
индексов мощности быстрых ритмов к 3-му и 6-му меся- |
стройствами значительно чаще встречался среднеампли- |
цам по сравнению с показателями в острейшем периоде |
тудный спектр ЭЭГ и значимо преобладал мономодаль- |
заболевания (р<0,05) (рис. 4, Б). Кроме того, наблюдалось |
ный широкодиапазонный спектр α-ритма (рис. 3, В). |
повышение коэффициента переднезаднего распределе- |
При оценке изменений в диапазоне быстроволновых |
ния α-ритма в первые 2 нед от начала заболевания (р<0,05), |
ритмов β1 и β2 было выявлено значимое повышение |
в дальнейшем отмечалось его нарастание по сравнению с |
(р<0,0004) в пораженном и непораженном полушариях |
группой больных без аффективных расстройств. При кор- |
мощности β-ритмов на 3-м месяце от начала инсульта по |
реляционном анализе спектральных данных с показателя- |
сравнению с группой больных без аффективных наруше- |
ми шкалы Гамильтона (HAM-A) были получены обратные |
ний (рис. 4, В). При корреляционном анализе спектраль- |
взаимосвязи индекса мощности α-активности в поражен- |
ных данных с показателем шкалы Гамильтона (HAM-А) |
ном и непораженном полушариях с тяжестью тревожных |
была получена прямая взаимосвязь индекса мощности |
|
|
|
|
Рис. 4. Динамика изменений основных частотных диапазонов ЭЭГ в остром, раннем и позднем восстановительных периодах у больных с постинсультными тревожными расстройствами (I) и в группе сравнения (II).
82 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 6, 2010 |
НЕЙРОФИЗИОЛОГИЯ ИНСУЛЬТА
β-активности ритма с тяжестью тревоги на 3-м месяце от начала заболевания: чем выше мощность β-ритма, тем выше тяжесть тревожных расстройств (R=0,7; p=0,02) (рис. 5, В).
Полученные результаты свидетельствуют, что у больных с аффективными расстройствами происходит нарушение корково-подкорковых взаимодействий, в которое вовлекаются лимбико-ретикулярные структуры обоих полушарий. Они согласуются с данными других исследований, показавшими, что при тревожных расстройствах и панических атаках происходит увеличение мощности θ- и β-активности, снижение α-активности с нарушением его зонального градиента [26, 29].
Различия в показателях ЭЭГ исследуемых групп в основном наблюдались в α-диапазоне: для постинсультных депрессий характерен плоский тип ЭЭГ с нарушением основного ритма, а также дву- и полимодальный широкодиапазонный спектр α-ритма. У больных с постинсультными генерализованными тревожными расстройствами преобладал средний тип ЭЭГ и мономодальный широкодиапазонный спектр α-ритма. Основными общими особенностями для постинсультных депрессивных и тревожных расстройств являются значимое снижение мощности медленных θ- -ритмов и α-ритмов и значительное повышение мощности β-ритмов к 3-му месяцу по сравнению с показателями в острейший период заболевания и группой сравнения, что может свидетельствовать о выраженных процессах ирритации глубинных структур головного мозга у больных с аффективными расстройствами, связанных со структурными и нейрохимическими нарушениями в центральной нервной системе. Установлена тесная взаимосвязь параметров ЭЭГ со степенью выраженности тревожных и депрессивных расстройств в различные сроки после перенесенного церебрального инсульта (см. таблицу).
В литературе имеются указания на то, что при аффективных расстройствах происходит нарушение синаптической передачи, в первую очередь это относится к тормозным ГАМКергическим системам. Как следствие, дезорганизуется нормальный режим взаимодействия нейронов в нервных сетях, осуществляющих обработку сенсорной (экстра- и интероцептивной) и межцентральной информации, а также интеграцию моторной и регуляторной активности [24].
При депрессивных расстройствах подтверждают наличие дисфункции диэнцефальных и подкорковых структур (по типу дефицита торможения), а при постинсультных тревожных расстройствах наблюдаются нарушения со стороны корково-лимбической системы и доминирование системы возбуждения над системой торможения, что сопровождается нарушением зонального распределения α-ритма, повышением или снижением его мощности [17]. В данных структурах локализованы основные серотониновые 5-НТ1-рецепторы, которые вовлечены в реализацию антидепрессивного и противотревожного эффектов селективных ингибиторов обратного захвата серотонина [9, 30]. При этом в зависимости от локализации и степени генерализации функциональных нарушений возникают различные расстройства психической деятельности с соответствующими неврологическими нарушениями [17, 37].
Таким образом, установлена тесная связь параметров ЭЭГ со степенью выраженности тревожных и депрессив-
А
Б
В
Рис. 5. Корреляции основных частотных диапазонов ЭЭГ со степенью тяжести тревоги по шкале Гамильтона.
А. Корреляции мощности θ-активности со степенью тяжести тревоги по шкале Гамильтона на 6-м месяце от начала инсульта (R=0,67; p=0,003).
По оси абсцисс — мощность θ-активности в пораженном полушарии на 6-м месяце от начала инсульта (мкВ^2).
По оси ординат — показатели выраженности тревоги по шкале Гамильтона (балл).
Б. Корреляции мощности α-ритма со степенью тяжести тревоги по шкале Гамильтона на 3-м месяце от начала инсульта (R=–0,87; p=0,004).
По оси абсцисс — мощность α-активности в пораженном полушарии на 3-м месяце от начала инсульта (мкВ^2).
По оси ординат — показатели выраженности тревоги по шкале Гамильтона (балл).
В. Корреляции мощности β-активности со степенью тяжести тревоги по шкале Гамильтона на 3-м месяце от начала инсульта (R=0,7; p=0,02).
По оси абсцисс — мощность β-активности в пораженном полушарии на 3-м месяце от начала инсульта (мкВ^2).
По оси ординат — показатели выраженности тревоги по шкале Гамильтона (балл).
ных расстройств в различные сроки после перенесенного церебрального инсульта. Длительно сохраняющиеся изменения биоэлектрической активности в этих случаях
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 6, 2010 |
83 |

ЭКСПЕРИМЕНТАЛЬНО-ТЕОРЕТИЧЕСКИЕ ВОПРОСЫ
Отличительные и общие черты ЭЭГ у больных с постинсультными депрессивными и тревожными расстройствами
Постинсультные депрессии |
Постинсультные тревожные расстройства |
Отличительные черты |
|
«Плоский» тип ЭЭГ (амплитуда α-ритма до 20 мкВ), нарушение |
«Средний» тип ЭЭГ (амплитуда α-ритма 30—70 мкВ), сгла- |
зонального градиента, зональные различия значительно осла- |
женность зональных различий |
блены или не определяются |
|
Двуили полимодальный широкодиапазонный спектр α-ритма |
Мономодальный широкодиапазонный спектр α-ритма |
Прямая связь индекса мощности -активности с тяжестью де- |
Прямая связь индекса мощности θ-активности с тяжестью |
прессии на 21—28-е сутки |
тревоги на 6-й месяц |
Обратная связь индекса мощности α-активности с тяжестью де- |
Обратные связи индекса мощности α-активности с тяжестью |
прессии на 21—28-е сутки и через 6 мес от начала заболевания |
тревожных расстройств на 3-м и 6-м месяце от начала заболе- |
|
вания |
Прямая связь индекса мощности β-активности с тяжестью де- |
Прямая связь индекса мощности β-активности с тяжестью |
прессии на 12-м месяце от начала заболевания |
тревоги на 3-м месяце от начала заболевания |
Общие особенности
Cнижение индекса мощности δ-, θ- и α-ритмов, повышение индекса мощности β-активности на 3-м месяце после инсульта
могут свидетельствовать о более выраженной дисфункции срединных структур головного мозга. Дальнейшие исследования в данной области позволят ожидать в будущем значительных сдвигов в понимании церебральных механизмов постинсультных аффективных расстройств. Это
ЛИТЕРАТУРА
1.Ашмарин И.П. Биохимия мозга. М 1999.
2.Боголепова А.Н. Депрессивные расстройства у больных с цереброваскулярной патологией, справочник поликлинического врача. М 2003.
3.Бочкарев В.К., Панюшкина С.В. Электроэнцефалографические исследования при пограничных состояниях. Пограничные психические расстройства. Под ред. Ю.А. Александровского. М 2000; 120—133.
4.Бутко Д.Ю., Давыдов А.Т. и др. Опыт диагностики и лечения тревожного расстройства в постинсультном периоде у больных, перенесших ишемический инсульт. Рус мед журн 2008; 5: 17: 266.
5.Вейн А.М., Вознесенская Т.Г., Голубев В.Л. и др. Депрессии в неврологической практике. М 2007; 198.
6.Вознесенская Т.Г. Церебральное ожирение и истощение (клиническое, нейроэндокринологическое и психофизиологическое исследование): Дис. … д-ра мед. наук. М 1990.
7.Гнездицкий В.В. Обратная задача ЭЭГ и клиническая электроэнцефалография. Таганрог 2000.
8.Гордеев С.А., Шварков С.Б. Особенности межполушарной асимметрии ЭЭГ у пациентов с генерализованными тревожными расстройствами и больных с паническими атаками. М 2009.
9.Данилова Н.Н. Связь активации мозга и холинергических медиаторных систем, реферат. М 1998; 78—90.
10.Дикевич Е.А., Федотова Е.Ю. ЭЭГ корреляты депрессии у пациентов с болезнью Паркинсона. М 2009.
11.Зенков Л.Р. Клиническая электроэнцефалография с элементами эпилептологии. Таганрог 1996.
12.Иванов Л.Б. Прикладная компьютерная электроэнцефалография. М 2000.
13.Изнак А.Ф., Чаянов Н.В. Модуляция сенсомоторной деятельности человека на фоне α-ритма. Проблемы развития научных исследований в области психического здоровья. М 1989; 3—24.
может способствовать решению таких проблем, как разработка точных диагностических тестов для людей с высоким риском постинсультных психических расстройств, создание новых терапевтических подходов на основе молекулярных механизмов этих болезней.
14.Кербиков О.Б. Формирование изменений биоэлектрической активности головного мозга в остром периоде полушарного ишемического инсульта: Дис. ... канд. мед. наук. М 2009; 30.
15.Минкин В.А., Николаенко Н.Н. Психофизиология, Психомоторика, Миокинетика, ЭЭГ, виброизображение, агрессия, терроризм, ложь, видео, реферат. М 2006.
16.Пирлик Г.П., Скворцова В.И., Гнездицкий В.В. Разработка системы контроля функционального состояния головного мозга больных с инсультами полушарной локализации на основе методов картирования и трехмерной локализации источников ЭЭГ: Дис. … канд. мед. наук. М 2000.
17.Психиатрия и психофармакотерапия журнал для психиатров и врачей общей практики. Психосоматические расстройства (клиника, терапия, организация медицинской помощи). М 2007; 9: 4.
18.Скворцова В.И. Клинический и нейрофизиологический мониторинг, метаболическая терапия в остром периоде церебрального ишемического инсульта: Дис. … д-pa мед. наук. М 1993.
19.Скок А.Б., Шубина О.С., Джафарова О.А., Веревкин Е.Г. Энцефалографический метод α-θ-тренинга при лечении аддиктивных расстройств. Биоуправление-3. Теория и практика. Новосибирск: ИМБК СО РАМН 1998; 181—187.
20.Смулевич А.Б. Клиника и систематика депрессий у соматических больных. М 2006.
21.Фарбер Д.А., Алферова В.В. Энцефалограмма детей и подростков. М: Педагогика 1972.
22.Черний В.И., Черний Е.В. и др. Практическая ангиология. Донецк 2003; 100—107.
23.Camus V., Kraehenbuhl H., Preisig M. et al. Geriatric depression and vascular diseases: what are the links? J Affect Disord 2004; 81: 1: 1—16.
24.Hermann W.M. Advances in Pharmaco-EEG. Eds F. Krijzer, W.M. Herrmann. 1996; 85—106.
84 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 6, 2010 |

НЕЙРОФИЗИОЛОГИЯ ИНСУЛЬТА
25.Bronzino D., Brusseau J. The role of serotonin and of the area postrema in synchronization of the neocortical electroencephalogram (EEG). USA 1972.
32.Shakesby A.C. et al. Overcoming the effects of stress on synaptic plasticity in the intact hippocampus: rapid actions of serotonergic and antide pressant agents. J Neurosci 2002; 22: 3638—3644.
26.Mayberg H.S. Frontal lobe dysfunction in secondary depression. J 33. Seki T., Awata S., Koizumi Y. et al. Association between depressive symp-
Neuropsychiat Clin Neurosciences 1994; 6: 4: 428—442.
27.Murphy B.E. Steroids and depression. J Steroid Biochem Mol Biol 1991; 38: 5: 537—559.
28.Narushima K., Kosier J.T., Robinson R.G. A reappraisal of poststroke depression, intraand inter-hemispheric lesion location using metaanalysis. J Neuropsychiat Clin Neurosci 2003; 15: 422—430.
29.Рassynkova N.R., Volf N.V. Seasonal affective disorder: spatial organization of EEG power and coherence in the depressive state and in light-induced and summer remission. Psychiat Rec 2001; 108: 3: 69—85.
30.Ressler K.J., Nemeroff C.B. Role of serotonergic and noradrenergic systems in the pathophysiology of depression and anxiety disorders. Depress Anxiety 2000; 12: Suppl 1: 2—19.
31.Robinson R.G., Starkstein S.E. Current research in affective disorders following stroke. J Neuropsych Clin Neuroscinces 1990; 2: 1: 1—14.
toms and cerebrovascular lesions on MRI in community-dwelling elderly individuals. Nippon Ronen Igakkai Zasshi 2006; 43: 1: 102—107.
34.Shimoda K., Robinson R.G. The relationship between poststroke depression and lesion location in long-term follow-up. Biol Psychiat 1999; 45: 187— 192.
35.Unutzer J. et al. Int psychologeriatr 2000; 12: 1: 15—33.
36.Wayne Drevets C. Neuroplasticity in mood disorders; in Dialogues in clinical neuroscience. Neuroplasticity 2004; 6: 199—216.
37.Yamada M., Kimura M., Mori T., Endo S. EEG power and coherence in presenile and senile depression. Characteristic findings related to differences between anxiety type and retardation type. Nippon Ika Daigaku Zasshi 1995; 62: 2: 176—185.
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 6, 2010 |
85 |
