
Журнал неврологии и психиатрии / 2010 / NEV_2010_05_101
.pdf
НАБЛЮДЕНИЕ ИЗ ПРАКТИКИ
Нейромиотония и миастения у больного с тимомой
Д.м.н., проф. А.Г. САНАДЗЕ, д.м.н. Д.В. СИДНЕВ, д.м.н., проф. Л.Ф. КАСАТКИНА, С.И. ДЕДАЕВ, М.Ю. КАРГАНОВ
Neuromyotonia and myasthenia in a patient with thymoma
A.G. SANADZE, D.V. SIDNEV, L.F. KASATKINA, S.I. DEDAEV, M.YU. KARGANOV
НИИ общей патологии и патофизиологии РАМН, Москва
Ключевые слова: нейромиотония, миастения, тимома.
Key words: neuromyotonia, myasthenia, thymoma.
Нейромиотония — синдром постоянной активности мышечных волокон, клинически проявляющийся периодическими болезненными судорогами (крампи), ощущением постоянного напряжения в различных группах мышц, фасцикуляциями и миокимиями [8]. Она относится к группе болезней, связанных с патологией ионных каналов: с выявлением антител к потенциалзависимым калиевым каналам периферического аксона [10, 12]. На иммунный генез заболевания указывает его сочетание с другими аутоиммунными болезнями: миастения, хроническая воспалительная демиелинизирующая полинейропатия, воспалительные миопатии (полимиозиты), тиреотоксикоз, зоб Хасимото и др. [4, 5, 7, 9]. Свидетельством паранеопластического компонента синдрома является выявление у больных с нейромиотонией опухолей различного генеза и локализации, среди которых наиболее часто встречаются тимомы, бронхогенные и мелкоклеточные карциномы легких [2, 3, 8, 12].
Тимомы выявляются у больных миастенией и нейромиотонией примерно с одинаковой (около 20%) частотой, однако весь предшествующий многолетний опыт наблюдения за большим количеством больных миастенией не выявлял случаев сочетания этих болезней. Это обстоятельство вызывало определенное недоумение в связи с тем, что в литературе имелись отдельные публикации о сочетании нейромиотонии и миастении у больных как с наличием, так и отсутствием тимомы [1—3, 7, 11]. В связи
сэтим мы считаем необходимым поделиться собственным клиническим наблюдением.
Больной М., 50 лет, впервые обратился в декабре 2007 г.
сжалобами на повышенную утомляемость и слабость, чувство скованности и напряжения в мышцах лица, туловища и конечностей, потерю массы тела. В июне—июле 2007 г. отметил быструю потерю массы тела — 15—20 кг за 2 мес при нормальном аппетите. С этого же времени отмечает выраженную общую слабость, утомляемость и субфебрильную температуру. Эти жалобы явились причиной детального обследования больного, выявившего при КТ
грудной клетки объемное образование средостения. В октябре 2007 г. в МОНИКИ методом стернотомии была произведена операция — тимомтимэктомия. Удалена инкапсулированная опухоль, гистологически определяемая как кортикально-клеточная тимома типа В. Однако после операции состояние больного не изменилось.
Объективно при осмотре в декабре 2007 г.: пациент эмоционально лабилен, вегетативен, астенизирован, постоянно пытается лечь. Пониженного питания. «Страдальческое» выражение лица. В неврологическом статусе глазодвигательных и бульбарных нарушений нет. Сила в мимической и в туловищной мускулатуре — нормальная. Синдром патологической мышечной утомляемости после физической нагрузки отсутствует. Сухожильные рефлексы на руках и ногах несколько снижены, симметричны. Патологических знаков, нарушений чувствительности нет. Имеется тремор в руках и ногах, усиливающийся при напряжении. Клинически видимых фасцикуляций и миокимий не наблюдается.
При исследовании нервно-мышечной передачи методом непрямой ритмической стимуляции декремента амплитуды М-ответа при стимуляции частотой 3 имп/с выявлено не было.
Исследование скорости распространения возбуждения (СРВ) по моторным аксонам периферических нервов выявило признаки пронаторного (n. medianus) и фибулярного (n.peroneus) туннельных синдромов, а также снижение амплитуды М-ответа на n. peroneus и минимальное снижение СРВ на n. tibialis.
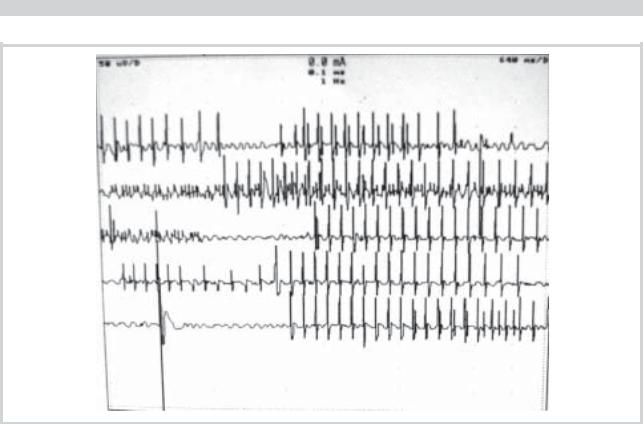
Анализ параметров потенциалов двигательных единиц (ПДЕ) и спонтанной активности мышечных волокон с помощью концентрических игольчатых электродов выявил наличие постоянной активности двигательных единиц, дуплетов и триплетов (см. рисунок). Полного расслабления мышцы добиться не удавалось. При этом средняя длительность ПДЕ находилась в пределах нормальных величин, а средняя и максимальная величины амплитуды ПДЕ были увеличены. Потенциалов фибрилляций и по-
© Коллектив авторов, 2010 |
e-mail: sanadze@mail.ru |
Zh Nevrol Psikhiatr Im SS Korsakova 2010;110:5:101 |
|
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 5, 2010 |
101 |
НАБЛЮДЕНИЕ ИЗ ПРАКТИКИ
Электромиограмма больного М. Постоянная активность двигательных единиц в передней большеберцовой мышце, регистрируемая с помощью концентрического игольчатого электрода. На 5-й линии зарегистрирован потенциал фасцикуляции. Разрешение: 50 мкВ и 640 мс на деление.
ложительных острых волн выявлено не было. Выявлялись |
Антитела к ацетилхолиновым рецепторам не выявле- |
выраженные потенциалы фасцикуляций. |
ны. |
Таким образом, данные клинического и электрофи- |
Концентрация антител к потенциалзависимым каль- |
зиологического исследования не выявляли признаков |
циевым каналам 12,7 Пмоль/л (норма до 20,0 Пмоль/л). |
миастении, а указывали на наличие синдрома гиперак- |
Уровень антител к титин-белку — 0,3 усл.ед. (норма |
тивности двигательных единиц скелетных мышц, которые |
до 1,0 усл.ед.). |
были расценены как нейромиотония. В связи с этим боль- |
С учетом данных клинического осмотра, динамиче- |
ному было начато лечение карбамазепином (финлепси- |
ского электромиографического исследования и отсут- |
ном) в дозе 200 мг 2 раза в день. Учитывая паранеопласти- |
ствия аутоантител было рекомендовано уменьшение дозы |
ческий характер синдрома, к лечению добавили метипред |
метипреда до 16 мг через день и увеличение дозы финлеп- |
в дозе 40 мг через день. Взят анализ крови на антитела к |
сина до 200 мг 3 раза в день. |
ацетилхолиновым рецепторам, потенциалзависимым |
К июню 2008 г. пациент прибавил в весе 10 кг. В не- |
кальциевым каналам и титин-белку. |
врологическом статусе выявлялось лишь снижение ко- |
На фоне проводимой терапии была отмечена отчет- |
ленных и практическое отсутствие ахилловых рефлексов, |
ливая положительная динамика в виде уменьшения ско- |
а также минимальный тремор пальцев рук. |
ванности, тремора и общей слабости. Больной прибавил в |
При электромиографическом исследовании отмеча- |
весе 5 кг. Вместе с тем стал отмечать повышенную потли- |
лась нормализация параметров ПДЕ, сохранялась посто- |
вость, сердцебиение, повышение артериального давления |
янная активность двигательных единиц, но продолжи- |
и ощущения жжения в стопах, особенно в день приема |
тельность полного расслабления мышцы увеличилась до |
глюкокортикоидных препаратов. В неврологическом ста- |
4 с. Регистрировались лишь единичные потенциалы фас- |
тусе никаких признаков слабости и патологической мы- |
цикуляций, сохранялись дуплеты, но их частота значи- |
шечной утомляемости не отмечалось. |
тельно снизилась. |
При исследовании СРВ сохранялось снижение ам- |
Исследование СРВ выявило ее снижение по n. suralis. |
плитуды М-ответа и СРВ на n. peroneus и n. suralis. |
Непрямая ритмическая стимуляция дельтовидной |
При исследовании ПДЕ и спонтанной активности от- |
мышцы не выявила признаков нарушения нервно- |
мечалось некоторое укрупнение параметров ПДЕ, значи- |
мышечной передачи. |
тельное снижение выраженности потенциалов фасцику- |
Рекомендовано уменьшение дозы финлепсина до |
ляций. Однако сохранялась постоянная активность дви- |
200 мг 2 раза в день и метипреда до 8 мг через день. |
гательных единиц и отдельные вспышки активности в |
В декабре 2008 г. неврологический статус без динами- |
виде ду- и триплетов, но удавалось добиться полного рас- |
ки. Результаты электромиографического исследования |
слабления мышцы, которое продолжалось не более 2 с. |
существенно не отличаются от данных июня 2008 г. КТ |
102 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 5, 2010 |

НЕЙРОМИОТОНИЯ И МИАСТЕНИЯ У БОЛЬНОГО С ТИМОМОЙ
средостения — данных за рецидив тимомы нет. Рекомендовано уменьшение дозы финлепсина до 300 мг в сутки, а метипреда — до 4 мг через день.
Весной 2009 г. пациент самостоятельно прекратил прием глюкокортикоидных препаратов, после чего отметил ухудшение состояния в виде появления слабости и утомляемости, затруднений глотания пищи. В этой связи вновь начат прием метипреда в дозе 16 мг через день. На фоне лечения отмечает улучшение состояния в день приема метипреда, тогда как в другой день сохраняется слабость и умеренно выраженные бульбарные расстройства. Доза финлепсина — 100 мг 2 раза в день.
В июне 2009 г. на фоне продолжающегося лечения в неврологическом статусе: снижение силы в мимической мускулатуре — 3 балла. Затруднения при жевании. Появление гнусавости голоса при длительном разговоре. Эпизоды нарушений глотания. В туловищной мускулатуре отмечается снижение силы: шея — 4 балла, дельтовидная
—3 балла, трехглавая — 4 балла, пояснично-подвздошная
—4 балла. Синдром патологической мышечной утомляемости после физической нагрузки с увеличением слабости на 1 балл.
Через 40 мин после введения 1,5 мл 0,05% раствора прозерина отмечается уменьшение выраженности бульбарного синдрома и увеличение силы мышц на 1 балл. Проба расценена как положительная.
При исследовании нервно-мышечной передачи в дельтовидной мышце выявлен декремент амплитуды М-ответа — 16% с его усугублением в период постактивационной депрессии — 38%.
Повторный анализ сыворотки крови на антитела к ацетилхолиновому рецептору выявил увеличение титра — 13,7 Нмоль/л (норма до 0,4 Нмоль/л).
Таким образом, полуторагодичное наблюдение за больным с удаленной тимомой типа В выявило наличие синдрома постоянной активности двигательных единиц, расцененное как нейромиотония с последующей транс-
формацией в миастению с клиническими, электрофизиологическими и иммунологическими проявлениями болезни.
Антитела к потенциалзависимым калиевым каналам выявляются примерно у 40% больных с нейромиотонией [11]. Эти же антитела могут быть обнаружены и при других клинических формах синдромов гиперактивности двигательных единиц и мышечных волокон, таких как «cramp-fasciculation», «rippling muscle syndrome» и «facial myokymia» [6, 9]. У 20% больных нейромиотония сочетается с тимомой, а у 70% — с миастенией и повышением уровня аутоантител к ацетилхолиновым рецепторам. У 20% больных нейромиотонией увеличение концентрации антител к ацетилхолиновым рецепторам выявляется даже при отсутствии миастении [5, 8, 11]. Вместе с тем, несмотря на частое сочетание нейромиотонии с тимомой, увеличения уровня антител к поперечнополосатым мышцам отмечено не было [7, 11].
Особенностью представленного наблюдения является трансформация нейромиотонии в миастению с регрессом клинических проявлений синдрома гиперактивности двигательных единиц и появлением мышечной слабости и патологической мышечной утомляемости. Важным обстоятельством является и то, что в период манифестации нейромиотонии у больного не выявлялось никаких клинических, электрофизиологических и иммунологических признаков миастении. Несмотря на то что исследование антител к потенциалзависимым калиевым каналам не проводилось, никаких других антител, включая аутоантитела к ацетилхолиновым рецепторам, потенциалзависимым кальциевым каналам, ганглиозидам класса GM1, мышечной специфической тирозинкиназе (Musk) и титин-белку, выявлено не было. И только в период появления клинических и электрофизиологических проявлений миастении отмечено увеличение уровня антител к ацетилхолиновому рецептору.
ЛИТЕРАТУРА
1.Antelli A., Spendos K., Zambelis T. et al. Neuromyotonia and myasthenia gravis in the absence thymoma. Eur J Neurol 2006; 13: 7: 5.
2.Evoli A., Minicuci G.M., Vitaliani R. et al. Paraneoplastic diseases associated with thymoma. J Neurol 2007; 254: 6: 756—762.
3.Fukushima K., Sato T., Mitsuhashi S. et al. Isaacs’ syndrome associated with myasthenia gravis, showing remission after cytoreductive surgery of pleural recurrence of thymoma. Neuromuscul Dis 2006; 16: 11: 763—765.
4.Iguchi M., Morimatsu A., Kondo T. et al. Case of Isaacs’ syndrome associated with Hashimoto disease. Rinsho Shinkeigaku 2007; 47: 10: 662—664.
5.Illes Z., Vincent A., Kovacs G.G. et al. Acquired neuromyotonia precipitated by thyroid surgery and associated with antiacetylcholine receptor antibodies. Eur Neurol 2006; 55: 4: 222—224.
6.Lagueny A. Cramp-fasiculatoin syndrome. Rev Neurol (Paris) 2005; 161: 12Pt 1: 1260—1266.
7.Mygland A., Vincent A., Newsom-Davis J. et al. Autoantibodies in thymomaassociated myasthenia gravis with myositis or neuromyotonia. Arch Neurol 2000; 57: 4: 527—531.
8.Newsom-Davis J. Neuromyotonia. Rev Neurol (Paris) 2004; 160: 5Pt 2: S85—89.
9.Oh S.J., Alapati A., Claussen G.C., Vtrnino S. Myokymia, neuromyotonia, dermatomyositis and voltage-gated K+ chanel antibodies. Muscle Nerve 2003; 27: 6: 757—760.
10.Tomimitsu H., Arimura K., Nagado T. et al. Mechanism of action of voltagegated K+ chanel antibodies in acquired neuromyotonia. Ann Neurol 2004; 53: 3: 440—444.
11.Van Parijs V., Van den Bergh P.Y., Vincent A. Neuromyotonia and myasthenia gravis without thymoma. J Neurol Neurosurg Psychiat 2002; 73: 3: 344— 345.
12.Vernino S. Autoimmune and paraneoplastic channelopathies. Neurotherapeutics 2007; 4: 2: 305—314.
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 5, 2010 |
103 |
