
Журнал неврологии и психиатрии / 2010 / NEV_2010_05_104
.pdf
НАБЛЮДЕНИЕ ИЗ ПРАКТИКИ
Синдром задней обратимой энцефалопатии
Чл.-корр. РАМН В.И. СКВОРЦОВА, д.м.н., проф. Л.В. ГУБСКИЙ, к.м.н. Е.А. МЕЛЬНИКОВА
Posterior reversible encephalopathy syndrome
V.I. SKVORTSOVA, L.V. GUBSKIY, E.A. MELNIKOVA
Кафедра фундаментальной и клинической неврологии и нейрохирургии Российского государственного медицинского университета,
Москва
Ключевые слова: синдром задней обратимой энцефалопатии, МРТ.
Key words: posterior reversible encephalopathy syndrome, MRI.
Термин «cиндром задней обратимой энцефалопатии»
— ЗОЭ (Posterior reversible encephalopathy syndrome — PRES) был введен в клиническую практику J. Hinchey и соавт. в 1996 г. [10]. Речь идет об уникальном синдроме, характеризующемся обратимой лейкоэнцефалопатией при отсутствии существенной деструкции белого вещества. Заметим, что для описания рассматриваемого синдрома используются также термины «гипертензивная энцефалопатия», «синдром обратимого заднего церебрального отека» и «задняя обратимая лейкоэнцефалопатия». Поскольку ЗОЭ является потенциально опасным для жизни неврологическим синдромом и при отсутствии своевременного лечения может осложниться развитием массивного инфаркта головного мозга, особенно важна его ранняя диагностика, определяющая правильность лечения пациентов [13].
В данной статье представлено соответствующее наблюдение, отличающееся некоторыми особенностями синдрома, обусловившими трудности его своевременной диагностики, и его обсуждение в аспекте существующей литературы.
Пациентка В., 72 года, пенсионерка. В анамнезе — язвенная болезнь желудка и двенадцатиперстной кишки. С 35 лет страдает артериальной гипертонией с частыми повышениями артериального давления (АД); беспокоят мигренозные цефалгии (без ауры) с частотой 1—2 раза в месяц, специфического противомигренозного лечения не получала. В качестве антигипертензивной терапии принимала препараты группы β-адреноблокаторы и ингибиторы АПФ.
17.01.07 на фоне повышенного АД у пациентки впервые в жизни развился генерализованный тоникоклонический судорожный припадок продолжительностью около 5 мин, сопровождавшийся прикусом языка, непроизвольными мочеиспусканием и дефекацией. При госпитализации отмечались дезориентация в месте и времени, нарушения речи по типу моторной афазии, персеверации, сухожильная анизорефлексия D>S, опускание правой ру-
ки в пробе Баре, диффузное снижение мышечного тонуса. АД 130/80 мм рт.ст., ЧСС 72 уд. в мин, пульс ритмичный, живот мягкий, безболезненный. Лабораторные исследования: в общем анализе крови, мочи, биохимическом анализе крови — без особенностей, гормоны щитовидной железы — в пределах нормы, исследования крови на Hbsантиген, antiHCV, ВИЧ, RW — отрицательные.
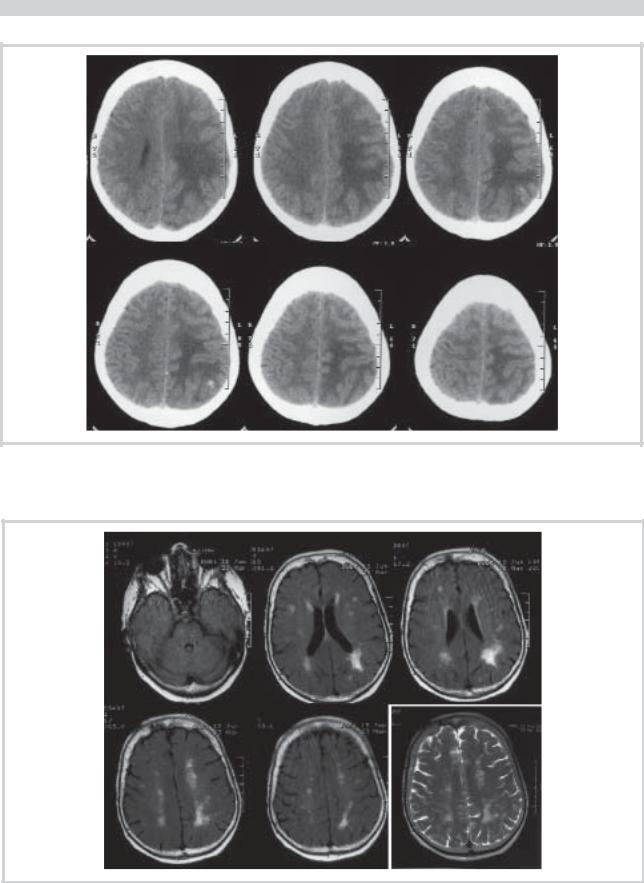
При рентгеновской компьютерной томографии (КТ), проведенной на 2-й день заболевания (рис. 1), выявлен асимметричный вазогенный отек в задних отделах полушарий мозга, больше слева, в левой теменной доле имелось небольшое кровоизлияние. Патологического накопления контрастного препарата в структурах мозга не отмечалось. Эти данные отражены на рис. 1.
При магнитно-резонансной томографии (МРТ) с контрастным усилением, проведенной на 3-й день заболевания, были выявлены изменения, подтверждающие наличие асимметричного вазогенного отека в задних отделах полушарий мозга. Дополнительно был выявлен небольшой участок контрастного накопления в базальном отделе правой височной доли, что явилось основанием для предположения о наличии метастатического поражения головного мозга (рис. 2).
Неврологическая симптоматика полностью регрессировала в течение 7 дней на фоне противосудорожной (финлепсин), противоотечной (сульфат магния, дексазон) и антигипертензивной (энап, атенолол) терапии, судорожные припадки не повторялись.
В этот период проводилась дифференциальная диагностика с метастатическим поражением головного мозга.
При МРТ-исследовании через 2 мес и 10 дней от развития неврологических нарушений выявлены изменения, соответствующие лейкоареозу и небольшим участкам глиозной трансформации в паравентрикулярном и субкортикальном белом веществе полушарий мозга, а также мосту мозга. Имелось расширение периваскулярных пространств в полушариях и ножках мозга. Полностью регрессировал вазогенный отек, и не наблюдалось участков
© Коллектив авторов, 2010 |
e-mail: melkaterina3@yandex.ru |
Zh Nevrol Psikhiatr Im SS Korsakova 2010;110:5:104 |
e-mail: gubskii@mail.ru |
|
104 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 5, 2010 |
ЗАДНЯЯ ОБРАТИМАЯ ЭНЦЕФАЛОПАТИЯ
Рис. 1. КТ головного мозга на 2-й день заболевания (18.01.07).
В задних отделах полушарий мозга отмечаются гиподенсивные изменения в белом веществе, соответствующие вазогенному отеку. Отмечается выраженная асимметрия с преобладанием отека в левом полушарии мозга. В левой теменной доле субкортикально располагается небольшое внутримозговое кровоизлияние.
Рис. 2. МРТ головного мозга на 3-й день заболевания (19.01.07).
На Т2-взвешенных изображениях в задних отделах полушарий мозга отмечаются гиперинтенсивные изменения в белом веществе, соответствующие вазогенному отеку, который более выражен в левом полушарии. Патологического накопления контрастного вещества (магневист 20 мл) в структурах мозга не наблюдалось за исключением небольшого (9×7 мм) участка слабого контрастного усиления в базальном отделе правой височной доли (на рисунке не представлен).
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 5, 2010 |
105 |

НАБЛЮДЕНИЕ ИЗ ПРАКТИКИ
Рис. 3. МРТ мозга через 2 мес и 10 дней от развития неврологических расстройств (март 2007 г.).
Т2-взвешенные изображения с подавлением сигнала «свободной» воды (методика FLAIR) — верхний ряд и два изображения слева в нижнем ряду — и Т2-взвешенное изображение справа внизу. Имеются гиперинтенсивные участки в паравентрикулярном и подкорковом белом веществе больших полушарий и в мосту мозга, которые могут соответствовать лейкоареозу и глиозной трансформации вещества мозга. Отмечается расширение периваскулярных пространств в полушариях мозга. Патологического накопления контрастного вещества в структурах мозга не наблюдалось.
патологического накопления контрастного вещества в структурах мозга (рис. 3).
В дальнейшем судорожные припадки у пациентки не наблюдались. Через 2 года (январь 2009 г.) было проведено контрольное МРТ-исследование с контрастным усилением, при котором не выявлено существенной динамики по сравнению с предшествующим исследованием в марте 2007 г.
Точные данные о распространенности синдрома ЗОЭ в литературе отсутствуют. Синдром встречается в широком возрастном диапазоне. Так M. Chou и соавт. [4] описали 12 пациентов в возрасте от 11 до 70 лет, а D. Covarrubias и соавт. [5] — 34 пациентов в возрасте от 4 до 90 лет.
Описана связь синдрома ЗОЭ с различными состояниями, сопровождающимися повышением АД и/или нарушением функции почек (табл. 1) [2—5, 10, 16, 19, 20].
Несмотря на то что заметное повышение АД в дебюте заболевания отмечено у большинства больных, имеются описания нескольких случаев незначительного повышения или даже нормального АД, что, вероятно, наблюдалось и у нашей пациентки [4].
Синдром ЗОЭ характеризуется появлением и быстрым прогрессированием таких симптомов, как головная боль, тошнота, рвота, спутанность сознания, поведенческие расстройства, угнетение сознания (от сомноленции до ступора), зрительные расстройства (в виде нечеткости зрения или транзиторной слепоты), наблюдаются судорожные припадки (преимущественно парциальные с вторичной генерализацией) [4, 10]. Судорожные припадки
нередко являются первым симптомом, что и имело место у нашей пациентки. Могут наблюдаться ментальные нарушения, характеризующиеся апатией, снижением концентрации внимания, мнестическими расстройствами. Летаргия, сменяющаяся периодами ажитации, также описана как первый симптом заболевания [13].
Неврологические нарушения, как правило, регрессируют в течение нескольких недель, если причины синдрома ЗОЭ устранены [3—5, 10, 19, 20]. По данным G. Leroux и соавт. [12] и J. Hinchey и соавт. [10] регресс симптомов наблюдается в течение 14—15 дней. B. Petrović и соавт. [13] описывают полное восстановление у пациента с артериальной гипертонией в течение 9 дней, нормализация КТ картины наблюдалась к 15-му дню. Основываясь на данных литературы, B. Petrović и соавт. [13] сообщают, что в большинстве случаев неврологические симптомы полностью регрессируют к 7-му дню с момента начала заболевания, однако имеются описания случаев, когда восстановление затягивалось на срок до 1 года и более. У нашей пациентки неврологические расстройства были купированы в течение недели. О сроках нормализации нейровизуализационной картины трудно судить достоверно, но на МРТ головного мозга, проведенной спустя 2 мес после начала заболевания, наблюдался полный регресс ранее выявленных изменений.
При синдроме ЗОЭ развивается обратимый вазогенный отек преимущественно в задних отделах полушарий мозга, хотя имеются описания формирования необратимого цитотоксического отека и инфаркта мозга [5]. Отек
106 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 5, 2010 |

ЗАДНЯЯ ОБРАТИМАЯ ЭНЦЕФАЛОПАТИЯ
Таблица 1. Частота (%) различных патологических состояний у пациентов с синдромом ЗОЭ
|
|
|
|
|
|
Авторы/количество наблюдений |
|
|
|
Итого |
|||||
|
|
|
|
|
|
|
D. Covarru- |
|
J. Proven- |
|
|
|
|||
Патологическое состояние |
J. Hinchey |
G. Leroux |
S. Casey |
M. Chou и |
наблюде- |
||||||||||
|
|
и соавт./15 |
и соавт./46 |
bias |
|
и соавт. /23 |
zale |
соавт./12 |
ний — 141 |
||||||
|
|
|
|
|
|
|
и соавт./34 |
|
и соавт./11 |
|
|
|
|
||
Артериальная гипертония |
|
4 (26,7%) |
44 (95,6%) |
19 (55,8%) |
2 (8,7%) |
7 (63,6%) |
11 (91,6%) |
|
87 (61,7%) |
||||||
Нарушение функции почек |
|
4 (26,7%) |
42 (91,3%) |
12 (35,3%) |
2 (8,7%) |
2 (18,2%) |
11 (91,6%) |
|
73 (51,8%) |
||||||
различной этиологии |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
(люпус-нефрит, гломеруло- |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
нефрит, лекарственно- |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
индуцированный гепаторе- |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
нальный синдром и т.д.) |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Прием иммуносупрессан- |
|
9 (60%) |
25 (54,3%) |
8 (23,5%) |
|
13 (56,5%) |
7 (63,6%) |
0 |
|
62 (44%) |
|||||
тов (циклоспорин, циспла- |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
тин, такролимус, |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
α-интерферон, интрате- |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
кальное введение метотрек- |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
сата) |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Внутривенное введение |
|
0 |
20 (43,4%) |
0 |
|
0 |
0 |
0 |
|
20 (14,2%) |
|||||
больших доз стероидов |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Преэклампсия/эклампсия |
|
3 (20%) |
|
0 |
2 (6%) |
|
0 |
2 (18,2%) |
1 (8,3%) |
|
8 (5,7%) |
||||
Таблица 2. Частота (%) поражений мозга различной локализации у пациентов с синдромом ЗОЭ по данным МРТ |
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||
Локализация поражения в голов- |
|
|
Публикации: авторы/количество наблюдений |
|
|
Итого |
|||||||||
|
|
|
|
|
|
|
|
|
|||||||
D. Covarrubias |
S. Casey |
J. Hinchey |
M. Chou |
F. Donmez |
наблюдений |
||||||||||
ном мозге |
|
|
|||||||||||||
|
|
|
— 105 |
||||||||||||
|
|
|
|
и соавт./22 |
и соавт./23 |
и соавт./15 |
и соавт./12 |
и соавт./33 |
|
||||||
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||
Лобная доля (белое вещество) |
|
18 (82%) |
9 (39%) |
7 (46,7%) |
4 (33,3%) |
17 (51,5%) |
|
55 |
(52,4%) |
||||||
Теменная доля (белое вещество) |
|
|
0 |
9 (39%) |
13 (86,7%) |
7 (58,3%) |
28 (84,8%) |
|
57 |
(54,3%) |
|||||
Затылочная доля (белое веще- |
|
|
|
0 |
14 (60,9%) |
14 (93,3%) |
11 (91,7%) |
24 (72,7%) |
|
63 (60%) |
|||||
ство) |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Височная доля (белое вещество) |
20 (91%) |
6 (26%) |
|
9 (60%) |
3 (25%) |
11 (33,3%) |
|
49 |
(46,7%) |
||||||
Мост мозга |
|
11 (50%) |
2 (8,7%) |
2 (13,3%) |
2 (16,7%) |
0 |
|
17 |
(16,2%) |
||||||
Базальные ганглии |
|
15 (68%) |
4 (17,4%) |
2 (13,3%) |
1 (8,3%) |
0 |
|
22 |
(20,9%) |
||||||
(таламус, хвостатое ядро, наруж- |
|
|
|
|
|
|
|
|
|
|
|||||
ная и внутренняя капсула) |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Мозжечок |
|
|
|
0 |
|
0 |
|
1 (6,7%) |
2 (16,7%) |
11 (33,3%) |
|
14 |
(13,3%) |
||
Мозолистое тело |
|
|
|
0 |
|
0 |
|
0 |
1 (8,3%) |
0 |
|
1 |
(0,9%) |
||
Гиппокамп |
|
|
|
0 |
1 (4,3%) |
|
0 |
0 |
0 |
|
1 |
(0,9%) |
|||
Тотальное поражение (кора и бе- |
0 |
11 (47,8%) |
|
0 |
0 |
0 |
|
11 |
(10,5%) |
||||||
лое вещество) |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
захватывает преимущественно белое вещество, но может распространяться и на прилегающее серое вещество (табл. 2).
В большинстве случаев очаги распределяются симметрично в обоих полушариях, однако асимметричное их расположение также описано [3, 10]. У нашей пациентки поражение носило асимметричный характер с преимущественным вовлечением теменно-затылочной области левого полушария головного мозга.
При синдроме ЗОЭ очаги поражения имеют повышенную интенсивность сигнала на Т2-взвешенных изо-
бражениях, в том числе изображениях в режиме FLAIR, контрастное усиление обычно не наблюдается. Однако имеются единичные описания слабого локального накопления контрастного вещества, вероятно, вследствие локального нарушения гематоэнцефалического барьера, возможно, с формированием петехиальных кровоизлияний [4—6, 8, 11]. Мы не наблюдали у пациентки накопления контрастного агента в зоне поражения, но в остром периоде имелся небольшой участок контрастного усиления в базальном отделе правой височной доли, происхождение которого остается неясным, так как при последу-
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 5, 2010 |
107 |
НАБЛЮДЕНИЕ ИЗ ПРАКТИКИ |
|
ющих исследованиях на протяжении 3 лет в данном месте |
лиянием при синдроме ЗОЭ: у 6 (85,7%) была выявлена |
не отмечалось контрастного усиления. |
внутримозговая гематома, у 1 (14,3%) — субарахноидаль- |
При подозрении на наличие синдрома ЗОЭ желатель- |
ное кровоизлияние. Однако в обоих исследованиях все |
но получение диффузионно-взвешенных изображений, |
пациенты с кровоизлиянием имели геморрагический диа- |
что необходимо для дифференциальной диагностики ти- |
тез или коагулопатию на фоне лечения антикоагулянта- |
па отека мозга (вазогенный или цитотоксический). Повы- |
ми, а синдром ЗОЭ развивался при нормальном АД. |
шение сигнала на диффузионно-взвешенных изображе- |
Атипичность представленного нами наблюдения |
ниях указывает на формирование инфаркта мозга при |
(асимметричность поражения полушарий мозга) послу- |
данном синдроме [4, 5, 8]. |
жила поводом для проведения дополнительной диффе- |
Имеются две теории патогенеза радиологических из- |
ренциальной диагностики с диффузной церебральной |
менений при синдроме ЗОЭ. Согласно более ранней тео- |
амилоидной ангиопатией (ЦАА) в сочетании или без ан- |
рии, спазм церебральных сосудов, возникающий в ответ |
гиита центральной нервной системы (АЦНС). В литерату- |
на внезапное резкое повышение системного АД, приво- |
ре [15] имеются описания пяти случаев, когда нейровизу- |
дит к отеку вещества мозга преимущественно в области |
ализационная картина при данном заболевании напоми- |
смежных зон кровообращения [4]. Более поздняя теория |
нала наблюдавшуюся нами у пациентки В. При МРТ у |
основана на результатах изучения диффузионно- |
больных с ЦАА в сочетании или без АЦНС выявляли диф- |
взвешенных изображений: повышенное системное АД |
фузные асимметричные очаги поражения головного мозга |
нарушает ауторегуляцию церебрального кровотока, вызы- |
с объемным воздействием, гиперна Т2-взвешенных и |
вая гиперперфузию мозга и пассивное растяжение цере- |
гипоинтенсивные на Т1-взвешенных изображениях и не |
бральных артериол с последующей интерстициальной |
накапливающие контрастное вещество. Такие поражения |
экстравазацией жидкости и развитием локального парен- |
сложно отличить от низкодифференцированной глиомы |
химатозного гидростатического отека [4, 5, 14]. |
или инфаркта мозга. В дебюте заболевания для больных с |
Предполагается, что преимущественное вовлечение |
ЦАА в сочетании или без АЦНС характерно наличие су- |
задних отделов мозга при синдроме ЗОЭ связано с нерав- |
дорожных припадков. В анамнезе, как правило, имеются |
номерностью симпатической иннервации церебральных |
мигренозные цефалгии, что наблюдалось и у нашей паци- |
сосудистых структур. Симпатический нерв из верхнего |
ентки. Быстрый регресс симптомов происходит на фоне |
шейного симпатического ганглия преимущественно ин- |
лечения стероидами у 60% больных, спонтанное восста- |
нервирует сосуды бассейна внутренней сонной артерии |
новление — только у 5% [15]. Однако доброкачественное |
[2, 4]. Вертебрально-базилярная система имеет относи- |
течение заболевания у нашей пациентки с полным регрес- |
тельно более слабую симпатическую иннервацию. В нор- |
сом клинических симптомов и нормализацией нейрови- |
ме церебральные механизмы ауторегуляции, направлен- |
зуализационной картины, а также отсутствие рецидивов в |
ные на поддержание стабильной перфузии вещества моз- |
течение достаточно длительного периода наблюдения по- |
га, зависят от мио- и нейрогенных компонентов. Когда |
служили основанием для отказа от диагноза ЦАА в соче- |
миогенный компонент нарушается из-за пассивного пе- |
тании или без АЦНС в пользу синдрома ЗОЭ. |
рерастяжения сосудов вследствие повышенного АД или в |
Правильная диагностика синдрома ЗОЭ важна в свя- |
результате прямого токсического воздействия на эндоте- |
зи с тем, что своевременно начатая антигипертензивная и |
лий, например при уремической энцефалопатии или ле- |
противоотечная терапия способствует полному обратно- |
чении иммуносупрессантами, нейрогенный ответ начи- |
му развитию клинических и радиологических нарушений. |
нает играть более важную роль в поддержании стабильно- |
Клинические симптомы данного состояния часто неспе- |
го церебрального кровотока [3, 5, 10]. Эффективность |
цифичны, поэтому диагноз бывает сложно установить. |
нейрогенного компонента напрямую зависит от степени |
Различные патологические состояния головного мозга |
симпатической иннервации, вследствие чего возрастает |
(ишемический инсульт, в том числе тромбоз/эмболия ба- |
риск развития вазогенного отека в участках кровоснабже- |
зилярной артерии, внутричерепное кровоизлияние, ве- |
ния вертебрально-базилярной системы [5]. Возросшая |
нозный тромбоз, энцефалит, демиелинизация) могут |
перфузия в зонах поражения при синдроме ЗОЭ была от- |
имитировать синдром ЗОЭ [2, 10, 20]. Венозный тромбоз |
мечена при проведении однофотонной эмиссионной КТ |
может быть выявлен при проведении МРТ мозга в сочета- |
[4]. |
нии с МР-ангиографией. Отличить синдром ЗОЭ от де- |
В нашем наблюдении у пациентки имелось неболь- |
миелинизации и энцефалита можно по преимущественно |
шое кровоизлияние в зоне поражения. В литературе опи- |
симметричному расположению очагов поражения в за- |
сано развитие внутричерепных кровоизлияний при син- |
дних отделах головного мозга. Диффузионно-взвешенные |
дроме ЗОЭ. H. Hefzy и соавт. [9] выявили субарахноидаль- |
изображения помогают провести дифференциальный ди- |
ное и/или внутримозговое кровоизлияние (по типу гема- |
агноз между синдромом ЗОЭ и инфарктом мозга. При |
томы или петехиальных кровоизлияний) у 23 (15,2%) из |
правильном и своевременно начатом лечении полное об- |
151 пациента с синдромом ЗОЭ. R. Aranas и соавт. [1] при- |
ратное развитие очаговых радиологических изменений |
водят описание 7 пациентов с внутричерепным кровоиз- |
при синдроме ЗОЭ наблюдается в 90% случаев [4]. |
ЛИТЕРАТУРА
1. |
Aranas R.M., Prabhakaran S., Lee V.H. Posterior Reversible Encephalopa- |
2. |
Ay H., Buonanno F.S., Schaefer P.W. et al. Posterior leukoencephalopathy |
|
thy Syndrome Associated with Hemorrhage. Neurocrit Care 2009; 10: 3: |
|
without severe hypertension: utility of diffusion-weighted MRI. Neurology |
|
306—312. |
|
1998; 51: 1369—1376. |
108 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 5, 2010 |

ЗАДНЯЯ ОБРАТИМАЯ ЭНЦЕФАЛОПАТИЯ
3.Casey S.O., Sampaio R.C., Michel E. et al. Posterior reversible encephalopa12. Leroux G., Sellam J., Costedoat-Chalumeau N. et al. Posterior reversible en-
thy syndrome: utility of fluid-attenuated inversion recovery MR imaging in the detection of cortical and subcortical lesions. AJNR Am J Neuroradiol 2000; 21: 7: 1199—1206.
4.Chou M.C., Lai P.H., Yeh L.R. et al. Posterior reversible encephalopathy syndrome: magnetic resonance imaging and diffusion-weighted imaging in 12 cases. Kaohsiung J Med Sci 2004; 20: 8: 381—388.
cephalopathy syndrome during systemic lupus erythematosus: four new cases and review of the literature. Lupus 2008; 17: 2: 139—147.
13.Petrović B., Kostić V., Sternić N. et al. Posterior reversible encephalopathy syndrome. Srp Arh Celok Lek 2003; 131: 11: 461—466.
14.Provenzale J.M., Petrella J.R., Cruz L.C. Jr. et al. Quantitative assessment of diffusion abnormalities in posterior reversible encephalopathy syndrome. AJNR Am J Neuroradiol 2001; 22: 8:1450—1451.
5.Covarrubias D.J., Luetmer P.H., Campeau N.G. Posterior reversible encephalopathy syndrome: prognostic utility of quantitative diffusion-weighted MR images. AJNR Am J Neuroradiol 2002; 23: 6: 1038—1048.
6.Donmez F.Y., Basaran C., Kayahan Ulu E.M. et al. MRI Features of Posterior Reversible Encephalopathy Syndrome in 33 Patients. J Neuroimaging 2008.
7.Finocchi V., Bozzao A., Bonamini M. et al. Magnetic resonance imaging in Posterior Reversible Encephalopathy Syndrome: report of three cases and review of literature. Arch Gynecol Obstet 2005; 271: 1: 79—85.
8.Garg R.K. Posterior leukoencephalopathy syndrome. Postgrad Med J 2001; 77: 903: 24—28.
9.Hefzy H.M., Bartynski W.S., Boardman J.F. et al. Hemorrhage in Posterior Reversible Encephalopathy Syndrome: Imaging and Clinical Features. AJNR Am J Neuroradiol 2009; 30: 7: 1371—1379.
10.Hinchey J., Chaves C., Appignani B. et al. A reversible posterior leukoencephalopathy syndrome. N Engl J Med 1996; 22: 334: 8: 494—500.
11.Lamy C ., Oppenheim C ., Méder J.F. et al. Neuroimaging in posterior reversible encephalopathy syndrome. J Neuroimaging 2004; 14: 2: 89—96.
15.Safriel Y., Sze G., Westmark K. et al. MR spectroscopy in the diagnosis of cerebral amyloid angiopathy presenting as a brain tumor. Am J Neuroradiol 2004; 25: 1705—1708.
16.Schwartz R.B., Jones K.M., Kalina P. et al. Hypertensive encephalopathy: findings on CT, MR imaging and SPECT imaging in 14 cases. AJR 1992; 159: 379—383.
17.Servillo G., Bifulco F., De Robertis E. et al. Posterior reversible encephalopathy syndrome in intensive care medicine. Intensive Care Med 2007; 33: 2: 230—236.
18.Striano P., Striano S., Tortora F. et al. Clinical spectrum and critical care management of Posterior Reversible Encephalopathy Syndrome (PRES). Med Sci Monit 2005; 11: 11: 549—553.
19.Sundgren P.C., Edvardsson B., Holtas S. Serial investigation of perfusion disturbances and vasogenic oedema in hypertensive encephalopathy by diffusion and perfusion weighted imaging. Neuroradiology 2002; 44: 299—304.
20.Yoshida K., Yamamoto T., Mory K. et al. Reversible posterior leukoencephalopathy syndrome in a patient with hypertensive encephalopathy: case report. Neurol Med Chir (Tokyo) 2001; 41: 364—369.
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 5, 2010 |
109 |
