
Журнал неврологии и психиатрии / 2010 / NEV_2010_08_041
.pdf
Патогенез и новая стратегия в коррекции нарушений невральной проводимости при компрессионно-ишемических невропатиях (клиническое и экспериментальное исследование)
C.А. ЖИВОЛУПОВ, Е.Ю. ШАПКОВА, И.Н. САМАРЦЕВ, К.В. ФЕДОРОВ
Pathogenesis and new strategy in treatment of neuronal conductivity impairments in compressionischemic neuropathies: a clinical and experimental study
S.A. ZHIVOLUPOV, E.J. SHAPKOVA, I.N. SAMARTSEV, R.V. FEDOROV
Кафедра нервных болезней Военно-медицинской академии им. С.М. Кирова, Санкт-Петербург
Компрессионно-ишемические невропатии остаются одной из наиболее актуальных проблем современной неврологии в виду широкой распространенности и частых неудовлетворительных исходов лечения. В настоящей работе изучены патогенетические механизмы формирования и восстановления невральной проводимости возбуждения при моделировании экспериментальной компрессионно-ишемической невропатии на кроликах, проанализированы особенности терапевтической эффективности антихолинэстеразного препарата нейромидин в лечении компрессионноишемических невропатий в клинических условиях. Обнаружена генерализованная реакция нервной системы на острую компрессию конечности со сдавлением седалищного нерва у экспериментальных животных. Убедительно доказана способность препарата нейромидин улучшать центральную проводимость. Полученные данные позволяют рекомендовать применение нейромидина в комплексном лечении пациентов с компрессионно-ишемическими невропатиями ввиду его способности оказывать как периферический, так и центральный эффекты.
Ключевые слова: компрессионно-ишемическая невропатия, проводимость, диашиз, нейромидин.
Compression-ischemic neuropathies remain one of the most actual problems of contemporary neurology due to the prevalence and commonly poor outcome. In the present work, we studied pathogenetic mechanisms of the formation and restoration of neural conductivity in the compression-ischemic model in rabbits and analyzed some features of therapeutic efficacy of the anticholinesterase drug neuromidin in clinical treatment of compression-ischemic neuropathies. We observed a generalized reaction of the nervous system to the acute limb compression in experimental animals. The ability of neuromidin to improve the central conductivity has been clearly shown. The results obtained allow recommending neuromidin in the treatment of patients with compression-ischemic neuropathies owing to its central and peripheral effects.
Key words: compression-ischemic neuropathy, conductivity, diaschisis, neuromidin.
Травматические невропатии составляют существенную долю (15—35‰) в структуре заболеваний периферической нервной системы. Они отличаются длительностью стационарного лечения пострадавших в медицинских учреждениях различного профиля с частой (свыше 29%) инвалидизацией больных, что определяет медикосоциальную значимость проблемы [5].
Одно из ведущих мест в структуре травматических невропатий по частоте (40—60%) и показателям продолжительности лечения занимают компрессионно-ишеми- ческие повреждения [1]. Несмотря на очевидные успехи в изучении патогенетических механизмов травматических повреждений периферической нервной системы (ПНС), результаты комплексного лечения пациентов с данной патологией достаточно скромны [9]. Остаются в значительной степени не раскрытыми факторы, влияющие на формирование нарушений невральной проводимости возбуждения и естественное ее восстановление в резуль-
© Коллектив авторов, 2010
Zh Nevrol Psikhiatr Im SS Korsakova 2010;110:8:41
тате нейропластичности. Прикладные задачи этой проблемы не могут быть решены без фундаментальных исследований нейрофизиологических механизмов терапевтической модуляции компенсаторно-восстановительных процессов при травмах нервов. Поэтому изучение патогенеза и наиболее эффективных путей коррекции нарушений невральной проводимости при компрессионноишемических невропатиях в клинических и экспериментальных наблюдениях представляется важной и актуальной научной проблемой современной неврологии.
Целью настоящего исследования было изучение патогенетических механизмов формирования и восстановления невральной проводимости возбуждения при моделировании экспериментальной компрессионно-ишеми- ческой невропатии на кроликах, а также анализ особенностей терапевтической эффективности антихолинэстеразного препарата нейромидин (ипидакрин) в лечении компрессионно-ишемических невропатий в клинических условиях.
Тел.: 542-72-97
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 8, 2010 |
41 |

ЭКСПЕРИМЕНТАЛЬНО-ТЕОРЕТИЧЕСКИЕ ВОПРОСЫ
Материал и методы
Исследование было проведено на базе кафедры нервных болезней Военно-медицинской академии им. С.М. Кирова (Санкт-Петербург). Протокол экспериментального и клинического исследования, в соответствие с методикой описанной ниже, был одобрен этическим комитетом академии.
Для решения поставленной задачи были проведены опыты на 4 беспородных половозрелых кроликах самцах весом 3,5—4,5 кг, содержащихся в стационарных клетках в виварии на обычном пищевом рационе при смешанном типе кормления.
Методика эксперимента заключалась в следующем: после снятия фоновых параметров, характеризующих исходное состояние нервно-мышечного аппарата по данным вызванной электромиографической активности камбаловидных мышц — М-ответ и Н-рефлекс, вызванным потенциалам спинного мозга (ВПСМ) и головного мозга (ВПГМ) на конечность наносилось компрессионное воздействие. Животным накладывался узкий проволочный «артериальный» жгут, снабженный специальным хомутом, на верхнюю треть бедра выше стимулирующих электродов. Сразу после наложения жгута и через каждые 30 мин проводилась регистрация перечисленных выше электрофизиологических параметров в течение 2 ч. По окончании времени компрессии на протяжении 3 ч наблюдали восстановление проводимости седалищного нерва и оценивали функциональную активность сегментарного аппарата спинного мозга, а также соответствующих проекционных зон коры головного мозга.
Для осуществления измерений выполнялись следующие подготовительные процедуры. Животное, анестезированное начальной дозой гексенала (60—90 мг/кг массы тела), фиксировали в станке в положении лежа на животе. Далее осуществляли препаровку задних лап, в процессе которой выделяли седалищные нервы на уровне средней трети бедра. На них накладывали пенальчиковые биполярные серебряные электроды для стимуляции. Рану послойно ушивали. В камбаловидные мышцы симметрично вводили биполярные концентрические игольчатые электроды фирмы DISA (тип I3К82). На уровне позвонков L2—L4 животным эпидурально вводили копьевидные игольчатые электроды того же изготовителя (тип I3K63). Аналогичные электроды вводили в скальп в зоне точки «вертакс».
Подготовленное к опыту животное подсоединяли к установке для электронейромиографии (ЭНМГ), состоящей из аппарата Nicolet Viking-IV, 2-координатного самописца Н-36 и шлейфного осциллографа H-117 [6]. При проведении электрофизиологических исследований анализировали динамику вызванных потенциалов (ВП) мышцы (М-ответ), спинного и головного мозга в ответ на стимуляцию седалищного нерва на стороне компрессии и контралатеральной стороне у экспериментальных животных до и после наложения жгута на лапу.
Нейроморфологические исследования проводили при помощи электронной микроскопии. Взятие материала у экспериментальных животных производилось по методу Б.С. Дойникова в модификации Г.А. Акимова и В.В. Семеновой-Тян-Шанской [2]. Изучались различные отделы периферической и центральной нервной системы. Материал для электронно-микроскопических исследова-
ний фиксировали 2% осмиевой кислотой с какодилатным буфером, заливали в эпон-812 и контрастировали в азотнокислом свинце по Рейнольдсу. Предварительную оценку материала проводили на полутонких срезах толщиной 1 мкм, окрашенных толуидиновым синим по Нисслю. Ультратонкие срезы изучали в электронном микроскопе УЕ-100 СХ. Всего было исследовано 200 электронограмм.
Для определения механизма действия нейромидина в лечении компрессионно-ишемических невропатий было проведено нейрофизиологическое обследование 10 здоровых и 10 больных с компрессионно-ишемическими невропатиями (7 человек с поражением лучевого нерва, 3 — малоберцового). Обследованные были одного пола и возраста. В зависимости от клинической картины и результатов проведенных ранее исследований все пациенты были разделены на 2 группы в соответствии с патогенетическим вариантом повреждения нервов — неврапраксией и аксонотмезисом.
Для обследования использовалась методика оценки соматосенсорных вызванных потенциалов (ССВП). Исследование заключалось в следующем: в начале снимались фоновые показатели ССВП, затем внутримышечно вводилось 15 мг нейромидина и через 30 мин проводилась многократная регистрация ССВП по стандартной методике [6]. При исследовании ССВП с верхних конечностей для регистрации периферического сенсорного ответа от плечевого сплетения первый электрод размещался в точке Эрба, находящейся в средней части ключицы. Следующий электрод размещался на шейном уровне позвоночника в зоне проекции С7 (или С6). Для регистрации корковых сенсорных ответов (оценка компонентов N10, N13, P14, N18, N20) электроды размещали на 2 см сзади от электродов С3 или С4 по международной системе отведений. При исследовании ССВП с нижних конечностей первый электрод размещался над третьим поясничным позвонком, последующие — аналогично с верхних конечностей (оценка компонентов N22, N30, P38, N46). Измеряли амплитуды и латентности пиков и межпиковых латентностей: в точке Эрба — пик N10, в отведении шеяскальп — компоненты N11, N13, N14 и P14, пиковые латентности P9, Р13-14, а также N18, N20, определяли скорости проведения (м/с) на различных уровнях.
Результаты, полученные при исследовании здоровых и больных с компрессионно-ишемическими невропатиями, сравнивали между собой.
Статистическая обработка результатов исследований проводилась с использованием пакета прикладных программ STATGRAPHICS фирмы «Manugistuics, Inc» (STSC) в соответствии с рекомендациями по обработке результатов медико-биологических исследований [4]. Выбор соответствующих методик проводили с учетом общепринятых правил системного анализа и моделирования динамических исследований. Заключение о статистической значимости давалось при уровне вероятности ошибочного заключения p<0,05.
Результаты
Экспериментальные исследования
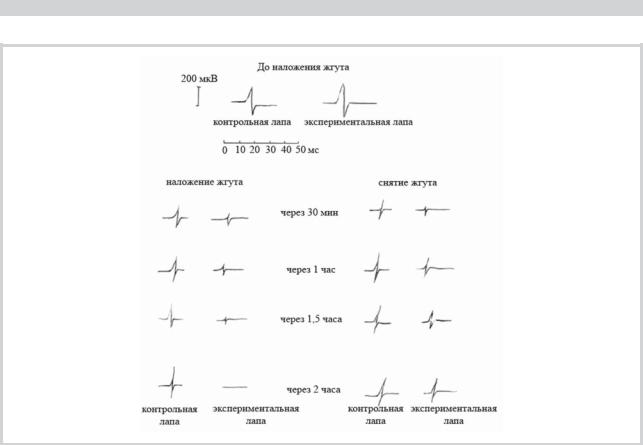
В опытах на кроликах было выявлено, что форма М-ответа после наложения жгута на лапу и его снятия менялась существенным образом на стороне компрессии (рис. 1). Наряду с резким уменьшением амплитуды, вплоть
42 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 8, 2010 |
КОМПРЕССИОННО-ИШЕМИЧЕСКИЕ НЕВРОПАТИИ
Рис. 1. Изменение формы (амплитуды) М-ответа икроножной мышцы после наложение жгута на заднюю лапу кролика.
до полного отсутствия ВП через 2 ч после наложения жгу- |
мкВ), оставаясь на низком уровне в течение 1,5 ч, а через |
та, отмечалась их полифазность, что, в свою очередь, со- |
2 часа ВП икроножной мышцы не регистрировались. |
провождалось компенсаторным увеличением продолжи- |
Сразу после снятия жгута выявлялся низкоамплитуд- |
тельности М-ответа. После снятия жгута просматривалась |
ный полифазный ответ («гребневидная зубчатость»), что |
отчетливая тенденция к постепенной нормализации фор- |
отражает асинхронную активацию ДЕ за счет нарушения |
мы М-ответа. |
проводимости импульсов по части аксонов. Через 30 мин |
Продолжительность (длительность) М-ответа проа- |
после снятия жгута амплитуда М-ответа значительно уве- |
нализирована статистически для исследуемой и контрала- |
личилась (206,0±29,8 мкВ), оставаясь в дальнейшем по- |
теральной сторон. Выявлено достоверное увеличение это- |
стоянной. Существенно, что даже через 2 ч после снятия |
го параметра на экспериментальной лапе через 1,5 ч после |
жгута амплитуда М-ответа не достигала исходного уровня |
наложения жгута, а через 2 ч М-ответ вообще не регистри- |
(238,0±40,9 мкВ; р<0,05). Данный феномен является про- |
ровался. После снятия жгута длительность М-ответа, в |
явлением спинального диашиза, а также частичного аксо- |
основном, оставалась больше исходной. Так, через 2 ч по- |
нотмезиса в месте компрессии. |
сле снятия жгута время М-ответа составило 13,0±2,18 мс. |
На контралатеральной стороне через 1 ч после нало- |
При этом отмечалась отчетливая корреляция между уве- |
жения жгута выявлено уменьшение амплитуды М-ответа |
личением длительности М-ответа и снижением скорости |
(от 376,0±46,5 до 259,0±36,2 мкВ; р<0,001). В дальнейшем |
невральной проводимости исследуемого нервного ствола, |
эта величина была достаточно стабильной и соответство- |
что свидетельствует о сочетанном поражении быстро- и |
вала исходному уровню, что косвенно свидетельствует о |
медленнопроводящих аксонов при их компрессионно- |
сегментарном торможении активности ДЕ или даже их |
ишемическом повреждении. Остаточный эффект жгуто- |
«функциональном выключении». Тем не менее при нало- |
вого влияния на нерв является косвенным признаком |
жении и снятии жгута амплитуда М-ответа на контроль- |
сформировавшегося в результате даже кратковременного |
ной лапе всегда была больше, чем на экспериментальной. |
воздействия патоморфологического дефекта нервных во- |
Латентный период М-ответа, характеризующий мак- |
локон либо по типу невроапраксии, либо по типу аксо- |
симальную проводимость по нервным волокнам, после |
нотмезиса. |
наложения и снятия жгута на лапу, также как и амплитуд- |
Амплитуда М-ответа, отражающая количество и син- |
ные параметры, менялся на стороне повреждения доста- |
хронность активации двигательных единиц (ДЕ) мышцы, |
точно отчетливо. Через 30 мин после наложения жгута |
также подвергалась значительной динамике при наложе- |
М-ответ регистрировался позже (р<0,01), и в дальнейшем, |
нии жгута на лапу экспериментального животного и его |
после снятия жгута, можно было отметить лишь тенден- |
снятии. На экспериментальной лапе амплитуда М-ответа |
цию к нормализации этой величины. Данное обстоятель- |
уменьшилась более чем в 4 раза (от 381,0±47,4 до 80,0±28,7 |
ство свидетельствует, во-первых, о снижении скорости |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 8, 2010 |
43 |
ЭКСПЕРИМЕНТАЛЬНО-ТЕОРЕТИЧЕСКИЕ ВОПРОСЫ |
|
|||
невральной проводимости по быстропроводящим миели- |
Через 1,5 ч после наложения жгута на лапу кролика |
|||
низированным |
аксонам |
при |
компрессионно- |
скрытое время регистрации раннего компонента ВПСМ |
ишемическом повреждении нерва; во-вторых, о неполной |
(Р10) возросло (р<0,05), оставаясь постоянным до 1,5 ч |
|||
обратимости данного поражения. Важно отметить, что |
после снятия жгута. Затем отмечено его уменьшение до |
|||
наложение жгута не отразилось на продолжительности |
исходной величины. В контрольной лапе латентное время |
|||
скрытого периода регистрации ВП икроножной мышцы |
компонента Р10, было, в основном, стабильно; выявлено |
|||
контралатеральной конечности (р>0,05). |
|
его увеличение лишь через 1 ч после наложения жгута |
||
При исследовании динамики ВПСМ после наложе- |
(р<0,05). Через 1,5—2 ч после наложения жгута, при его |
|||
ния и снятия жгута на заднюю лапу кролика обращали |
снятии и через 30 мин после снятия при стимуляции не- |
|||
внимание на форму, продолжительность ВП, латентные |
рва экспериментальной лапы скрытое время регистрации |
|||
периоды и амплитуду раннего (Р10) и позднего (N20) ком- |
компонента Р10 было больше, чем контрольной лапы |
|||
понентов. |
|
|
|
(р<0,05), что отражает торможение афферентной импуль- |
Форма ВПСМ в результате наложения жгута на за- |
сации. |
|||
днюю лапу кролика менялась значительно (рис. 2). Уже |
Амплитуда Р10 претерпевала динамику, аналогичную |
|||
через 30 мин после наложения жгута регистрировали |
изменению латентного периода. Уменьшение ее при сти- |
|||
асимметричные кривые. Через 1 ч при стимуляции седа- |
муляции седалищного нерва экспериментальной лапы |
|||
лищного нерва экспериментальной лапы амплитудные |
было зарегистрировано через 1 ч после наложения жгута |
|||
параметры всех компонентов ВП уменьшались, было уве- |
(от 52,0±6,6 до 29,0±2,8 мкВ; р<0,05). Восстановление ам- |
|||
личенным время регистрации Р10 и N20. После снятия |
плитуды Р10 выявлено через 30 мин после снятия жгута |
|||
жгута амплитудные и временные параметры Р10 и N20 по- |
(42,0±5,1 мкВ; р>0,005), что свидетельствует о восстанов- |
|||
степенно (в течение 2 ч) восстанавливались, но исходного |
лении постсинаптической активности дорзальных рогов |
|||
уровня не достигали вследствие относительно стойкого |
СМ. Различия в амплитудных параметрах раннего компо- |
|||
диашиза в спинном мозге. |
|
|
нента ВПСМ (Р10) при стимуляции седалищного нерва |
|
В течение 4 ч после наложения и снятия жгута дли- |
было статистически значимо через 1, 1,5 и 2 ч после на- |
|||
тельность ВПСМ достоверно не менялась при стимуля- |
ложения, сразу после снятия и через 30 минут после сня- |
|||
ции седалищных нервов с двух сторон. Через 30 мин после |
тия жгута. |
|||
наложения жгута и до его снятия продолжительность |
Изменения амплитудно-временных параметров позд- |
|||
ВПСМ на стимуляцию седалищного нерва эксперимен- |
него компонента ВПСМ (N20) были выражены менее от- |
|||
тальной лапы была меньше, чем контрольной. |
четливо, чем Р10. Так, удлинение латентного периода |
|||
|
|
|
|
|
|
|
|
|
|
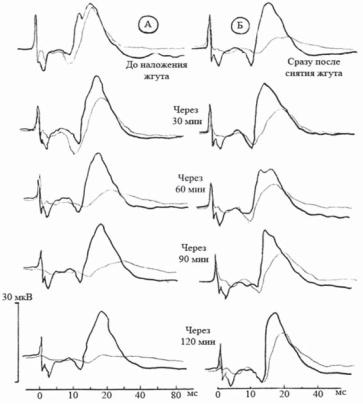
Рис. 2. Изменение формы ВПСМ после наложения (А) и снятия (Б) жгута на заднюю лапу кролика.
Тонкая линия — при стимуляции седалищного нерва экспериментальной лапы, толстая линия — контралатеральной лапы. Объяснения в тексте.
44 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 8, 2010 |
КОМПРЕССИОННО-ИШЕМИЧЕСКИЕ НЕВРОПАТИИ
компонента N20 ВПСМ при стимуляции седалищного нерва экспериментальной лапы 6ыло зарегистрировано через 1,5 и 2 ч после наложения жгута на лапу, а также сразу после снятия жгута (р<0,05). Уже через 30 мин после снятия жгута различие по сравнению с исходным уровнем было статистически незначимым. Через 2 ч после наложения жгута имело место достоверное различие величин латентных периодов для контрольной и экспериментальной лап (р<0,05).
Амплитуда N20 при наложении и снятии жгута подвергалась изменениям, аналогичным динамике латентного периода. Резкое достоверное (р<0,05) уменьшение амплитуды при стимуляции седалищного нерва экспериментальной лапы зарегистрировано через 1,5 и 2 ч после наложения жгута на лапу (от 46,0±5,4 до 15,0±2,5 и 18,0±2,1 мкВ соответственно) и особенно сразу после снятия жгута (до 12,0±1,9 мкВ). Различие в показателях амплитуды компонента N20 ВПСМ при стимуляции седалищных нервов контрольной и экспериментальной лап было достоверно через 1 ч после наложения жгута и дальше на весь период исследования, что отражало торможение афферентной импульсации на уровне спинного мозга.
Анализировали изменение формы, амплитуды и латентных периодов ряда компонентов ВПГМ: PN 7,8; PN 13; PN 20. Форма ВПГМ в результате экспериментальных
исследований подвергалась существенным изменениям (рис. 3 и 4), что отражало реактивные нейродинамические процессы в надсегментарных структурах. Так, через 30 мин после наложения жгута на лапу кролика можно было отметить уменьшение амплитуды и удлинение латентных периодов основных компонентов ВПГМ. В дальнейшем амплитудно-временные параметры ВПГМ были стабильно изменены. Через 30 мин после снятия жгута отмечалась тенденция к восстановлению ВП. Амплитуда всех компонентов ВПГМ, как правило, нормализовалась в течение первого часа. Латентные периоды в большинстве наблюдений восстанавливались к концу обследования (через 1,5—2 ч после снятия жгута).
При статистическом анализе амплитудно-временных параметров РN7 ВПГМ выявлены некоторые особенности. Так, латентный период компонента PN7 ВПГМ при стимуляции седалищного нерва экспериментальной лапы увеличивался через1 ч после наложения жгута (от 7,2±0,44 до 8,8±0,18 мс; р<0,01), был максимальным через 1,5 ч (10,3±0,71 мс; р<0,001), несколько уменьшался через 2 ч (8,8±0,44 мс; р<0,05) и восстанавливался до нормальных величин сразу после снятия жгута (7,9±0,6 мс). Величина латентного периода компонента PN7 ВПГМ при стимуляции седалищного нерва контрольной лапы была без динамики в течение всего опыта.
По-иному изменялись показатели амплитуды ВПГМ. При стимуляции седалищного нерва экспериментальной лапы достоверное, выраженное уменьшение амплитуды РN7 отмечалось только через 2 ч после наложения жгута (р<0,01). Сразу после снятия жгута и в дальнейшем величина ВПГМ не отличалась от исходной. Интересным и необычным было изменение амплитуды РN7 ВПГМ при
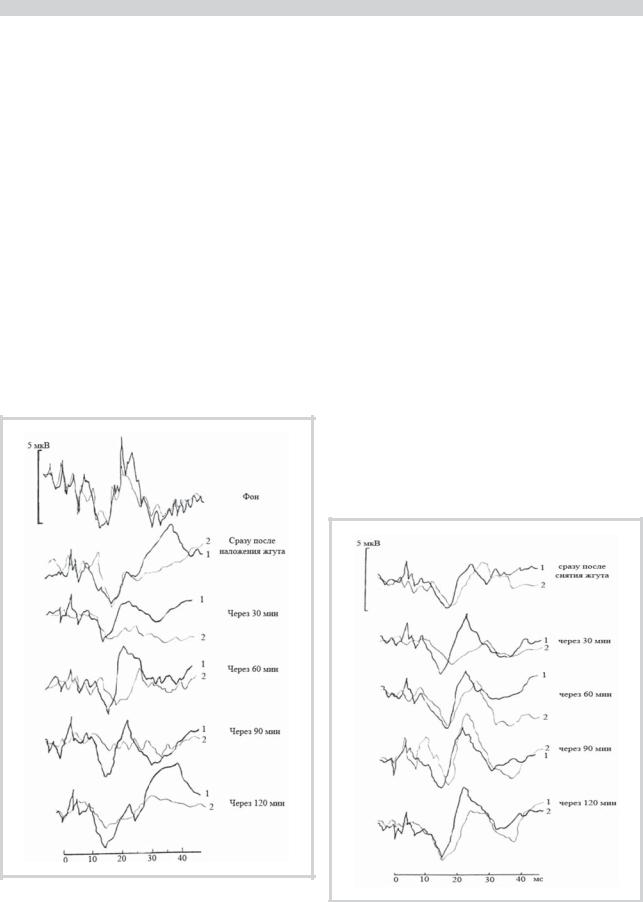
Рис. 3. Изменение формы ВПГМ при стимуляции седалищного нерва после наложения жгута на заднюю лапу кролика.
Здесь и на рис. 4—6: толстая линия (1) — при стимуляции седалищного нерва экспериментальной лапы, тонкая линия (2) — контралатеральной лапы. Объяснения в тексте.
Рис. 4. Изменение формы ВПГМ при стимуляции седалищного нерва после снятия жгута.
Обозначения (см. рис. 3). Объяснения в тексте.
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 8, 2010 |
45 |
ЭКСПЕРИМЕНТАЛЬНО-ТЕОРЕТИЧЕСКИЕ ВОПРОСЫ |
|
|
раздражении седалищного нерва контрольной лапы — че- |
латерального седалищного нерва (от 6,3±0,93 до 4,8±1,08 |
|
рез 30 мин после наложения жгута на контралатеральную |
мкВ). |
|
лапу в течение 2 ч обнаружено уменьшение амплитуды |
Таким образом, данные ЭНМГ свидетельствуют о по- |
|
компонента РN7 ВПГМ (р<0,001). Это, на наш взгляд, |
степенном формировании частично обратимого блока |
|
может быть объяснено иррадиацией торможения в ЦНС |
проводимости возбуждения по нерву при его острой ком- |
|
вследствие болевого раздражения экспериментальной ла- |
прессии, а также об угнетении рефлекторной возбудимо- |
|
пы. Сразу после снятия жгута амплитуда РN7 при раздра- |
сти сегментарного аппарата спинного мозга и соответ- |
|
жении седалищного нерва контрольной лапы восстанав- |
ствующих проекционных зон коры головного мозга, при- |
|
ливалась до исходных величин. |
чем изменения центральной проводимости наблюдались |
|
Увеличение скрытого времени компонента РN13 |
в меньшей степени и на контралатеральной конечности. |
|
ВПГМ имело место через 30 мин после наложения жгута |
После проведения электрофизиологических исследо- |
|
(от 12,7±1,34 до 13,1±0,81 мс; р<0,05) и сохранялось в те- |
ваний для изучения гистологических изменений в различ- |
|
чение 60 мин после его снятия (16,2±0,66 мс; р<0,05). Раз- |
ных отделах нервной системы животные забивались c по- |
|
личие было также статистически значимым по сравнению |
мощью воздушной эмболии. При электронномикроско- |
|
с латентным периодом компонента РN13 ВПГМ при сти- |
пическом исследовании материала обнаружены следую- |
|
муляции седалищного нерва контрольной лапы. Харак- |
щие изменения. На уровне наложения жгута наблюдались |
|
терно, что при сравнении динамики компонента РN13 |
нервные волокна с преимущественным нарушением |
|
зарегистрированного на уровне головы кролика, и компо- |
структуры миелиновых оболочек в виде их разрыхлений и |
|
нента Р10 ВПСМ, отведенного от поясничного отдела |
расслаивания. Уцелевшие миелиновые волокна были ис- |
|
спинного мозга, можно было отметить однотипные изме- |
тончены, отчего количество толстых волокон в нервных |
|
нения (удлинение) латентных периодов. Как известно, |
пучках было уменьшено; наряду с истончением отмеча- |
|
PN13 ВПГМ и Р10 ВПСМ отражают состояние спинного |
лась неравномерность калибра многих волокон (тяжелые |
|
мозга, и поэтому удлинение латентных периодов этих |
периаксональные изменения). Кроме этого обнаружены |
|
компонентов расценивалось нами как проявление фор- |
умеренные деструктивные изменения аксонов: дегидрата- |
|
мирования диашиза в сегментарном аппарате мозга при |
ция аксоплазмы, содержащей густоупакованные нейро- |
|
наложении жгута на заднюю лапу кролика и компрессии |
филаменты и вакуолизированные митохондрии (рис. 5 и 6). |
|
седалищного нерва. |
Выше наложения жгута обнаружены незначительные из- |
|
Динамика амплитуды РN13 ВПГМ была такая же, как |
менения миелиновых оболочек (небольшое разрыхление |
|
и амплитуды компонента Р10 ВПСМ. Уменьшение ам- |
и искривление миелина во внутренней части миелиновой |
|
плитуды компонента РN13 при стимуляции седалищного |
оболочки) и обеднение цитоплазмы леммоцитов (см. рис. |
|
нерва экспериментальной лапы имело место уже через 30 |
5 и 6). |
|
мин после наложения жгута (от 2,8±0,19 до 1,9±0,12 мкВ; |
При исследовании нерва ниже наложения жгута об- |
|
р<0,05). Через 1, 1,5 и 2 ч регистрировались крайне малые |
наружены наиболее выраженные и тяжелые изменения |
|
по амплитуде потенциалы компонента РN7 ВПГМ |
нервных волокон. Миелиновые оболочки оказались по- |
|
(1,2±0,08, |
1,3±0,10, 1,4±0,15 мкВ соответственно; |
вреждены наиболее существенно: наблюдалось значи- |
р<0,001). Сразу после снятия жгута амплитуда РN13 не- |
тельное разрыхление и дезинтеграция миелиновых пла- |
|
сколько увеличивалась (1,9±0,14 мкВ; р<0,05), а через 30 |
стин с образованием в некоторых волокнах крупных ва- |
|
мин отмечено ее полное восстановление (2,2±0,19 мкВ). |
куолей (см. рис. 5 и 6). Кроме того, обнаружена деструк- |
|
Различие амплитуды компонента РN13 ВПГМ при стиму- |
ция отдельных аксонов от незначительной деформации |
|
ляции седалищного нерва экспериментальной и кон- |
до полной гибели (в поздние сроки после компрессии). |
|
трольной лап было достоверным через 1,5 и 2 ч после на- |
Обращает на себя внимание резкая гиперплазия и гипер- |
|
ложения жгута. |
трофия фибробластов. В нервных стволах отмечено уве- |
|
При раздражении седалищного нерва эксперимен- |
личение количества клеточных элементов как внутри |
|
тальной лапы через 1 ч после наложения жгута удлинялся |
нервных пучков, так и вне их. Клеточные тела деформи- |
|
латентный |
период вызова компонента РN20 ВПГМ |
рованы и часто грубо вакуолизированы, т.е. имеются ти- |
(р<0,005). Величина скрытого периода регистрации РN20 |
пичные явления некроза. В нервных пучках также можно |
|
нормализовалась сразу после снятия жгута, однако затем, |
было видеть гиперплазию леммоцитов. |
|
через 1 ч, отмечалось повторное удлинение латентного пе- |
Таким образом, при проведении электронно- |
|
риода этого компонента (р<0,05). При электрическом раз- |
микроскопических исследований обнаружены признаки |
|
дражении седалищного нерва контрольной лапы через 30 |
демиелинизирующего (периаксонального) и аксонально- |
|
мин после наложения жгута время регистрации РN20 |
осевого типов поражения седалищного нерва на стороне |
|
уменьшалось (р<0,05), а через 1,5 ч восстанавливалось до |
наложения жгута. Максимум изменений наблюдался на |
|
исходной величины, в дальнейшем оставаясь без суще- |
уровне наложения жгута и ниже. Демиелинизация прояв- |
|
ственной динамики. |
лялась в форме деформаций и разрыхлений миелиновых |
|
Амплитуда компонента РN20 ВПГМ до наложения |
оболочек различной степени выраженности, нарушений |
|
жгута составила 6,5±0,87 мкВ, а после — резко снизилась, |
миелино-аксоплазматических взаимоотношений. |
|
при этом наименьшее ее значение на экспериментальной |
Кроме того, наблюдались патоморфологические |
|
лапе было через 1,5 и 2 ч после наложения жгута (4,1± 0,81 |
сдвиги в некоторых структурах центральной нервной си- |
|
и 4,3±0,36 мкВ соответственно; р<0,05). Восстановление |
стемы. Так, обнаружены дегенеративные изменения про- |
|
амплитудных параметров отмечено сразу после снятия |
водящих путей на уровне спинного и продолговатого моз- |
|
жгута. При раздражении седалищного нерва контрольной |
га. На рис. 7 представлены нервные волокна на уровне |
|
лапы можно было отметить лишь тенденцию к уменьше- |
спинного мозга: наблюдаются дегидратированные и де- |
|
нию амплитуды РN20 через 2 ч после компрессии контра- |
формированные аксоны с плотноупакованными нейро- |
|
46 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 8, 2010 |

КОМПРЕССИОННО-ИШЕМИЧЕСКИЕ НЕВРОПАТИИ
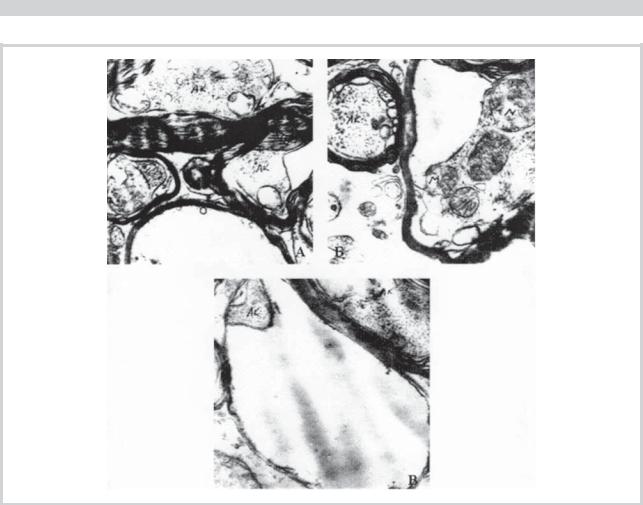
Рис. 5. Электронограммы срезов седалищного нерва кролика через 1 сут: выше (А), на уровне (Б) и ниже (В) места наложения жгута.
АК — аксон, Лем — леммоцит, ВАК — вакуоль, МН — миелин. × 6600 (А); 13 000 (Б); 16 000 (В). Объяснения в тексте.
Рис. 6. Электронограммы срезов седалищного нерва кролика через 8 сут: выше (А), на уровне (Б) и ниже (В) места наложения жгута.
Стрелкой указано появление электроннопрозрачных и электронноплотных вздутий миелиновых ламелл на уровне наложения жгута. ×13 000 (А); 20 000 (Б, В). Объяснения в тексте.
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 8, 2010 |
47 |
ЭКСПЕРИМЕНТАЛЬНО-ТЕОРЕТИЧЕСКИЕ ВОПРОСЫ
Рис. 7. Электронограммы среза вентрального отдела продолговатого мозга кролика через 8 сут после наложения жгута на заднюю лапу.
АК — аксон, М — митохондрия. На снимках представлены Мнв на разных стадиях дегенерации. × 16 000 (А); 20 000 (Б); 26 000 (В).
филаментами и микротрубочками. В аксоплазме обнаруживаются гипертрофированные, набухшие митохондрии с резко выраженной дезинтеграцией и исчезновением крист. Периаксональные изменения проявляются в незначительном разрыхлении миелина. На уровне продолговатого мозга выявляются нервные волокна, находящиеся на разных стадиях дегенерации. Наблюдается разрыхление, искривление миелина с образованием везикул или вакуолей. Встречаются резко истонченные миелиновые пластинки. Аксоны деформированы, в аксоплазме наблюдаются набухшие митохондрии с измененной конфигурацией, с исчезновением или дезинтеграцией крист. Реже встречаются погибшие нервные волокна с истонченной миелиновой оболочкой и исчезновением аксоплазмы.
Обнаруженные изменения свидетельствуют о трансганглионарной дегенерации проводящих путей, возникающей как реакция на аксонотомию, что лежит в основе ретроградных изменений нервной системы, описанных при травматических поражениях ПНС [3, 5, 7]. Данные патоморфологические сдвиги объясняют обнаруженные нами нейрофизиологические феномены (обратимый многоуровневый диашиз).
Исследование больных
В ходе проведения нейрофизиологического исследования здоровых и пациентов с компрессионно-
ишемическими невропатиями было выявлено, что параметры исследуемых компонентов у здоровых лиц были в пределах нормы, тогда как у больных они достоверно отличались от нормативных показателей в зависимости от тяжести и локализации повреждения нерва.
Межпиковые интервалы считаются более надежным показателем, чем абсолютные значения латентностей, поскольку не зависят от длины конечностей. Межпиковый интервал N9 — N13 отражает время проведения стимула между плечевым сплетением и дорзальными рогами спинного мозга, а интервал N9 — N20 — время проведения стимула между плечевым сплетением и первичной соматосенсорной корой.
Увеличение межпиковой латентности больше, чем на 2,5 сигмы по сравнению с нормой, может рассматриваться как патологическое и отражает торможение афферентной импульсации между соответствующими структурами нервной системы, являясь нейрофизиологическим маркером диашиза надсегментарного уровня. Наиболее важное диагностическое значение имеют межпиковый интервал N13 — N20, отражающий время проведения стимула между дорзальными рогами спинного мозга и первичной соматосенсорной корой (время центрального проведения), и амплитуда коркового ответа (N20 — P25).
При повреждениях нервов по типу невроапраксии отмечалась умеренная дисфункция проводящих путей на
48 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 8, 2010 |

уровне «плечевое сплетение — шейное утолщение спинного мозга» (5 больных) и на уровне «поясничнокрестцовое сплетение — поясничное утолщение спинного мозга» (2 больных), выражавшаяся в увеличении латентного периода и межпиковых интервалов (параметры N9, N9—13, N22, N22—30).
Повреждения нервов по типу аксонотмезиса характеризовались выраженной дисфункцией проводящих путей на тех же участках (соответственно 2 пациента и 1 больной): увеличение латентного периода и межпиковых интервалов при одновременном снижении амплитуды изучаемых ВП.
После введения нейромидина (ипидакрин АО «OlainFarm») в двух группах отмечалось статистически достоверное изменение всех исследуемых параметров: уменьшение латентного периода, межпиковых интервалов, увеличение амплитуды потенциалов, наиболее выраженное на 40-й минуте эксперимента. Данные изменения сохранялись в течение 2—3 ч (см. таблицу).
Обсуждение
В результате экспериментальных исследований обнаружена генерализованная реакция нервной системы на острую компрессию конечности со сдавлением седалищного нерва. Удалось показать прямое механическое действие жгута на нервный ствол в месте перетяжки, которое приводит к локальной демиелинизации и аксонотмезису части нервных волокон, что было основной причиной формирования блока невральной проводимости возбуждения. Травма нерва у экспериментальных животных являлась триггером различных гистофизиологических процессов, которые влияли на центральные отделы нервной системы и приводили к выраженным в той или иной степени структурным преобразованиям, сочетавшимся со значительными функционально-динамическими нарушениями по типу обратимого диашиза.
Несмотря на наличие отчетливых признаков демиелинизирующего (периаксонального) и аксональноосевого типов поражения, а также гибели части нервных волокон, что было выявлено по результатам гистологического исследования поврежденного нервного волокна, через 30 мин после снятия жгута на стороне повреждения происходило значительное восстановление амплитуды суммарного М-ответа, которая оставалась в дальнейшем постоянной. Характерны изменения ВПСМ — уже через несколько минут после наложения жгута на стороне повреждения регистрировались асимметричные кривые
КОМПРЕССИОННО-ИШЕМИЧЕСКИЕ НЕВРОПАТИИ
ВПСМ, а в дальнейшем отмечалось, с одной стороны уменьшение амплитудных параметров всех компонентов, с другой, — увеличение времени регистрации Р10 и N20. После снятия жгута амплитудные и временные параметры ВПСМ в течение 2 ч достигли исходного уровня. В динамике изменения ВПГМ прослеживались следующие особенности: через 30 мин после наложения жгута отмечалось уменьшение амплитуды и удлинение латентных периодов основных компонентов ВПГМ, которые в дальнейшем были стабильно изменены. Через 30 мин после снятия жгута наблюдалась тенденция к восстановлению ВП, а амплитуда и латентные периоды всех компонентов ВПГМ, как правило, нормализовались в течение первых 1,5—2 ч. Результаты исследования позволяют утверждать, что в короткое время после изменения потока афферентной информации, сигнализирующей о значимых модификациях состояния рецепторного аппарата на периферии, происходит активизация процесса реорганизации соответствующих нейрональных сетей, первично, по всей вероятности — на уровне спинного мозга, происходящая по двум основным механизмам. Одним из них является изменение баланса тормозных и активизирующих связей на уровне заинтересованного сегмента спинного мозга, что происходит за счет высвобождения нейротрансмиттеров, модуляции мембранной проводимости и увеличения плотности постсинаптических рецепторов [11]. Второй механизм включает усиление или ослабление синаптических связей за счет долговременной потенциации и депрессии, основанных на активизации NMDA-рецепторов и повышении концентрации внутриклеточного кальция, что приводит к значимым изменениям синаптической активности в короткий срок и на длительное время [12]. В результате, с одной стороны, происходит повышение эффективности функционирования «активных» нейрональных сетей, а с другой — включение в работу «молчащих» ансамблей нейронов. Полученные нами экспериментальные данные подтверждают развитие при компрессионно-ишеми- ческих невропатиях феномена диашиза (транссинаптического функционального торможения, локализованного гетеротопично от очага повреждения и формирующегося вследствие нарушения модулирующего влияния различных нейротрансмиттерных систем), имеющего, как известно, прогностически неблагоприятное значение [10]. Скорейшее разрешение этого состояния является одним из ключевых этапов стимуляции нейропластичности структур центральной и периферической нервной систем и, как результат, восстановления утраченных функций. В нашем случае компрессионное воздействие на седалищ-
Параметры ССВП при стимуляции лучевого и малоберцового нервов до (фоновые показатели ССВП) и на 40-й минуте после введения нейромидина
|
Компо- |
|
|
|
Параметры ССВП |
|
|
|
||
Точка приложения |
|
Латентность, мс |
|
|
Амплитуда, мкВ |
|
||||
нент |
|
|
|
|
||||||
электродов |
здоровые |
больные |
здоровые |
больные |
||||||
ССВП |
||||||||||
|
до |
после |
до |
после |
до |
после |
до |
после |
||
|
|
|||||||||
эрба |
N9 |
9,5±0,7 |
7,2±0,9 |
13,2±1,1 |
10,1±1,0 |
5,5±2,5 |
9,3±2,2 |
2,1±1,0 |
3,4±1,9 |
|
шейный отдел |
N13 |
13,1±0,8 |
9,8±0,6 |
16,5±1,0 |
14,2±1,1 |
2,9±1,3 |
5,2±1,4 |
1,1±0,4 |
2,2±1,3 |
|
кора |
N20 |
18,9±1,0 |
13,8±0,8 |
22,8±1,2 |
20,1±1,3 |
2,7±1,6 |
4,9±1,8 |
1,3±0,4 |
2,3±1,1 |
|
поясничный отдел |
N22 |
22,3±2,2 |
19,4±2,4 |
27,6±2,4 |
25,3±2,5 |
1,1±0,3 |
2,3±0,7 |
0,6±0,2 |
0,9±0,2 |
|
шейный отдел |
N30 |
29,7±2,8 |
24,7±2,7 |
36,1±2,7 |
33,4±3,0 |
0,9±0,3 |
1,2±0,4 |
0,3±0,1 |
0,5±0,2 |
|
кора |
Р38 |
38,4±3,3 |
31,5±3,5 |
48,3±3,6 |
45,5±3,7 |
2,7±1,1 |
5,4±2,1 |
1,0±0,4 |
1,8±0,6 |
|
|
N46 |
46,5±3,2 |
40,2±3,6 |
59,3±3,7 |
55,7±3,9 |
2,3±1,3 |
4,7±2,1 |
0,9±0,2 |
1,1±0,4 |
|
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 8, 2010 |
49 |

ЭКСПЕРИМЕНТАЛЬНО-ТЕОРЕТИЧЕСКИЕ ВОПРОСЫ
ный нерв кролика было кратковременным, однако уже этого срока было достаточно для развития диашиза в структурах сегментарного аппарата спинного мозга и в соответствующих им центральных проекционных зонах коры головного мозга. В случаях длительно текущих компрессионно-ишемических поражений периферических нервов, например, у пациентов с туннельными невропатиями, мы вправе ожидать стойкого диашиза, в значительной мере ухудшающего восстановление утраченных функций и увеличивающего сроки лечения таких больных.
Таким образом, клинические и морфологические исследования экспериментальных животных выявили высокую корреляцию клинического и нейрогистологического паттерна компрессионного повреждения нерва. Полученные данные позволяют предположить необходимость поиска и применения в лечении пациентов с гетерогенными травматическими невропатиями потенциально новых групп препаратов, позволяющих не только восстанавливать проводимость возбуждения в поврежденных периферических нервах, но также и улучшать трансмиссию нервных импульсов в соответствующих структурах сегментарного звена нейромоторного аппарата и выше, вплоть до центральных проекционных зон коры головного мозга.
В свете вышеизложенного среди множества препаратов, используемых для стимуляции спрутинга и регенерации периферических нервов при их повреждениях, особое место занимает препарат нейромидин, в основе действия которого лежит ингибирование ацетилхолинэстеразы, а также блокада калиевых и натриевых каналов мембраны. В ходе ряда исследований были выдвинуты предположения о, возможно, значимом влиянии нейромидина на улучшение периферической и центральной проводимости
возбуждения, лежащей в основе стимуляции нейропластичности при различных заболеваниях и травмах нервной системы [8].
Полученные во второй, клинической, части исследования данные полностью подтверждают положительное влияние нейромидина на проводящие пути комплекса «сплетение-головной мозг». Анализ результатов исследования центральной проводимости и возбудимости продемонстрировал отчетливую положительную динамику в разрешении явления диашиза у пациентов с компрессионно-ишемическими невропатиями после введения нейромидина, достоверно отличающуюся от таковой у пациентов контрольной группы. Данный эффект может быть объяснен восстановлением проведения по поврежденным и активизацией передачи импульсов по сохранным волокнам, а также вовлечением резервных синаптических образований «нервной сети».
На основании вышеизложенных данных становится очевидно, что использование традиционных препаратов, таких как прозерин, в качестве основных средств восстановления невральной проводимости существенно ограничивает возможности консервативной терапии, поскольку последние оказывают влияние исключительно на периферическое звено нейромоторного аппарата. Использование же препарата нейромидин с двойным эффектом (центральным и периферическим) позволяет с одной стороны восстановить активность периферической части нейромоторного аппарата, а с другой — купировать явление распространенного диашиза. Тем не менее необходимы дальнейшие клинические и экспериментальные исследования для уточнения наиболее оптимальных схем применения нейромидина при гетерогенных травмах ПНС.
ЛИТЕРАТУРА
1.Агасаров Л.Г., Чузавкова Е.А. Туннельные синдромы: клинико- 7. Живолупов С.А., Рашидов Н.А., Самарцев И.Н., Цыба В.В. Убиквитар-
патологическая характеристика, диагностика и лечение (обзор). Рос мед журн 1999; 3: 49—53.
2.Акимов Г.А., Семенова-Тян-Шанская В.В. Исследование патоморфологических изменений в нервной системе по методу Б.С. Дойникова. Арх патол 1953; 15: 5: 82—86.
3.Акимов Г.А., Одинак М.М., Живолупов С.А. и др. Современные представления о патогенезе, диагностике и лечении травматических поражений нервных стволов конечностей (обзор). Журн невропатол и психиат 1989; 89: 5: 126—132.
4.Григорьев С.Г., Перфилов А.М., Левандовский В.В., Юнкеров В.И. Пакет прикладных программ STATGRAPHICS на персональном компьютере практ. пособие по обраб. результатов мед.-биол. исслед. СтПетербург: БИ 1992; 104.
5.Живолупов С.А. Травматические невропатии и плексопатии (патогенез, клиника, диагностика и лечение): Автореф. дис. … д-ра мед. наук. Ст-Петербург 2000; 43.
6.Живолупов С.А. Клиническая электронейромиография. Учебное пособие. Ст-Петербург: ВМА 2007; 152.
ные пластические изменения нервной системы при острой компрессии седалищного нерва (экспериментальное исследование). Вестн Рос ВМА 2009; 1: 52: 549.
8.Катунина Е.А. Применение ипидакрина в восстановительном периоде ишемического инсульта. Рус мед журн 2008; 16: 12: 1633—1638.
9.Одинак М.М., Живолупов С.А. Заболевания и травмы периферической нервной системы (обобщение клинического и экспериментального опыта). Ст-Петербург: СпецЛит 2009; 367.
10.Butefisch C.M., Netz J., Webling M. et al. Remote changes in cortical excitability after stroke. Brain 2003; 126: 470—481.
11.Chen R., Cohen G. Nervous system reorganization following injury. Neuroscience 2002; 111: 4: 761—773.
12.Li C.Y., Song Y.H., Higuera E.S. et. al. Spinal dorsal horn calcium channel alpha2delta-1 subunit upregulation contribute. J Neurosci 2004; 24: 8494— 8499.
50 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 8, 2010 |
