
Журнал неврологии и психиатрии / 2010 / NEV_2010_09_076
.pdf
ОБЗОРЫ
Использование ривастигмина при деменциях: от симптоматического эффекта к нейропротекции
Д.м.н., проф. И.В. ДАМУЛИН
Rivastigmine in the treatment of dementia: from the symptomatic effect to neuroprotection
I.V. DAMULIN
Кафедра нервных болезней Московской медицинской академии им. И.М. Сеченова
Ключевые слова: деменция, умеренные когнитивные расстройства, лечение, ривастигмин.
Key words: dementia, mild cognitive impairment, treatment, rivastigmine.
Проблема деменций в настоящее время является весьма актуальной, что в значительной мере определяется существующей тенденцией к постарению населения. Одной из наиболее частых причин деменции является болезнь Альцгеймера (БА). Это заболевание, относящееся к первично-дегенеративным деменциям, характеризуется прогрессирующим снижением когнитивных функций, в первую очередь памяти, и развитием поведенческих расстройств. Предполагается, что всего в мире около 24 млн пациентов с БА и в течение ближайших 3—4 десятилетий их количество увеличится втрое [10]. Однако деменции — это не только важная медицинская проблема, но и тяжелое социально-экономическое бремя как для самого больного, так и для ухаживающих за ним лиц, членов семьи и общества в целом. В частности, БА является одной из ведущих причин инвалидности в высокоразвитых странах, а уход за пациентом, страдающим БА, резко снижает качество жизни самих ухаживающих лиц.
Коррекция холинергического дефицита в лечении деменций
Для лечения БА в настоящее время широко используются центральные ингибиторы ацетилхолинэстеразы, которые рассматриваются как средства первой линии терапии [23, 53]. Улучшение в состоянии больных на фоне назначения препаратов этой группы отмечается в 40—80% случаев [12, 32]. Основанием для их применения при БА является наличие центрального ацетилхолинергического дефицита, являющегося одним из ключевых патогенетических механизмов этого заболевания. При этом имеется соответствие между тяжестью деменции и центральным холинергическим дефицитом. Степень холинергического дефицита в корковых отделах тесно связана с уменьшением количества нейронов в базальных отделах головного мозга, особенно в области базального ядра Мейнерта, где располагаются нейроны, продуцирующие ацетилхолин. Помимо этого в коре мозга уменьшается количество холинергических рецепторов.
Ацетилхолин образуется в пресинаптических терминалях под действием ацетилхолинтрансферазы, затем накапливается в везикулах, в которых он и транспортируется к пресинаптической мембране. После выделения ацетилхолина в синаптическую щель он воздействует на постсинаптические холинергические рецепторы. Разрушение ацетилхолина происходит под действием фермента ацетилхолинэстеразы, присутствующей как в области пресинаптической, так и постсинаптической мембраны.
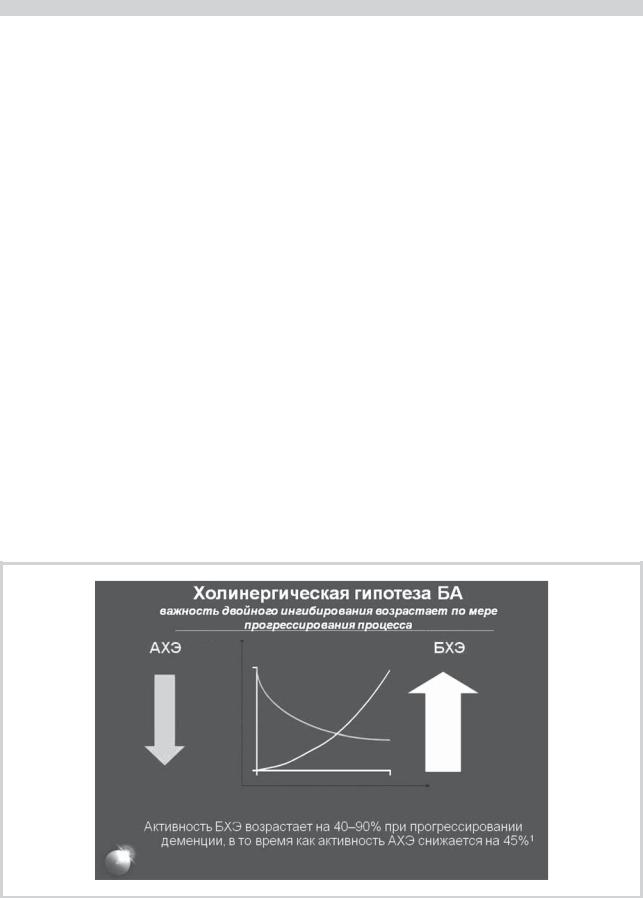
В настоящее время показано, что помимо ацетилхолинэстеразы регуляция уровня ацетилхолина в головном мозге осуществляется еще одним ферментом — бутирилхолинэстеразой [10, 25, 47]. Поэтому следует ожидать большего эффекта от препаратов, обладающих двойным действием, т.е. способных ингибировать и ацетилхолинэстеразу, и бутирилхолинэстеразу. Бутирилхолинэстераза выявлена в сенильных бляшках, фибриллярных клубочках и в стенке сосудов (при амилоидной ангиопатии). Считается, что этот фермент участвует в образовании сенильных бляшек [10]. Предполагается, что активность бутирилхолинэстеразы наиболее выражена в подкорковом белом веществе головного мозга и увеличение активности данного фермента в этих зонах объясняет нарастание выраженности церебральной атрофии и размеров желудочковой системы головного мозга при прогрессировании когнитивных нарушений у больных деменцией. Следует заметить, что наиболее значительное увеличение активности бутирилхолинэстеразы при старении отмечается в тех зонах белого вещества, миелинизация которых при нормальном развитии ребенка наступает в более позднем периоде, в частности в энторинальных отделах [53].
Результаты экспериментальных и клинических исследований свидетельствуют о том, что ингибирование бутирилхолинэстеразы сопровождается улучшением способности к обучению, памяти и зрительно-пространст- венных функций [10]. Было показано, что по мере прогрессирования БА активность ацетилхолинэстеразы в определенных участках головного мозга снижается, а ак-
© И.В. Дамулин, 2010 |
Тел.: (499) 248-63-73 |
Zh Nevrol Psikhiatr Im SS Korsakova 2010;110:9:76
76 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 9, 2010 |
РИВАСТИГМИН ПРИ ДЕМЕНЦИЯХ
тивность бутирилхолинэстеразы — повышается [10, 47] (см. рисунок). Учитывая этот факт, представляется более предпочтительным назначение препаратов, способных ингибировать и ацетилхолинэстеразу, и бутирилхолинэстеразу, — ингибирование только ацетилхолинэстеразы может быть недостаточным для достижения необходимого терапевтического эффекта. Именно таким препаратом двойного механизма действия и является ривастигмин.
Ривастигмин (экселон, «Novartis Pharma», Швейцария) является медленнообратимым ингибитором ацетилхолинэстеразы и бутирилхолинэстеразы [10, 36], преимущественно действующим на центральном уровне [35]. Препарат используется для лечения легкой и умеренной деменции при БА и при болезни Паркинсона. На фоне его назначения в спинномозговой жидкости у пациентов с БА быстро наступает дозозависимое ингибирование уровня этих ферментов [10, 35]. При этом значимое ингибирование активности ацетилхолинэстеразы отмечается уже после разового приема 3 мг ривастигмина [35]. Препарат действует преимущественно на структуры гиппокампа, височные и лобные отделы; его влияние на церебральные структуры сохраняется до 10 ч [10].
Эффективность ривастигмина была оценена в большом числе исследований, проведенных в разных странах. На фоне терапии наиболее существенное клиническое улучшение отмечается с 12-й недели от начала приема препарата, при этом его эффективность носит дозозависимый характер. На фоне терапии у пациентов помимо улучшения в когнитивной сфере отмечается уменьшение выраженности расстройств, связанных с самообслуживанием, что имеет огромное значение для близких и родственников больных. В настоящее время показана высокая эффективность ривастигмина у пациентов, у которых течение БА осложнилось возникновением галлюцинаций [15, 16]. Важ-
но заметить, что эффективность ривастигмина сохраняется в течение длительного времени [10, 20, 24].
Препарат характеризуется селективностью действия, поскольку преимущественно ингибирует G1-изоформу ацетилхолинэстеразы (в большей степени экспрессируется в гиппокампе и коре, т.е. в областях, первично поражаемых при БА) и в меньшей степени G4-изоформу [10], что обусловливает существенное снижение вероятности развития периферических нежелательных явлений. Избирательное влияние ривастигмина на G1-изоформу ацетилхолинэстеразы, как считается, объясняет редкость возникновения экстрапирамидных побочных реакций [10]. Этим же свойством ривастигмина объясняют редкое возникновение мышечных крампи, что характерно для других ингибиторов ацетилхолинэстеразы. Следует заметить, что генез крампи на фоне терапии ингибиторами ацетилхолинэстеразы связан с действием на G2-изоформу фермента, располагающуюся преимущественно в области нервно-мышечных терминалей [10]. Селективность ривастигмина, а также двойной эффект действия делают предпочтительным его назначение не только на ранних, но и на развернутых стадиях БА [10].
Следует отметить, что использование ингибиторов ацетилхолинэстеразы в клинической практике нередко связано с развитием типичных для данного класса нежелательных явлений — головной боли, тошноте, головокружении и диареи, обусловленных холинергической активностью. Как правило, они легкие или умеренные по своей выраженности, ограничены по продолжительности и не являются жизнеугрожающими [26].
Это обусловливает необходимость разработки новых подходов, в частности внедрения новых средств доставки ингибиторов ацетилхолинэстеразы, характеризующихся отсутствием пиков концентрации, снижением частоты
Динамика активности ацетилхолинэстеразы (АХЭ) и бутирилхолинэстеразы (БХЭ) по мере прогрессирования деменции при болезни Альцгеймера (по E. Perry и соавт. [47]).
По оси абсцисс — время прогрессирования заболевания, годы; по оси ординат — активность ферментов, %.
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 9, 2010 |
77 |

ОБЗОРЫ
нежелательных явлений и, как результат, повышением эффективности за счет большей вероятности достижения оптимальной дозы.
Совсем недавно в клиническую практику внедрена новая форма ривастигмина — в виде пластыря (трансдермальная терапевтическая система) [62, 63]. Эта форма ривастигмина имеет несомненные преимущества по сравнению с обычной пероральной формой препарата, связанные с возможностью постоянного поступления ривастигмина в кровь в течение 24 ч [63]. В основном это обусловлено отсутствием колебаний концентрации препарата в сыворотке крови при его применении в виде пластыря, что приводит к уменьшению частоты возникновения побочных явлений (в 3 раза) — при высокой клинической эффективности и более значительной подверженности больных лечению. В подавляющем большинстве случаев какого-либо местного раздражающего эффекта при использовании пластыря не наблюдается [63].
Влитературе отмечается, что для ривастигмина характерно удачное сочетание хорошей эффективности и переносимости [46]. В проведенные к настоящему времени исследования включались пациенты преимущественно пожилого и старческого возраста, у которых, как правило, имеется сопутствующая соматическая патология. В связи с этим следует заметить, что для пациентов пожилого и старческого возраста весьма характерна полиморбидность — у лиц старше 65 лет в среднем имеется более 3 заболеваний, в связи с чем пожилые больные принимают более 3 лекарственных препаратов (особенно часто — сердечно-сосудистые, обезболивающие и снотворные средства).
Проведенные исследования показали, что ривастигмин хорошо переносится данной категорией больных. Его можно назначать совместно с широким кругом препаратов, которые часто применяются в нейрогериатрической практике, включая антипсихотические средства [31, 60]. Не отмечено отрицательного влияния терапии на электрокардиографические параметры [44].
Впрактической деятельности нередко возникает необходимость в переходе от одного ингибитора ацетилхолинэстеразы к другому. Подобные проблемы, связанные либо с недостаточной эффективностью препарата, либо с развитием побочных эффектов терапии, отмечаются при легкой и умеренной степени выраженности БА почти в 50% случаев [24]. Показано, что у пациентов, у которых не был отмечен положительный эффект от других центральных ингибиторов ацетилхолинэстеразы, может отмечаться улучшение на фоне назначения ривастигмина [10, 12]. Кроме того, в отличие от других ингибиторов ацетилхолинэстеразы для ривастигмина характерен низкий потенциал взаимодействия с назначаемыми по другим показаниям препаратами [56], что особенно важно для пациентов пожилого и старческого возраста.
Нейропротективный эффект ривастигмина
Результаты проведенных исследований свидетельствуют об улучшении на фоне терапии центральными ингибиторами ацетилхолинэстеразы, включая ривастигмин, не только при легкой и умеренной, но и при тяжелой деменции [23, 50, 59]. Однако подчеркивается необходимость как можно более раннего назначения этой группы препаратов, что предположительно позволяет задержать прогрессирование заболевания [20, 24]. По мнению неко-
торых авторов [40], положительная динамика в состоянии больных на фоне терапии ингибиторами ацетилхолинэстеразы проявляется не только в улучшении результатов выполнения нейропсихологических тестов, но в более медленном прогрессировании заболевания.
Весомых данных о протективном эффекте этой группы лекарственных средств при БА до недавнего времени не было, что в значительной мере могло быть обусловлено дизайном проводимых исследований, которые в большинстве случаев были непродолжительными [53]. Ситуация несколько изменилась в последнее время. Было показано, что даже после отмены ингибиторов ацетилхолинэстеразы степень прогрессирования патологического процесса снижается, а клинически это проявляется более медленным нарастанием когнитивных и поведенческих расстройств [53]. В пользу предположения о протективном эффекте ингибиторов ацетилхолинэстеразы, в частности ривастигмина, свидетельствуют результаты наблюдения за пациентами с умеренными когнитивными расстройствами (УКР), длительно — на протяжении 3—4 лет
— получающими данную терапию [53]. Следует заметить, что УКР нередко рассматриваются как продромальная стадия БА, а риск развития этого заболевания существенно выше у женщин с УКР, чем у мужчин.
Концепция УКР была предложена для обозначения додементных расстройств высших мозговых функций, обусловленных преимущественно БА [1, 49]. БА в своем развитии проходит ряд этапов, характеризующихся последовательным нарастанием симптоматики, — начиная от легких расстройств когнитивных функций, преимущественно в сфере памяти, и заканчивая грубыми нарушениями, достигающими степени деменции. Продолжительность продромальной (доклинической) стадии этого заболевания остается неизвестной, однако не вызывает сомнений, что она составляет годы. Для обозначения этого продромального периода и был предложен термин УКР. При этом отсутствует четкая граница как между нормальным старением и УКР, так и между УКР и БА (ее начальными этапами). Пациенты с УКР являются важной группой с теоретических и практических позиций. С теоретической точки зрения изучение этих расстройств позволяет приблизиться к пониманию клинических особенностей наиболее ранних проявлений деменций (в основном БА), а также важно в контексте «неврологии нормального старения». С практической точки зрения, выявление лиц, имеющих на момент осмотра негрубые когнитивные нарушения, но относящихся к группе риска последующего развития деменции, позволяет использовать те или иные терапевтические программы на самых ранних этапах заболевания. Именно у этой категории больных можно ожидать их большей эффективности. Кроме того, более обоснованным и перспективным представляется эффективность активно разрабатываемой в настоящее время нейропротективной терапии.
Распространенность УКР достигает 10% среди лиц старше 65 лет, и у 10—15% из них в течение года возникает развернутая клиническая картина БА [49, 54]. Следует с определенной осторожностью трактовать УКР как исключительно раннюю стадию БА, поскольку в их основе могут лежать и иные причины, включая депрессию, цереброваскулярные поражения, лобно-височную деменцию, болезнь диффузных телец Леви и др. В настоящее время часть случаев УКР рассматривается как предклиническая
78 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 9, 2010 |

РИВАСТИГМИН ПРИ ДЕМЕНЦИЯХ
стадия сосудистой деменции. При этом существует, по меньшей мере, 2 варианта сосудистых УКР [3, 42]. При первом из них, с выраженными диффузными изменениями белого вещества полушарий головного мозга, в клинической картине доминируют нарушения исполнительных функций, а второй связан с инфарктами и повторными эпизодами острых нарушений мозгового кровообращения и проявляется более полиморфной симптоматикой, характер которой определяется локализацией ишемического очага (очагов).
Назначение ривастигмина при УКР сопровождается не только положительным клиническим эффектом, но и снижает у данной категории пациентов риск развития БА [27, 28, 53], хотя ранее и сообщалось об отсутствии подобного эффекта [26]. Нужно заметить, что положительный эффект связан с полом больных — достоверное снижение риска развития у пациентов с УКР БА отмечено именно у женщин, у мужчин подобный эффект не был статистически значимым [27, 53]. Кроме того, у женщин с амнестическим типом УКР, длительно получающих ривастигмин, отмечено уменьшение степени нарастания церебральной атрофии и объема желудочков головного мозга по сравнению с пациентами, получающими плацебо. В настоящее время показано, что эффективность препарата в определенной степени определяется имеющимся генотипом бутирилхолинэстеразы. Рассматривая полученные результаты, свидетельствующие о различиях в эффективности ривастигмина у мужчин и женщин, следует учитывать и определенные особенности строения белого вещества в зависимости от пола, во всяком случае об этом свидетельствуют данные магнитно-резонансной томографии [34].
У пациентов с БА, получавших ривастигмин, менее значительно нарастает атрофия коры в теменно-височных отделах по сравнению с группой пациентов, получавших плацебо или другие — селективные — ингибиторы ацетилхолинэстеразы [53, 58]. На фоне терапии ривастигмином менее значительно, чем при терапии другими ингибиторами ацетилхолинэстеразы, происходит уменьшение объема белого вещества, в том числе в глубинных отделах полушарий и стволе головного мозга [59]. Многие исследователи [13, 53, 59] считают, что протективный эффект ривастигмина, способность этого препарата уменьшать прогрессирующую атрофию белого вещества головного мозга и, соответственно, сохранять интактными корковоподкорковые связи, обусловлен в первую очередь ингибированием бутирилхолинэстеразы. При этом подчеркивается, что в основе нейропротективного эффекта лежит блокирование ривастигмином бутирилхолинэстеразы вне синапсов, в глиальной ткани, в глубинных отделах корковых структур и подкорковых отделах [13], что, в частности, приводит к уменьшению провоспалительного действия этого фермента [59].
В последнее время показано, что одним из механизмов действия этого препарата, приводящим к уменьшению отложения амилоида [29], является противовоспалительный эффект [53]. В частности, на модели экспериментального аутоиммунного энцефаломиелита была продемонстрирована способность ривастигмина уменьшать выраженность демиелинизации, активацию микроглии, образование провоспалительных цитокинов и аксональное повреждение [45]. В настоящее время подчеркивается роль процессов воспаления в патогенезе БА [17]. Полученные данные свидетельствуют о значении несинапти-
ческого механизма действия ингибиторов ацетилхолинэстеразы на прогрессирование БА, связанного с влиянием этой группы препаратов на процессы миелинизации в центральной нервной системе [5].
Перспективы применения ривастигмина при других деменциях
Эффективность ингибиторов ацетилхолинэстеразы, в частности ривастигмина, отмечена не только при БА и сосудистой деменции, но и при других формах деменции — деменции с тельцами Леви, деменции при болезни Паркинсона [10, 11, 21, 41] и деменции, обусловленной черепно-мозговой травмой (ЧМТ) [2].
Важно заметить, что помимо непосредственного восстановления ацетилхолинергического дефекта, центральные ингибиторы ацетилхолинэстеразы также способны влиять и на церебральный кровоток. При БА, по данным методов функциональной нейровизуализации, отмечается снижение регионарного мозгового кровотока и метаболизма, которое носит наиболее выраженный характер в височно-теменных и лобных отделах. При этом локализация зон гипометаболизма не всегда совпадает с областями, в которых имеется характерный для данного заболевания ацетилхолинергический дефект [55]. Однако низкий уровень регионарного кровотока в височных отделах является одним из предикторов быстрого прогрессирования когнитивного дефекта.
Высказывается мнение, что центральные ингибиторы ацетилхолинэстеразы могут улучшать церебральную перфузию, и, таким образом, эта группа препаратов может быть эффективной в случаях как сосудистого, так и первично-дегенеративного генеза деменции [18]. Действительно, на фоне терапии центральными ингибиторами ацетилхолинэстеразы у пациентов с БА отмечается увеличение регионарного мозгового кровотока [39, 57].
Вчастности, ривастигмин не только повышает сниженный вследствие заболевания уровень ацетилхолина в головном мозге, но также увеличивает мозговой кровоток
влобных, теменных и височных отделах, что сопровождается улучшением в когнитивной сфере больных [10, 57]. Возможно, однако, что эти изменения кровотока связаны не столько с действием ривастигмина непосредственно на сосуды, сколько с усилением метаболизма в областях головного мозга, где сохранились реагирующие на ацетилхолин нейроны (стимуляция нейрональной активности на постсинаптическом уровне) [57].
Внастоящее время показано, что ингибиторы ацетилхолинэстеразы (галантамин, ривастигмин, донепезил) эффективны не только при БА, но и при сосудистой деменции [14, 19, 22, 39]. Отмечено улучшение в когнитивной и поведенческой сфере больных с подкорковой сосудистой деменцией, которые получали ривастигмин в течение 52 нед [43]. Возможно, что в части случаев в эти исследования были включены пациенты не с «чистой» сосудистой деменцией, а со смешанной деменцией [6]. Следует заметить, что имеются данные, весьма немногочисленные, свидетельствующие о том, что для «чистой» сосудистой деменции (т.е. без сосуществующих альцгеймеровских изменений) холинергический дефект не характерен [48]. Однако в пользу концепции ацетилхолинергического дефекта при сосудистой деменции свидетельствуют не только клинические, но также экспериментальные и патоморфологические данные. В частности, у специально
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 9, 2010 |
79 |

ОБЗОРЫ
выведенной линии крыс с наследственной предрасположенностью к артериальной гипертензии и инсультам (экспериментальная модель сосудистой деменции) наблюдается значительное уменьшение ацетилхолина и холина в коре головного мозга, гиппокампе и спинномозговой жидкости [22]. По данным аутопсии, у пациентов с сосудистой деменцией выявляется холинергический дефицит в коре, гиппокампе и стриатуме, а также снижение концентрации ацетилхолина при посмертном исследовании спинномозговой жидкости [22].
Важно подчеркнуть, что подкорковые сосудистые очаги могут приводить к центральному ацетилхолинергическому дефекту даже в случае отсутствия сопутствующих альцгеймеровских изменений [8, 52]. Центральные холинергические структуры, сохранность которых крайне важна в осуществлении когнитивных функций, весьма подвержены поражению в условиях ишемии, при этом атрофия гиппокампа может выявляться у пациентов с сосудистой деменцией при отсутствии сопутствующей БА [22].
Следует заметить, что «чистая» сосудистая деменция на практике встречается редко. У лиц пожилого и старческого возраста, как правило, имеется сочетание сосудистых и первично-дегенеративных (альцгеймеровских) изменений [4, 30, 38]. Такие случаи более правильно рассматривать как смешанную деменцию. В настоящее время подчеркивается, что использование центральных ингибиторов ацетилхолинэстеразы при смешанной деменции не менее эффективно, чем при БА [37, 51, 52].
Травматические повреждения головного мозга являются 3-й по частоте (после инфекционных заболеваний и алкоголизма) причиной деменции у лиц моложе 50 лет. В развитых странах примерно в 50% случаев причиной ЧМТ являются автомобильные аварии, однако у лиц пожилого
истарческого возраста ЧМТ чаще обусловлены падениями. Мужчины подвержены ЧМТ в большей степени, чем женщины. Выраженность когнитивных нарушений после ЧМТ зависит от целого ряда факторов, включая характер
итяжесть травмы, возраст больных, локализацию поражения и преморбидный когнитивный уровень. В целом деменция может отмечаться примерно у 3—10% больных, выживших после тяжелой ЧМТ.
Воснове прогрессирования когнитивных нарушений после ЧМТ могут лежать нарушения со стороны ацетилхолинергической системы, аналогичные нарушениям, отмечаемым при БА, нарушения гематоэнцефалического барьера, аутоиммунные и сосудистые расстройства, обусловленные травмой, а также развитие гидроцефалии. Следует заметить, что перенесенная травма увеличивает риск возникновения БА, а при патоморфологическом исследовании головного мозга лиц, перенесших ЧМТ, нередко выявляются характерные для БА изменения [7, 9]. В этой связи весьма любопытны данные, свидетельствующие о сходстве церебральных воспалительных реакций при БА и ЧМТ [33]. Головной мозг защищен от действия иммунной системы организма гематоэнцефалическим барьером, в норме через него могут проникать лишь активированные на периферии Т-клетки. При ЧМТ под действием провоспалительных цитокинов, интерлейкина-1β и фактора некроза опухолей происходит увеличение образования β-амилоида. Все это в конечном итоге может приводить к характерной для БА нейрональной дегенерации.
Поскольку при всех типах деменции когнитивный дефект нередко связан с нарушением исполнительных функций и обусловлен разобщением передних отделов головного мозга с корковыми и подкорковыми структурами, ривастигмин в силу своего двойного механизма действия имеет определенные преимущества. Связано это с тем, что активность бутирилхолинэстеразы наиболее значительна в области таламуса, проекционные пути из которого в лобные доли обеспечивают реализацию исполнительных функций, внимание и поведенческие реакции, а также в белом веществе полушарий головного мозга [13, 64]. Дефект исполнительных функций клинически проявляется нарушением способности ставить перед собой цель (цели), нарушением способности к планированию своих действий (способности выстроить программу достижения цели, выделить и структурировать ряд этапов и шагов, необходимых для достижения цели), нарушением выполнения целенаправленных действий (трудности начала действия и его исполнения, трудности переключения с одного действия на другое), трудностями «эффективного исполнения» (нарушение способности контролировать и регулировать собственную активность, замечать и исправлять собственные ошибки), а также апатией. Возможно, что одной из причин эффективности ривастигмина при деменции, связанной с болезнью Паркинсона, а также при некоторых типах сосудистой деменции является то, что он селективно влияет на лобные отделы головного мозга [11, 57].
Эффективность ривастигмина в лечении деменции при болезни Паркинсона была убедительно доказана в крупном исследовании EXPRESS, в процессе выполнения которого было установлено положительное влияние ривастигмина на когнитивные функции (в частности, внимание), активность в повседневной жизни и поведенческие нарушения [21]. В настоящее время ривастигмин — это единственный официально зарегистрированный ингибитор холинэстеразы, показанием для применения которого является болезнь Паркинсона. Ривастигмин уменьшает частоту возникновения зрительных галлюцинаций у пациентов с деменцией при болезни Паркинсона [11]. У них отмечено статистически значимое улучшение внимания после 6-месячного курса терапии [61]. В многоцентровом двойном слепом плацебоконтролируемом исследовании, в которое вошли пациенты с деменцией с тельцами Леви, было отмечено улучшение на фоне терапии ривастигмином в когнитивной и эмоциональной сферах [41]. На фоне терапии реже возникали столь характерные для этого заболевания и тяжело протекающие психотические расстройства. Следует заметить, что когнитивный дефект при этом заболевании аналогичен дефекту при БА. Кроме того, у большинства пациентов с болезнью диффузных телец Леви имеются экстрапирамидные нарушения (часто в отсутствие тремора покоя), выраженные психические расстройства (включая депрессию и психозы) и флюктуирующие нарушения сознания.
Полученные данные имеют важное практическое значение, поскольку как при деменции с тельцами Леви, так и при психотических явлениях у больных с деменцией при болезни Паркинсона, использование нейролептиков является весьма проблематичным. При болезни Паркинсона они могут усиливать основные проявления заболевания, а в ряде случаев приводить к возникновению злока-
80 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 9, 2010 |

РИВАСТИГМИН ПРИ ДЕМЕНЦИЯХ
чественного нейролептического синдрома, а при деменции с тельцами Леви они противопоказаны.
Заключение
Таким образом, существующие в настоящее время данные свидетельствуют о важности коррекции центрального ацетилхолинергического дефекта у пациентов с деменцией, как при БА, так и вследствие других причин (сосудисто-мозговая недостаточность, болезнь Паркинсона, деменция с тельцами Леви и др.). Одним из препара-
ЛИТЕРАТУРА
1.Захаров В.В., Яхно Н.Н. Синдром умеренных когнитивных расстройств в пожилом возрасте: диагностика и лечение. Рус мед журн 2004; 10: 573—576.
2.Кондратьева Е.А., Боровикова В.Н., Кондратьев С.А. и др. Роль ривастигмина (экселона) в лечении последствий черепно-мозговой травмы. Журн неврол и психиат 2009; 109: 55—58.
3.Локшина А.Б., Захаров В.В. Легкие и умеренные когнитивные расстройства при дисциркуляторной энцефалопатии. Неврол журн 2006;
11:прил. 1: 57—64.
4.Яхно Н.Н. Когнитивные расстройства в неврологической клинике Неврол журн 2006; 11: прил. 1: 4—13.
5.Bartzokis G. Acetylcholinesterase inhibitors may improve myelin integrity. Biol Psychiat 2007; 62: 294—301.
6.Bowler J.V. Acetylcholinesterase inhibitors for vascular dementia and Alzheimer’s disease combined with cerebrovascular disease. Stroke 2003;
34:584—586.
7.Brooks N. Mental deterioration late after head injury — does it happen? J Neurol Neurosurg Psychiat 2003; 74: 1014.
8.Brun A. The neuropathology of vascular dementia and its overlap with Alzheimer’s disease. In: Cerebrovascular Disease, Cognitive Impairment and Dementia. Second edition. Ed. by J.O’Brien et al. London, New York: Martin Dunitz 2004; 103—115.
9.Bruton C.J. Head injury and dementia. In: The Neuropathology of Dementia. Ed. by M.M. Esiri, J.H. Morris. Cambridge: Cambridge University Press 1997; 344—355.
10.Bullock R. The clinical benefits of rivastigmine may reflect its dual inhibitory mode of action: an hypothesis. Int J Clin Pract 2002; 56: 3: 206—214.
11.Bullock R., Cameron A. Rivastigmine for the treatment of dementia and visual hallucinations associated with Parkinson’s disease: a case series. Curr Med Res Opin 2002; 18: 5: 258—264.
12.Bullock R., Connolly C. Switching cholinesterase inhibitor therapy in Alzheimer’s disease — donepezil to rivastigmine, is it worth it? Int J Geriat Psychiat 2002; 17: 288—289.
13.Bullock R., Lane R. Executive dyscontrol in dementia, with emphasis on subcortical pathology and the role of butyrylcholinesterase. Curr Alzheimer Res 2007; 4: 277—293.
14.Court J., Perry E.K., Kalaria R.N. Neurotransmitter changes in vascular dementia. In: Cerebrovascular Disease, Cognitive Impairment and Dementia. Second edition. Ed. by J.O’Brien et al. London, New York: Martin Dunitz 2004; 133—151.
15.Cummings J.L., Kaufer D. Neuropsychiatric aspects of Alzheimer’s disease: The cholinergic hypothesis revisited. Neurology 1996; 47: 876—883.
16.Cummings J., Emre M., Aarsland D. et al. Effects of rivastigmine in Alzheimer’s disease patients with and without hallucinations. J Alz Dis 2010; 20: 301—311.
17.Das N.U. Acetylcholinesterase and butyrylcholinesterase as possible markers of low-grade systemic inflammation. Med Sci Monit 2007; 13: RA214— RA221.
18.de la Torre J.C., Stefano G.B. Evidence that Alzheimer’s disease is a microvascular disorder: the role of constitutine nitric oxide. Brain Res Rev 2000; 34: 119—136.
19.Desmond D.W. Vascular dementia. Clin Neurosci Res 2004; 3: 437—448.
тов, осуществляющих такую коррекцию, является ривастигмин (экселон), который ингибирует ацетилхолинэстеразу и бутирилхолинэстеразу. В настоящее время показана способность препарата действовать не только симптоматически, улучшая когнитивные и поведенческие функции у пациентов с БА, но и влиять на механизмы развития этого заболевания. Помимо таблетированной формы ривастигмина разработана более удобная для использования новая форма — трансдермальная терапевтическая система (пластырь).
20.Doraiswamy P.M., Krishnan K.R.R., Anand R. et al. Long-term effects of rivastigmine in moderately severe Alzheimer’s disease: Does early initiation of therapy offer sustained benefits? Progr. Neuro-Psychopharm. Biol Psychiat 2002; 26: 705—712.
21.Emre M., Aarsland D., Albanese A. et al. Rivastigmine for dementia associated with Parkinson’s disease. N Engl J Med 2004; 351: 2509—2518.
22.Erkinjuntti T., Roman G., Gauthier S. et al. Emerging therapies for vascular dementia and vascular cognitive impairment. Stroke 2004; 35: 1010—1017.
23.Farlow M., Anand R., Messina J. et al. A 52-week study of the efficacy of rivastigmine in patients with mild to moderately severe Alzheimer’s disease. Eur Neurol 2000; 44: 234—241.
24.Farlow M.R., Lilly M.L. and for the ENA713 B352 Study Group. Rivastigmine: an open-label, observational study of safety and effectiveness in treating patients with Alzheimer’s disease for up to 5 years. BMC Geriatrics 2005; 5: 3—10.
25.Farlow M.R., Cummings J.L. Effective pharmacologic management of Alzheimer’s disease. Am J Med 2007; 120: 388—397.
26.Feldman H.H., Ferris S., Winblad B. et al. Effect of rivastigmine on delay to diagnosis of Alzheimer’s disease from mild cognitive impairment: the InDDEx study. Lancet Neurol 2007; 6: 501—512.
27.Ferris S., Lane R., Sfikas N. et al. Effects of gender on response to treatment with rivastigmine in mild cognitive impairment: a post hoc statistical modeling approach. Gender Med 2009; 6: 345—355.
28.Ferris S., Nordberg A., Soininen H. et al. Progression from mild cognitive impairment to Alzheimer’s disease: effects of sex, butyrylcholinesterase genotype, and rivastigmine treatment. Pharmacogenet. Genomics 2009; 19: 635—636.
29.Golde T.E. Alzheimer disease therapy: Can the amyloid cascade be halted? J Clin Invest 2003; 111: 11—18.
30.Gorelick P.B. Status of risk factors for dementia associated with stroke. Stroke 1997; 28: 459—463.
31.Grossberg G.T., Stahelin H.B., Messina J.C. et al. Lack of adverse pharmacodynamic drug interactions with rivastigmine and twenty-two classes of medications. Int J Geriat Psychiat 2000; 15: 242—247.
32.Guttman R., Altman R., Nielsen N.H. Alzheimer disease. Report of the Council on Scientific Affairs. Arch Fam Med 1999; 8: 347—353.
33.Holmin S., Gahm C., Mathiesen T. Intracerebral inflammatory response in traumatic brain injury. In: Research and Practice in Alzheimer’s Disease. Vol.2. Ed. by B. Vellas, L.J. Fitten. Paris, New York: Serdi Publisher, Springer Publishing Company 1999; 48—54.
34.Hsu J.L., Leemans A., Bai C.H. et al. Gender differences and age-related white matter changes of the human brain: a diffusion tensor imaging study. NeuroImage 2008; 39: 566—577.
35.Kennedy J.S., Polinsky R.J., Johnson B. et al. Preferential cerebrospinal fluid acetylcholinesterase inhibition by rivastigmine in humans. J Clin Psychopharm 1999; 19: 6: 513—521.
36.Lane R.M., Potkin S.G., Enz A. Targeting acetylcholinesterase and butyrylcholinesterase in dementia. Internat. J Neuropsychopharmacol 2006; 9: 101—124.
37.Langa K.M., Foster N.L., Larson E.B. Mixed dementia. Emerging concepts and therapeutic implications. JAMA 2004; 292: 2901—2908.
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 9, 2010 |
81 |

ОБЗОРЫ
38.Leys D., Henon H., Pasquier F. The role of cerebral infarcts in vascular dementia. /In: Research and Practice in Alzheimer’s Disease. B. Vellas et al. (eds.). Paris: Serdi Publisher 2001; 5: 123—128.
39.Lojkowska W., Ryglewicz D., Jedrzejczak T. et al. The effect of cholinesterase inhibitors on the regional blood flow in patients with Alzheimer’s disease and vascular dementia. J Neurol Sci 2003; 216: 119—126.
40.Lopez O.L., Becker J.T., Saxton J. et al. Alteration of a clinically meaningful outcome in the natural history of Alzheimer's disease by cholinesterase inhibition. J Am Geriat Soc 2005; 53: 1: 83—87.
41.McKeith I., Del Ser T., Spano P.-F. et al. Efficacy of rivastigmine in patients with dementia with Lewy bodies: a randomized, double blind, placebocontrolled international study. Lancet 2000; 356: 2031—2036.
42.Meguro K., Ishii H., Yamaguchi S. et al. Is vascular cognitive impairment the preclinical stage of vascular dementia: The Tajiri Project. In: 2nd Congress of the International Society for Vascular Behavioural and Cognitive Disorders (Vas-Cog). Abstract book. Florence 2005; 71.
43.Moretti R., Torre P., Antonello R.M., Cazzato G. Rivastigmine in subcortical vascular dementia: a comparison trial on efficacy and tolerability for 12 months follow-up. Eur J Neurol 2001; 8: 361—362.
44.Morganroth J., Graham S., Hartman R., Anand R. Electrocardiographic effects of rivastigmine. J Clin Pharmacol 2002; 42: 558—568.
45.Nizri E., Irony-Tur-Sinai M., Faranesh N. et al. Suppression of neuroinflammation and immunomodulation by the acetylcholinesterase inhibitor rivastigmine. J Neuroimmunol 2008; 203: 12—22.
51.Raskind M.A. Galantamine — a review of efficacy and tolerability in mild- to-moderate Alzheimer’s disease. In: Alzheimer’s Disease and Related Disorders: Research Advances. Ed. by K. Iqbal, B. Winblad. Bucharest: “Ana Aslan” International Academy of Aging 2003; 677—691.
52.Royall D.R. The emperor has no clothes: Dementia treatment on the Eve of the Aging Era. J Am Geriat Soc 2005; 53: 1: 163—164.
53.Shanks M., Kivipelto M., Bullock R., Lane R. Cholinesterase inhibition: is there evidence for disease-modifying effects? Curr Med Res Opin 2009; 25: 2439—2446.
54.Small G.W. What we need to know about age related memory loss. Br Med J 2002; 324: 1502—1505.
55.Smith G.S., De Leon M.J., George A.E. et al. Topography of cross-sectional and longitudinal glucose metabolic deficits in Alzheimer’s disease. Pathophysiologic implications. Arch Neurol 1992; 49: 1142—1150.
56.Tavassoli N., Sommet A., Lapeyre-Mestre M. et al. Drug interactions with cholinesterase inhibitors: An analysis of the French pharmacovigilance database and a comparison of two national drug formularies (Vidal, British National Formulary). Drug Safety 2007; 30: 1063—1071.
57.Venneri A., Shanks M.F., Staff R.T. et al. Cerebral blood flow and cognitive responses to rivastigmine treatment in Alzheimer’s disease. NeuroReport 2002; 13: 83—87.
58.Venneri A., McGeown W.J., Shanks M.F. Empirical evidence of neuroprotection by dual cholinesterase inhibition in Alzheimer’s disease. NeuroReport 2005; 16: 107—110.
46.Orgogozo J.-M. Therapeutic Approaches in Alzheimer’s Disease. /In: 59. Venneri A., Lane R. Effects of cholinesterase inhibition on brain white
Alzheimer’s Dementia. The 16th International Bayer Pharma Press Seminar. Paris 1997; 34—42.
47.Perry E.K., Perry R.H., Blessed G., Tomlinson B.E. Changes in brain cholinesterases in senile dementia of Alzheimer type. Neuropathol Appl Neurobiol 1978; 4: 273—277.
48.Perry E., Ziabreva I., Perry R. et al. Absence of cholinergic deficits in «pure» vascular dementia. Neurology 2005; 64: 132—133.
49.Petersen R. C., Stevens J.C., Ganguli M. et al. Practice parameter: Early detection of dementia: Mild cognitive impairment (an evidence-based review). Report of the Quality Standards Subcommittee of the American Academy of Neurology. Neurology 2001; 56: 1133—1142.
50.Potkin S.G., Anand R., Hartman R. et al. Impact of Alzheimer’s disease and rivastigmine treatment on activities of daily living over the course of mild to moderately severe disease. Progr. Neuro-Psychopharm. Biol Psychiat 2002; 26: 713—720.
matter volume in Alzheimer’s disease. NeuroReport 2009; 20: 285—288.
60.Weiser M., Rotmensch H.H., Korczyn A. et al. A pilot, randomized, openlabel trial assessing safety and pharmacokinetic parameters of coadministration of rivastigmine with risperidone in dementia patients with behavioral disturbances. Int J Geriat Psychiat 2002; 17: 343—346.
61.Wesnes K.A., McKeith I., Edgar C. et al. Benefits of rivastigmine on attention in dementia associated with Parkinson disease. Neurology 2005; 65: 1654—1656.
62.Winblad B., Grossberg G., Frolich L. et al. IDEAL: A 6-month, doubleblind, placebo-controlled study of the first skin patch for Alzheimer disease. Neurology 2007; 69: Suppl 1: S14—S22.
63.Winblad B., Machado J.C. Use of rivastigmine transdermal patch in the treatment of Alzheimer’s disease. Expert Opin Drug Deliv 2008; 5: 1—10.
64.Wright C.I., Geula C., Mesulam M.M. Neurological cholinesterases in the normal brain and in Alzheimer’s disease: relationship to plaques, tangles, and patterns of selective vulnerability. Ann Neurol 1993; 34: 373—384.
82 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 9, 2010 |
