
Журнал неврологии и психиатрии / 2004 / NEV_2004_12_04
.pdf
ЛЕЧЕНИЕ НЕРВНЫХ И ПСИХИЧЕСКИХ ЗАБОЛЕВАНИЙ
Применение тремонорма при болезни Паркинсона: опыт амбулаторной неврологической службы Московского городского здравоохранения
А.Н. БОЙКО, Т.Т. БАТЫШЕВА, Е.С. ЧИКИНА, И.Ю. АРТЕМОВА, Т.В. ВДОВИЧЕНКО, П.А. ГАНЖУЛА, А.М. ИСМАИЛОВ, Л.Н. ЛИСЕНКЕР, Н.А. ОБЫДЕНОВА, Л.Д. РОТОР, А.А. ХОЗОВА, Я.Я. ВИНЕЦКИЙ
Use of tremonorm in treatment of Parkinson’s disease: outpatient experience of Moscow Municipal Health Care Service
A.N. BOIKO, T.T. BATYSHEVA, E.S. CHIKINA, I.YU. ARTEMOVA, T.V. VDOVICHENKO, P.A. GANZHULA, A.M. ISMAILOV, L.N. LISENKER, N.A. OBYDENOVA, L.D. ROTOR, A.A. KHOZOVA, YA.YA. VINETSKY
Организационно-методический отдел неврологии, поликлиника восстановительного лечения ¹7 департамента здравоохранения, Москва; окружные неврологические отделения управлений здравоохранения административных округов1 Москвы; кафедра неврологии и нейрохирургии Российского государственного медицинского университета, Москва
Приведены результаты оценки эффективности отечественного препарата тремонорм (леводопа/карбидопа) при болезни Паркинсона (БП). Лечение проводилось в лечебных учреждениях 8 административных округов Москвы. Лечили 142 больных с БП, из них 15 тремонорм был назначен впервые и 127 были переведены с терапии другими препаратами, содержащими леводопу/карбидопу (наком). Для каждого больного подбиралась минимально эффективная доза, которая не менялась затем в ходе исследования на протяжении 2 мес (максимально 500 мг). Для пациентов, уже получающих леводопу (в виде леводопа/карбидопа), замена препарата на тремонорм осуществлялась одномоментно, если больной принимал не более 500 мг леводопы, и в течение 2 нед, если больной принимал более 500 мг леводопы в сутки. Для комплексной оценки стадии заболевания использовалась модифицированная шкала Hoehn&Yahr, шкалы UPDRS, MMSE, PDQ-39 и др. в динамике. В результате положительный эффект от приема тремонорма при первичном назначении отметили 94 пациента, что составляет 66,2% от всех больных БП. Все из них продолжили прием тремонорма после окончания исследования. Самыми частыми побочными эффектами были желудочно-кишечные проявления. На фоне назначения тремонорма выявлено достоверное улучшение двигательных функций (по шкале UPDRS) и качества жизни пациентов практически по всем подшкалам PDQ-39. Улучшение двигательных функций сопровождалось уменьшением выраженности брадикинезии, тремора покоя, улучшением походки, письма, увеличением степени самообслуживания и повседневной активности. Замена накома на тремонорм не сопровождалась достоверным изменением симптомов или показателей качества жизни, что может свидетельствовать о практически одинаковом влиянии этих препаратов на симптоматику БП. Вместе с тем существенная разница в их стоимости (практически в 2 раза) позволяет с более экономных позиций подойти к проблеме выбора препарата для лечения БП.
Ключевые слова: болезнь Паркинсона, терапия, тремонорм.
The efficacy of domestic drug tremonorm (levadopa-carbidopa) for Parkinson’s disease (PD) treatment was studied. The treatment was conducted in neurological outpatient departments in several Moscow administrative regions and was administered to 142 PD patients, 15 being assigned to this drug for the first time and 127 being previously treated with other medications containing levadopa/carbidopa. A minimal effective dose (up to 500 mg) was selected for each patient and was not changed during 2 months. For patients previously switched to levadopa, the change for tremonorm has been done during 1 day if the dose of levadopa did not exceed 500 mg, and during 2 months in case a patient received over 500 mg per day. Modified Hoehn&Yahr scale, UPDRS, MMSE, PDQ-39 and other scales were used in complex evaluation of the disease stage. Positive effect of tremonorm was detected for 94 patients (66,2%), all of them continued tremonorm therapy after the end of the study. The most frequent side-effects proved to be dyspeptic symptoms. Tremonorm caused statistically significant positive changes in patient’s movement scaled by UPDRS and the QL indexes in all PDQ-39 subscales. Positive changes in movement activity were accompanied by decrease of bradykinesia, tremor, better walking, writing and every day activity of PD patients. A change of nacom for tremonorm did not result in significant alteration of symptoms and Quality of Life indexes that suggest similar influence of these drugs on PD symptomatology. At the same time, a substantially lower price of tremonorm allows reducing of treatment costs.
Key words: Parkinson's disease, therapy, tremonorm.
|
|
Zh Nevrol Psikhiatr Im SS Korsakova 2004;104: 12: 23—28 |
|
|
|
|
|
|
|
|
|
|
|
1 Учреждения Центрального (ЦАО), Северо-Западного |
|
|
|
(СЗАО), Юго-Западного (ЮЗАО), Северо-Восточного |
|
|
|
(СВАО), Северного (САО), Южного (ЮАО), Западного |
|
© Коллектив авторов, 2004 |
|
||
|
(ЗАО) и Зеленоградского округов Москвы. |
||
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 12, 2004 |
|
23 |
|

ЛЕЧЕНИЕ НЕРВНЫХ И ПСИХИЧЕСКИХ ЗАБОЛЕВАНИЙ
Известно, что болезнь Паркинсона (БП) является идиопатическим медленно прогрессирующим дегенеративным неврологическим заболеванием, встре- чающимся у 1% лиц в возрасте старше 60 лет. Заболевание проявляется в типичных случаях брадикинезией, ригидностью мышц, тремором в состоянии покоя, постуральной неустойчивостью, вегетативной дисфункцией. Все это существенно влияет на способность к передвижению и качество жизни больных. Исследования последних лет позволили не только значительно углубить понимание патогенеза БП, но
èразработать новые методы терапии.
Âоснове БП лежит патология базальных ганглиев мозга, которые связаны между собой и корой головного мозга посредством нейрональных путей, которые соединяют премоторные, пре- и постцентральные сенсомоторные зоны коры, базальные ганглии, передневентральный и вентролатеральный отделы таламуса. Выделяют два основных пути — прямой и непрямой. Прямой соединяет скорлупу и внутренний сегмент бледного шара; непрямой проходит через наружный сегмент бледного шара, субталамическое ядро и далее к внутреннему сегменту. Субталамическое ядро оказывает активирующее влияние на внутренний сегмент бледного шара, в то время как почти все остальные связи базальных ганглиев являются тормозными. Дофамин, синтезирующийся в клетках компактной зоны черной субстанции и приходящий по их аксонам в неостриатум, оказывает модулирующее воздействие на возбуждающие глутаматергические кортико-стриарные связи. Он стимулирует нейроны нейростриатума, имеющие D1-рецепторы, от которых начинается прямой путь, и тормозит нейроны, экспрессирующие D2-рецепторы, дающие начало непрямому пути. Таким образом, дофамин уменьшает ингибирующее влияние базальных ганглиев, что ведет к облегчению таламокортикальной передачи и активации двигательной зоны коры. Основным патогенетическим механизмом БП считают прогрессирующую дегенерацию дофаминергических нейронов в черной субстанции, что приводит к уменьшению количе- ства дофамина и затрудняет синаптическую передачу. Вследствие дофаминергической денервации базальных ганглиев развивается их чрезмерная тормозная активность по отношению к коре, что приводит к развитию акинезии и ригидности [10, 20]. Возникновение тремора связывают с усилением спонтанной активности нейронов полосатого тела и таламуса. Считается также, что хвостатое ядро и его связи более вовлекаются в когнитивные функции и планирование моторной активности, в то время как скорлупа и ее связи отвечают преимущественно за реализацию моторных симптомов [2, 3, 10, 16].
Выраженность клинической картины заболевания во многом определяется степенью функциональной активности оставшихся неповрежденными нейронов [4, 6, 10]. Проявления нигростриарного дефицита дофамина рассматривают в настоящее время не только как результат потери соответствующих нейронов, но и как следствие неадекватности компенсаторных механизмов и механизмов пластичности c выделением периода «удовлетворительной компенсации недостаточности функционирования дофаминергиче- ской системы» [7].
Лечение БП является в настоящее время в основном симптоматическим, направленным на восполнение дефицита дофамина, и приводит к временному уменьшению выраженности основных симптомов и улучшению каче- ства жизни пациентов. Можно замедлить прогрессирование болезни и улучшить качество жизни пациентов на основе индивидуального подхода к выбору препарата для лечения БП с учетом степени функциональной дезадаптации, возраста, выраженности отдельных симптомов болезни и наличия побочных эффектов терапии [17, 20].
Препараты леводопы остаются наиболее эффективными противопаркинсоническими средствами, являясь «золотым стандартом» лечения БП. Согласно современным алгоритмам лечения, начальная монотерапия препаратами леводопы рекомендуется для пациентов старше 65—70 лет, если необходимо быстрое достижение хорошего эффекта, особенно при наличии когнитивно-психических расстройств, так как это обеспечивает максимальную эффективность наряду с минимальным риском усиления этих нарушений [3, 5, 9, 17]. Однако вследствие прогрессирования заболевания и необходимости коррекции появляющихся лекарственных осложнений с течением времени возникает необходимость в увеличении дозы препаратов,
âназначении дополнительных медикаментов, что существенно ухудшает качество жизни пациента и увеличивает стоимость лечения.
Последние годы в практике отечественного здравоохранения качеству жизни пациентов стали отводить особенно большую роль, так как это существенно расширяет возможности оценки эффективности новых методов лечения, определения эффективности реабилитационных программ, экономического обоснования тех или иных методов лечения; проведения индивидуального мониторинга состояния больного с оценкой ранних и отдаленных результатов терапии, стандартизации методов лечения и прогнозирования развития заболевания. Для оценки качества жизни применяют специальные опросники [15, 18, 19]. При БП чаще других используют опросник “Parkinson’s disease questionnaire” — PDQ-39 [19], состоящий из 39 вопросов, сгруппированных
â8 подшкал. Он был апробирован во многих странах мира,
âтом числе в России [8], переведен на более чем 15 языков мира. Более того, этот опросник рекомендован для международных клинических испытаний [14, 19]. Важно, что учет показателя качества жизни наряду с клинической оценкой эффективности лечения позволяет судить о целесообразности применения тех или иных препаратов с учетом их стоимости, т.е. проводить фармакоэкономический анализ лече- ния [1].
Данное исследование было посвящено изучению эффектов препарата тремонорм. Тремонорм — первый отече- ственный препарат, содержащий комбинацию леводопы с ингибитором периферической ДОФА-декарбоксилазы (ДДК) и производящийся в России на Скопинском фармацевтическом заводе (в кооперации с компанией “Тeva” (Израиль). В настоящее время широко используются несколько препаратов этой группы: леводопа/бенсеразид (мадопар 250, мадопар 125, мадопар ГСС, мадопар диспергируемый) и леводопа/карбидопа (наком, тремонорм, дуэллин, синдопа, тидомет, синемет). Все эти препараты (кроме тремонорма) производятся фармацевтическими фирмами зарубежных стран
— Швейцарии, Словении, Индии, Венгрии. В табл. 1 приведена сравнительная стоимость препаратов леводопы при оптовых поставках крупнейшими российскими фармдистрибьюторами в аптеки и поликлиники города (цены из прайс-листов дистрибьюторов на 27.07.04). Из табл. 1 видно, что при одинаковой дозировке стоимость тремонорма ниже, чем других препаратов. Для более подробного изучения возможностей широкого применения тремонорма для лечения болезни Паркинсона в ряде окружных неврологических отделений Управлений здравоохранения административных округов Москвы в 2003 г. проводилось открытое изучение эффективности препарата тремонорм у пациентов с болезнью
Паркинсона.
Целью исследования была оценка клинической эффективности и безопасности тремонорма при назначении его пациентам с БП, не применявшим ранее препаратов леводопы, и при переводе с других, содержащих леводопу и карбидопу препаратов, а также оценка влияния тремонорма на качество жизни пациентов.
24 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 12, 2004 |

ЛЕЧЕНИЕ БОЛЕЗНИ ПАРКИНСОНА
Таблица 1. Стоимость препаратов леводопы при оптовых поставках в аптечную сеть Москвы
|
Дозировка |
Kоличество |
Стоимость оптовых поставок препарата |
|||
|
фармдистрибьюторами, усл.ед. |
|||||
Препарат |
леводопа/ингибитор |
таблеток |
||||
|
|
|
||||
|
«ÑÈÀ |
«Øðåÿ |
||||
|
ÄÄK, ìã |
в упаковке |
«Протек» |
|||
|
интернейшнл» |
корпорейшн» |
||||
|
|
|
|
|||
|
|
|
|
|
|
|
Мадопар |
200/50 |
100 |
41,84 |
41,40 |
42,06 |
|
|
125/25 |
100 |
21,10 |
20,88 |
21,21 |
|
Мадопар ГСС |
125/25 |
100 |
23,47 |
23,30 |
23,71 |
|
Мадопар диспергируемый |
125/25 |
100 |
23,62 |
23,30 |
23,71 |
|
Наком |
250/25 |
100 |
39,46 |
íåò |
40,15 |
|
Тремонорм |
250/25 |
100 |
22,98 |
24,66 |
22,68 |
|
Дуэллин |
100/10 |
50 |
5,07 |
íåò |
4,96 |
|
|
100/25 |
50 |
8,00 |
íåò |
íåò |
|
|
250/25 |
50 |
11,66 |
íåò |
11,19 |
|
Синдопа |
100/10 |
50 |
íåò |
íåò |
14,70 |
|
Тидомет форте |
100/10 |
100 |
15,20 |
16,49 |
15,04 |
|
|
|
|
|
|
|
|
Таблица 2. Распределение пациентов с БП по лечебным учреждениям различных административных округов Москвы
|
Число больных, которым был |
Число больных, переведенных с лечения |
|
|
Округ |
другими препаратами |
Всего больных |
||
назначен впервые тремонорм |
||||
|
леводопа/карбидопа на тремонорм |
|
||
|
|
|
||
|
|
|
|
|
ÑÀÎ |
3 |
34 |
37 |
|
ÞÀÎ |
0 |
5 |
5 |
|
ÑÂÀÎ |
0 |
9 |
9 |
|
ÑÇÀÎ |
0 |
13 |
13 |
|
ÞÇÀÎ |
2 |
15 |
17 |
|
ÇÀÎ |
0 |
20 |
20 |
|
ÖÀÎ |
8 |
26 |
34 |
|
Зеленоградский АО |
2 |
15 |
17 |
|
Всего |
15 |
127 |
142 |
Материал и методы
В табл. 2 представлено распределение 142 пациентов с БП, лечившихся в лечебных учреждениях разных административных округов Москвы. 15 пациентам тремонорм был назначен впервые, 127 пациентов были переведены с другого препарата, содержащего леводопу/карбидопу (как правило, с накома).
Критериями включения пациентов в исследование были: возраст 40—75 лет, установленный диагноз БП 2—4-й стадии по шкале Hoehn и Yahr [13], возможность приема препарата внутрь, письменное согласие пациента с проводимым исследованием. Для пациентов, уже получающих препараты леводопы, дополнительным критерием включения был прием стабильных доз препаратов леводопы (в виде леводопа/карбидопа) от 3 мес до 15 лет.
Критериями исключения пациентов из исследования были: беременность, кормление грудью или отсутствие средств контрацепции у женщин детородного возраста, наличие выраженного интеллектуально-мнестического снижения с оценкой по шкале MMSE менее 22 баллов (уровень деменции), наличие анамнестических данных или клиниче- ских проявлений, указывающих на другой генез заболевания вследствие приема лекарств, метаболических нарушений, энцефалита, дегенеративных заболеваний ЦНС, наличие цереброваскулярного поражения, выявляемого по данным анамнеза, клинического осмотра и/или нейровизуализации, что могло явиться причиной развития синдро-
ма паркинсонизма. Для пациентов, уже получающих препараты леводопы, дополнительным критерием исключения был прием нестабильной дозы препаратов леводопы в тече- ние последних 3 мес перед включением пациента в исследование. Для пациентов, не получавших препаратов леводопы, дополнительными критериями исключения были: обострение язвенной болезни желудка/двенадцатиперстной кишки в настоящее время, ортостатическая гипотензия (снижение систолического АД ≥20 мм рт.ст. через 2—3 мин после принятия положения стоя), нестабильные дозы снотворных, анксиолитиков, антидепрессантов в последние 30 дней.
Cхема лечения: для пациентов, не получавших ранее леводопу, начальная доза препарата тремонорм составляла 62,5 мг (1/4 таблетки) 3 раза в день. Доза увеличивалась в течение месяца, еженедельно на 62,5—125 мг, в зависимости от переносимости. В результате увеличения дозы к концу первого месяца исследования подбиралась минимально эффективная доза препарата, которая не менялась затем в ходе дальнейшего исследования на протяжении последующих 2 мес приема и максимально составила 500 мг леводопы (2 таблетки по 250/25 мг). Для пациентов, уже получающих леводопу (в виде леводопа/карбидопа), замена того препарата, который они получали, на тремонорм осуществлялась одномоментно, если больной принимал не более 500 мг леводопы, и в течение 2 нед, если больной принимал более 500 мг леводопы
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 12, 2004 |
25 |
ЛЕЧЕНИЕ НЕРВНЫХ И ПСИХИЧЕСКИХ ЗАБОЛЕВАНИЙ
в сутки. При необходимости проводилась коррекция дозы тремонорма с учетом возникших или усилившихся дофаминергических побочных эффектов. При отсутствии побочных эффектов и хорошей переносимости препарата его доза не менялась. К концу первого месяца исследования доза тремонорма была стабильной и не менялась затем на протяжении последующих 2 мес приема. Длительность исследования составила 3 мес.
Другие противопаркинсонические препараты (циклодол, мидантан, проноран, юмекс) пациенты принимали в прежней дозе, дополнительные противопаркинсонические лекарственные средства назна- чались только по жизненно важным показаниям.
Для оценки стадии заболевания использовалась модифицированная упоминавшаяся выше шкала Hoehn и Yahr, для оценки выраженности симптоматики — шкала “Unified Parkinson’s disease rating scale”
— UPDRS [11] часть II («активность в повседневной жизни», часть III («двигательные функции») и часть IV («осложнения от лечения»), для краткой оценки когнитивных функций шкала “Mini-mental state examination” — MMSE [12], для оценки качества жизни пациентов — опросник PDQ-39 [18]. Кроме того, применялась оценка эффективности и переносимости препарата по 5-балльной шкале (отличная, хорошая, удовлетворительная, плохая, отсутствует). Оценка по всем шкалам проводилась до начала лечения, в динамике (в конце 1-го месяца исследования, когда была подобрана окончательная доза тремонорма) и в конце исследования (через 2 мес приема стабильной дозы препарата).
Статистическая обработка полученных данных проводилась с использованием пакета статистической программы SPSS 10.0 for Windows (1999). При анализе межгрупповых различий использовался критерий t Стьюдента с 95% доверительным интервалом. Все данные представлены в виде M±SD.
Результаты
Положительный эффект от приема тремонорма отметили 94 пациента, что составляет 66,2% (табл. 3). Все из них продолжили прием тремонорма после окон-
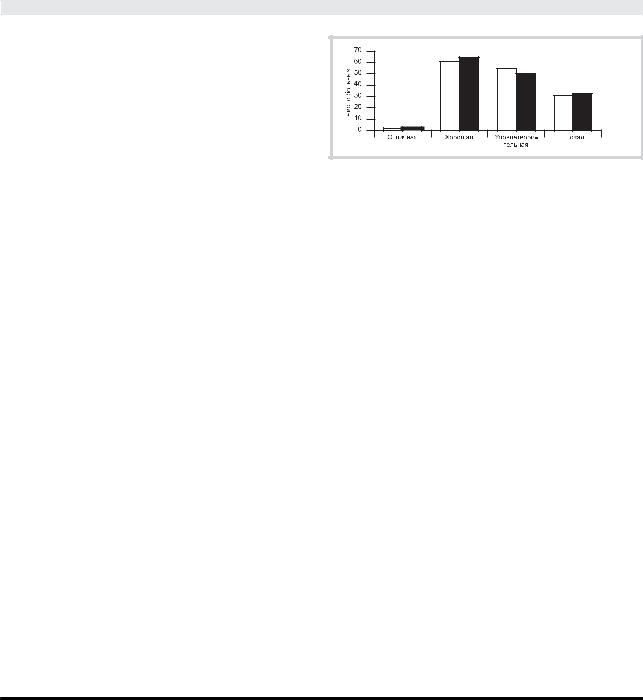
Результаты оценки эффективности (светлые столбики) и пере- |
носимости (темные столбики) тремонорма у пациентов с БП. |
чания исследования. 48 пациентам был отменен тремонорм (вследствие побочных эффектов или недостаточной эффективности препарата по сравнению с предыдущим лечением).
Результаты оценки эффективности и переносимости тремонорма по 5-балльной шкале (отличная, хорошая, удовлетворительная, плохая, отсутствует), представленные на рисунке, варьировали от отлич- ной до плохой. Наиболее частыми побочными эффектами были желудочно-кишечные проявления (тошнота, боли в животе) — у 14 (50% от всех больных с побочными эффектами); в 2 случаях желудочно-ки- шечные проявления сопровождались аллергическими высыпаниями на коже. Галлюцинаторный синдром наблюдался у 5 (17,9%) пациентов, аллергические проявления имели место у 3 (10,7%). У 5 (17,9%) пациентов был зафиксирован шум в голове при приеме тремонорма, но он вскоре регрессировал и не являлся причиной отмены препарата.
Необходимо отдельно остановиться на одном слу- чае возникновения акинетического криза при замене накома на тремонорм. Пациент получал 3 таблетки накома в сутки, у него проводилась постепенная замена накома на тремонорм: 1,5 таблетки накома и 1,5 таблетки тремонорма в сутки. Однако уже к концу 2-го дня резко усилилась скованность, акинезия, тремор, пациент перестал передвигаться самостоятельно, отмечался подъем температуры тела до 39°С. При возврате к исходной схеме лечения (прием накома 3 таблетки в сутки) имевшиеся проявления регрессировали в течение нескольких дней. Возможно, что возникновение акинетического криза в данном случае
Таблица 3. Эффективность тремонорма у пациентов с БП в учреждениях различных округов Москвы
|
|
|
|
|
|
|
Причины отмены |
|
Продолжают |
||
|
|
|
|
Отмена |
|
|
принимать |
||||
|
|
|
|
|
|
|
|
||||
|
|
Положительный |
|
|
|
|
тремонорм |
||||
|
Всего |
препарата, |
|
|
|
|
|||||
Округ |
эффект |
|
|
|
|
после |
|||||
всего |
из-за побочных |
èç-çà |
|
||||||||
больных |
|
||||||||||
|
|
|
окончания |
||||||||
|
|
|
|
|
эффектов |
неэффективности |
|||||
|
|
|
|
|
|
||||||
|
|
|
|
|
|
исследования |
|||||
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
àáñ. |
% |
àáñ. |
% |
àáñ. |
% |
àáñ. |
% |
àáñ. |
% |
|
|
|
|
|
|
|
|
|
|
|
|
ÑÀÎ |
37 |
23 |
62,2 |
14 |
37,8 |
6 |
16,2 |
8 |
21,6 |
23 |
62,2 |
ÞÀÎ |
5 |
5 |
100 |
0 |
— |
0 |
— |
0 |
— |
5 |
100 |
ÑÂÀÎ |
9 |
1 |
11,1 |
8 |
88,9 |
4 |
44,4 |
4 |
44,4 |
1 |
11,1 |
ÑÇÀÎ |
13 |
13 |
100 |
0 |
— |
0 |
— |
0 |
— |
13 |
100 |
ÞÇÀÎ |
17 |
11 |
64,7 |
6 |
35,3 |
4 |
23,6 |
2 |
11,8 |
11 |
64,7 |
ÇÀÎ |
20 |
18 |
90 |
2 |
10 |
0 |
— |
2 |
10 |
18 |
90 |
ÖÀÎ |
34 |
16 |
47,1 |
18 |
52,9 |
11 |
32,4 |
7 |
20,6 |
16 |
47,1 |
Зеленоградский АО |
7 |
7 |
100 |
0 |
— |
0 |
— |
0 |
— |
7 |
100 |
Всего |
142 |
94 |
66,2 |
48 |
33,8 |
25 |
17,6 |
23 |
16,2 |
94 |
66,2 |
26 |
|
|
|
|
|
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 12, 2004 |
|||||

ЛЕЧЕНИЕ БОЛЕЗНИ ПАРКИНСОНА
обусловлено индивидуальной реакцией этого пациента, нечувствительностью к тремонорму, что под- черкивает необходимость постепенной взаимозамены леводопасодержащих препаратов, начиная с самых минимальных доз.
В ряде случаев недостаточная эффективность тремонорма по сравнению с предыдущим лечением проявилась усилением симптоматики, увеличением выраженности дискинезий и длительности периодов «выключения». У 23 (16,2%) пациентов это явилось причиной отмены препарата.
Далее подробно были проанализированы результаты исследования эффективности и безопасности тремонорма с учетом влияния на качество жизни у 54 пациентов с БП: 15 из них тремонорм был назна- чен впервые, 39 пациентов были переведены на тремонорм после приема накома.
Из 15 пациентов, которым впервые был назна- чен тремонорм, у одной пациентки с дрожательной формой БП препарат был отменен вследствие возникновения желудочно-кишечных побочных эффектов, остальные пациенты хорошо переносили препарат. В дальнейший анализ было включено 14 пациентов, из них 8 мужчин и 6 женщин, средний возраст
—70,6±2,6 года, средняя длительность заболевания
—2,2±1,1 года. Средняя стадия по Hoehn и Yahr 2,4±0,4 (7 пациентов находились на 2,0 стадии по Hoehn и Yahr, 4 — на 2,5 стадии, 3 — на 3,0 стадии). Из сопутствующей терапии 3 пациента принимали агонисты дофаминовых рецепторов (3 таблетки пронорана в сутки), 5 — амантадин (мидантан 3 таблетки в сутки), 2 человека — холинолитики (циклодол 2 таблетки в сутки) и амантадин (3 таблетки мидантана в сутки). По форме заболевания 2 пациента имели изолированно-дрожательную форму, 9 — смешанную дрожательно-ригидную и 3 — акинетико-ригидную форму. Средний балл по шкале MMSE составил 27,6±1,4. Средняя эффективная доза тремонорма составила 339,9±109,9 мг (от 175 мг до 500 мг/сут). В табл. 4 и 5 представлена динамика выраженности клинической симптоматики (по шкале UPDRS) и каче- ства жизни пациентов (по шкале PDQ-39) на фоне назначения тремонорма.
На фоне назначения тремонорма у этих больных (см. табл. 4) выявлено достоверное (p<0,01) улучшение
двигательных функций (по шкале UPDRS) и качества жизни пациентов практически по всем подшкалам опросника PDQ-39, характеризующим подвижность (подшкала I), активность в повседневной жизни (подшкала II), эмоциональное состояние (подшкала III), социальную поддержку (подшкала V), когнитивные функции (подшкала VI), общение (подшкала VII), общий дискомфорт (подшкала VIII). Только показатели IV подшкалы опросника, характеризующей внешние проявления болезни (stigma), не различа- лись достоверно.
Улучшение двигательных функций сопровождалось уменьшением выраженности брадикинезии, тремора покоя, ригидности аксиальной мускулатуры, улучшением походки, письма, увеличением степени самообслуживания и повседневной активности. Постепенное медленное титрование дозы позволило остановиться на минимально эффективной дозе тремонорма, что способствует более длительному периоду гарантированной эффективности без дофаминерги- ческих побочных эффектов.
Также проводился анализ клинической эффективности и влияния тремонорма на качество жизни пациентов с болезнью Паркинсона при переводе с других препаратов леводопы, содержащих леводопу и карбидопу (преимущественно, с накома). Из 40 пациентов было 23 мужчины и 17 женщин, средний возраст — 69,65±8,99 года, средняя длительность заболевания — 7,80±3,13 года. Согласно критериям включения, 4 пациента имели 2,0 стадию заболевания, 10 — 2,5 стадию, 17 — 3,0 стадию, 9 — 4,0 стадию по Hoenh и Yahr. Один пациент имел изолиро- ванно-дрожательную форму, 27 — смешанную дро- жательно-ригидную, 12 — акинетико-ригидную форму. Средний балл по шкале MMSE составил 26,5±1,5.
У 21 пациента имели место двигательные флюктуации (истощение действия однократной дозы, периоды «включения-выключения», в том числе у 6 — непредсказуемые эпизоды застывания), у 12 наблюдались дискинезии: у 7 — преимущественно хореиформные, у 5 — преимущественно дистонические.
На фоне постепенной замены препаратов леводопы/карбидопы на тремонорм у 4 пациентов наблюдались легкие временные побочные эффекты, не повлекшие за собой отмену препарата, у 6 на-
Таблица 4. Динамика клинической эффективности тремонорма по |
шкале UPDRS (II и III части) с оценкой влияния его |
|||
на качество жизни (по PDQ-39) при назначении его пациентам, не применявшим ранее препаратов леводопы |
||||
|
|
|
|
|
Показатель, баллы |
До назначения тремонорма |
После назначения |
ð |
|
(n=14) |
тремонорма (n=14) |
|||
|
|
|||
|
|
|
|
|
UPDRS II часть |
11,00±3,84 |
6,36±2,17 |
<0,01 |
|
UPDRS III часть |
26,43±11,17 |
16,36±5,00 |
<0,01 |
|
PDQ-39 подшкала I |
39,82±22,15 |
23,93±12,08 |
<0,01 |
|
PDQ-39 подшкала II |
45,54±17,62 |
31,88±8,74 |
<0,01 |
|
PDQ-39 подшкала III |
42,85±15,72 |
17,84±13,44 |
<0,01 |
|
PDQ-39 подшкала IV |
58,95±31,06 |
56,74±24,22 |
í/ä |
|
PDQ-39 подшкала V |
29,14±20,86 |
1,19±3,01 |
<0,01 |
|
PDQ-39 подшкала VI |
34,85±8,04 |
22,32±14,85 |
<0,01 |
|
PDQ-39 подшкала VII |
26,49±20,78 |
4,15±4,31 |
<0,01 |
|
PDQ-39 подшкала VIII |
48,21±17,04 |
25,61±7,64 |
<0,05 |
|
PDQ-39 Общий индекс |
40,89±10,85 |
23,13±5,85 |
<0,01 |
|
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 12, 2004 |
27 |

ЛЕЧЕНИЕ НЕРВНЫХ И ПСИХИЧЕСКИХ ЗАБОЛЕВАНИЙ
Таблица 5. Динамика клинической эффективности тремонорма по шкале UPDRS (II, III, IV части) с оценкой влияния его на качество жизни (по PDQ-39) при переводе пациентов с болезнью Паркинсона с других препаратов леводопы/карбидопы
|
Показатель, баллы |
До перевода на тремонорм |
После перевода на |
ð |
|
(n=40) |
тремонорм (n=40) |
||
|
|
|
||
|
|
|
|
|
UPDRS II часть |
18,40±6,17 |
16,65±7,55 |
í/ä |
|
UPDRS III часть |
43,35±12,42 |
42,02±15,55 |
í/ä |
|
UPDRS IV часть |
3,82±1,14 |
4,21±0,98 |
í/ä |
|
PDQ-39 подшкала I |
55,58±23,18 |
49,12±24,75 |
í/ä |
|
PDQ-39 подшкала II |
68,81±16,81 |
62,41±24,28 |
í/ä |
|
PDQ-39 подшкала III |
53,29±18,57 |
48,69±19,48 |
í/ä |
|
PDQ-39 подшкала IV |
43,14±23,63 |
41,11±18,20 |
í/ä |
|
PDQ-39 подшкала V |
40,46±16,94 |
36,05±15,40 |
í/ä |
|
PDQ-39 |
подшкала VI |
41,36±19,44 |
40,46±16,94 |
í/ä |
PDQ-39 |
подшкала VII |
34,72±17,98 |
31,93±18,40 |
í/ä |
PDQ-39 |
подшкала VIII |
39,76±20,71 |
33,49±17,82 |
í/ä |
PDQ-39 |
Общий индекс |
47,05±17,83 |
42,43±18,13 |
í/ä |
|
|
|
|
|
блюдалось увеличение длительности периодов «выключения» и усиление симптоматики, у 1 — усиление хореиформных дискинезий. Улучшение состояния на фоне замены препарата отметили 15 пациентов, у 18 состояние оставалось без изменений. Результаты обследований по клинической шкале UPDRS и вопроснику PDQ-39 представлены в табл. 5. Из таблицы видно, что замена накома на тремонорм не сопровождалась достоверным изменением (улучшением или ухудшением) симптоматики или показателей качества жизни, что может свидетельствовать о
практически одинаковом влиянии этих препаратов на симптоматику болезни Паркинсона. Вместе с тем существенная разница в их стоимости (практиче- ски в 2 раза) позволяет с более экономных позиций подойти к проблеме выбора препарата для ле- чения БП.
Очевидно, что с началом производства первого отечественного леводопасодержащего препарата тремонорма мы получили еще одно эффективное и вместе с тем относительно недорогое лекарство для ле- чения БП.
ЛИТЕРАТУРА
1.Авксентьева М.В., Воробьев П.А., Герасимов В.Б. и др. Экономи- ческая оценка эффективности лекарственной терапии (фармакоэкоэкономический анализ). М: Ньюдиамед 2000.
2.Артемьев Д.В., Яхно Н.Н. Этиология и патогенез болезни Паркинсона. Рус мед журн (спецвыпуск) 2001; 4—10.
3.Голубев В.Л., Левин Я.И., Вейн А.М. Болезнь Паркинсона и синдром паркинсонизма. М: Медпресс 1999.
4.Гусев Е.И., Гехт А.Б. Болезнь Паркинсона. Основные направления лечения. Consilium medicum 2000; 2: 67—70.
5.Захаров В.В. Когнитивные нарушения при болезни Паркинсона. Методическое пособие. Под ред. Н.Н. Яхно. М 2003.
6.Каменецкий В.К. Паркинсонизм. Ст-Петербург: Питер 2001.
7.Крыжановский Г.Н., Карабань И.Н., Магаева С.В. и др. Болезнь Паркинсона. М: Медицина 2002.
8.Чикина Е.С. Клинические, фармакоэкономические аспекты болезни Паркинсона и оценка качества жизни больных при применении агонистов дофаминовых рецепторов: Автореф. дис.
...…êàíä. ìåä. íàóê. Ì 2004.
9.Яхно Н.Н., Нодель М.Р. Современные принципы терапии болезни Паркинсона. Рус мед журн 2000; 8: 418—425.
10.CONTINUUM. A programm of the American Academy of Neurology. Parkinson’s Disease 1995; 1: 4: 1—169.
11.Fahn S., Elton R.L., members of the UPDRS Development Committee. Unified Parkinson’s disease rating scale. In: Recent developments in Parkinson’s disease. In: S. Fahn, C.D. Marsden, D.B. Calne et al. (eds.). Florham Park, NJ: MacMillan Health Care Information 1987; 153—163.
28
12.Folstein M.F., Folstein S.E., McHugh P.R. Mini-mental state: a practical method for grading the mental state of patients for the clinicians. J Psychiat Res 1975; 12: 189—198.
13.Hoehn M.M., Yahr M.D. Parkinsonism: onset, progression and mortality. Neurology 1967; 17: 427—442.
14.Jenkinson C., Fitzpatrick R., Norquist J. et al. Cross-cultural evaluation of the Parkinson’s Disease Questionnaire: tests of data quality, score reliability, response rate, and scaling assumptions in the United States, Canada, Japan, Italy, and Spain. J Clin Epidemiol 2003;
56:9: 843—847.
15.Martinez-Martin P. Conversion to controlled-release levodopa/carbidopa treatment and quality of life as measured by the Nottingham Health Profile. The STAR Study Group. Neurology 1999; 14: 338—343.
16.Obesso J.A., Rodriguez-Oroz M.C., Rodriguez M. et al. Pathophysioligy of the basal ganglia in Parkinson’s disease. Trends Neurosc 2000;
23:8—19.
17.Olanow C.W., Watts R.L., Koller W.C. An algorithm (decision tree) for management of Parkinson’s disease (2001): treatment guidelines. Neurology 2001; 56: Suppl 5: 1—88.
18.Peto V., Jenkinson C., Fitzpatrick R., Greenhall R. The development and validation of a short measure of functioning and well being for individuals with Parkinson’s disease. Qual Life Res 1995; 4: 241— 248.
19.Peto V., Jenkinson C., Fitzpatrick R. Determining minimally important differences for the PDQ-39 Parkinson’s Disease Questionnaire. Age Ageing 2001; 30: 299—302.
20.Waters C.H. Diagnosis and management of Parkinson’s disease. 2002; 1—240.
Поступила 13.09.04
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 12, 2004
