
Журнал неврологии и психиатрии / 2007 / NEV_2007_02_01
.pdf
КЛИНИКА НЕРВНЫХ И ПСИХИЧЕСКИХ ЗАБОЛЕВАНИЙ
Опсоклонус-миоклонус синдром у детей
Р.Ц. БЕМБЕЕВА, А.С. ПЕТРУХИН, А.А. БОЛОГОВ, Л.В. БАЙДУН, Е.С. ИЛЬИНА, М.В. САМОЙЛОВА, Л.М. КОЛПАКЧИ, Л.И. СЕМЫКИНА, И.Д. ФЕДОНЮК
Opsoclonus-myoclonus syndrome in children
R.TS. BEMBEEVA, A.S. PETRUKHIN, A.A. BOLOGOV, L.V. BAIDUN, E.S. IL’INA, M.V. SAMOILOVA, L.M. KOLPAKCHI, L.I. SEMYKINA, I.D. FEDONYUK
Российский государственный медицинский университет; Российская детская клиническая больница, Москва
Целью исследования были изучение клинических особенностей параинфекционного опсоклонус-миоклонус синдрома (ОМС) у детей и разработка подходов к его медикаментозной коррекции. Наблюдали 20 детей — 12 девочек и 8 мальчиков. При их обследовании использовали неврологический, нейрофизиологический, иммунологический и вирусологический методы, МРТ. Заболевание у обследованных детей дебютировало в возрасте от 8 мес до 3 лет. Возникновение неврологической симптоматики было связано с перенесенным вирусным заболеванием (55% наблюдений) или вакцинацией (15%). Отмечена выраженная сезонность заболевания (осень, весна). В ряде случаев данными вирусологических и иммунологических исследований была подтверждена возможная роль инфекционного фактора в развитии болезни. Особенностью изучавшейся патологии были отсутствие специфиче- ских изменений при МРТ головного мозга, а также редкость выраженных отклонений в спинномозговой жидкости. Изложен положительный опыт применения гормональной терапии и иммуномодуляторов.
Ключевые слова: опсоклонус-миоклонус синдром, энцефалопатия Кинсбурна, миоклоническая энцефалопатия, острая мозжечковая энцефалопатия, клинические проявления, патогенез, лечение.
To study clinical peculiarities of parainfectious opsoclonus-myoclonus syndrome (OMS) in children and to elaborate approaches to its pharmacotherapeutic correction, 20 children, including 12 girls and 8 boys, have been examined using neurological, neurophysiological, immunological and virological methods along with magnetic resonance tomography (MRT). Age-at-disease-onset was from 8 months to 3 years old. The development of neurological symptoms was related to a virus infection (55% of cases) or vaccination (15%). Marked disease seasonality (autumn, spring) was observed. In some cases, a possible role of infectious factor in the disease development was confirmed by virological and immunological studies. OMS was featured by the absence of specific brain MRT changes and low frequency of significant abnormalities of cerebrospinal fluid. A positive experience of the use of hormonal therapy and immunomodulators is presented.
Key words: opsoclonus-myoclonus syndrome, Kinsbourne syndrome, myoclonic encephalopathy, acute cerebellum encephalopathy, clinical presentations, pathogenesis, treatment.
Опсоклонус1-миоклонус синдром (ОМС) — аутоиммунное заболевание ЦНС с преимущественным поражением мозжечка и его связей, проявляющееся тяжелым нарушением нервно-психического развития.
ОМС был описан в 1962 г. P. Sandifer и одновременно M. Kinsburne [13], который сообщил о 6 пациентах в возрасте 9—20 мес с нарушением координации, миоклониями и хаотичными движениями глаз. Следует отметить, что несколько сходных наблюдений ранее были представлены в литературе. Так, E. Fernandes-Alvares и J. Aicardi [11] указывают, что такие случаи были описаны Cogan в 1954 г. и Arthuis в 1960 г., но они тогда рассматривались в структуре энцефалита и полиомиелита.
ОМС известен под разными названиями: энцефалопатия Кинсбурна, миоклоническая энцефалопатия [13], синдром «танцующих глаз» [8], инфантильная полимиоклония [9], острая мозжечковая энцефалопатия [6], опсоклонус-миоклонус-атаксия синдром [7].
Распространенность ОМС, в том числе у детей, неизвестна. В России опубликовано лишь несколько работ, посвященных паранеопластическому ОМС [1, 3]. Заболевание практически незнакомо педиатрам и часто не диагностируется. В последние годы в связи с общей тенденцией к росту аутоиммунных заболеваний этот синдром стал регистрироваться чаще.
В нашей предыдущей статье [2] был представлен обзор литературы, касающейся ОМС. В настоящей
© Коллектив авторов, 2007 |
1 Термин «опсоклонус» (греч. ops — глаз, klonos — беспорядоч- |
|
ные движения) предложил в 1913 г. польский невролог |
Zh Nevrol Psikhiatr Im SS Korsakova 2007;107:2:4—11 |
K. Orzechowski. |
4 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 2, 2007 |
публикации дается анализ собственных клинических наблюдений пациентов с параинфекционным ОМС, проведенных на клинических базах кафедры нервных болезней педиатрического факультета РГМУ в 1998— 2005 гг.
Целью исследования явились изучение клиниче- ских особенностей параинфекционного ОМС у детей и разработка методов его медикаментозной коррекции.
Материал и методы
Наблюдали 20 детей с параинфекционным ОМС
—12 девочек и 8 мальчиков (соотношение 1,5:1). Общая длительность их наблюдения составила в среднем 12,05±2,57 мес.
Во всех случаях проводились неврологическое, нейрофизиологическое, нейрорадиологическое, иммунологическое и вирусологическое исследования. Учитывали демографические и анамнестические данные, клинические симптомы в дебюте и в динамике развития заболевания.
Для оценки тяжести состояния больных использовали шкалу оценки двигательной функции при ОМС, описанную M. Pranzatelli и соавт. [16]. Каждый ее пункт предусматривает оценку соответствующих нарушений от 1 до 3 баллов: 0 — норма, 1 — легкая степень, 2 — средняя, 3 — тяжелая. Сумма от 0 до 12 баллов соответствует легкой степени тяжести (I степень), от 13 до 24 баллов — средней (II степень), от 25 до 36 баллов — тяжелой (III степень). Включенные в шкалу признаки отражены в табл. 1.
Для исключения текущей нейроинфекции проводилось лабораторное исследование биологических жидкостей (кровь, слюна, моча, спинномозговая жидкость
—СМЖ) с помощью полимеразной цепной реакции (ПЦР) и иммуноферментного анализа (ИФА) на на-
личие различных возбудителей (HSV1,2,6; CMV; EBV; VZV; Mycoplasma hominis). По показаниям проводилось
также расширенное серологическое обследование для выявления коревой и краснушной инфекции.
С целью исключения наследственных болезней обмена веществ, имеющих сходную клиническую симптоматику, осуществлялись специфические биохимические исследования в лаборатории наследственных болезней обмена веществ Медико-генетического научного центра РАМН.
Анализ мембранных маркеров лимфоцитов проведен методом прямой двухцветной иммунофлюоресценции и проточной цитофлуориметрии с использованием проточного цитофлуориметра ALTRA (Beckman Coulter) c использованием моноклональных антител (IMMUNOTECH) в цитологической клиниче- ской лаборатории Российской детской клинической больницы.
Результаты и обсуждение
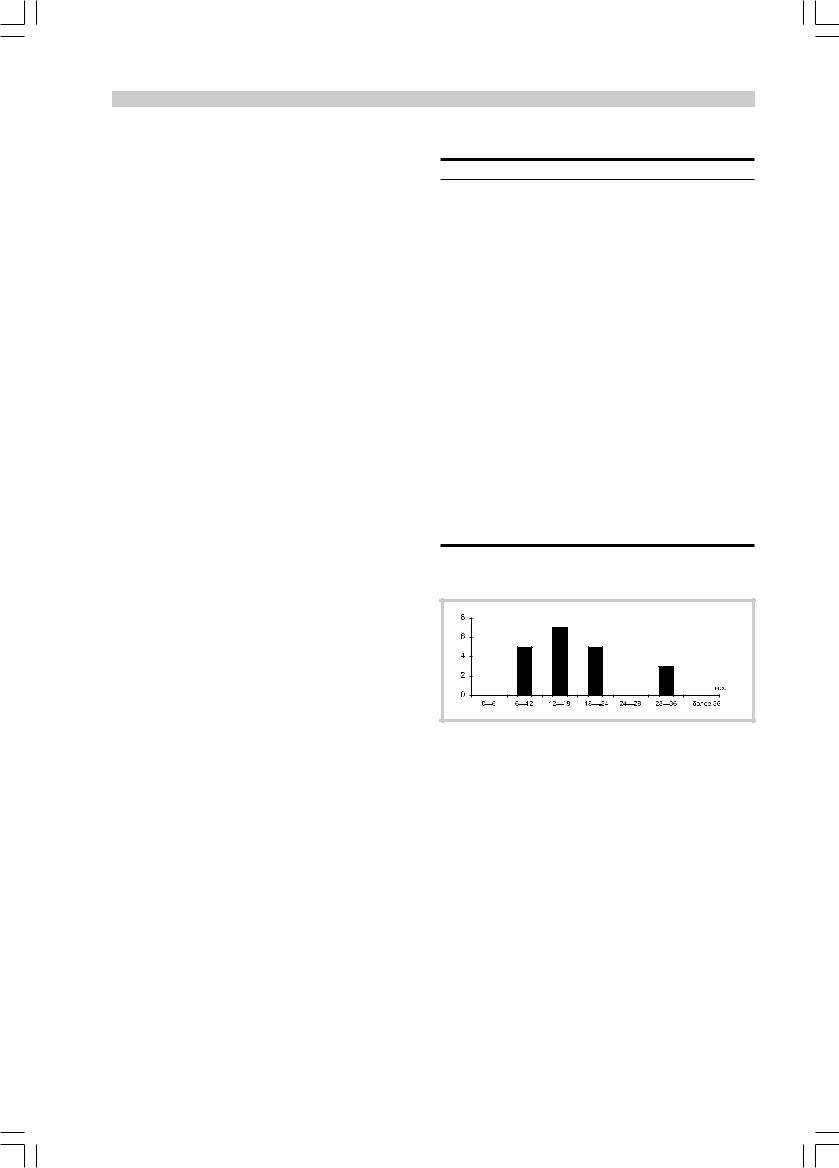
Возраст больных к моменту появления первых клинических симптомов составлял 16 мес (1,45±0,15 года) — от 8 мес до 3 лет (рис. 1).
Заболевание чаще возникало осенью — у 9 (45%) детей и весной — у 6 (30%), реже зимой — у 2 (10%) и летом — у 3 (15%) (рис. 2).
ОПСОКЛОНУС-МИОКЛОНУС СИНДРОМ У ДЕТЕЙ |
||||
Таблица 1. Шкала оценки двигательной функции при опсо- |
||||
клонус-миоклонус синдроме |
|
|
|
|
Признак |
|
|
Баллы |
|
При ходьбе пошатывание из |
0 |
1 |
2 |
3 |
стороны в сторону |
|
|
|
|
При ходьбе пошатывание |
0 |
1 |
2 |
3 |
вперед-назад |
|
|
|
|
Неустойчивая походка на |
0 |
1 |
2 |
3 |
широко расставленных ногах |
|
|
|
|
Неустойчиво стоит |
0 |
1 |
2 |
3 |
Трудности достижения позиции |
0 |
1 |
2 |
3 |
стояния из положения сидя |
|
|
|
|
Нестабильность туловищная, |
0 |
1 |
2 |
3 |
когда сидит |
|
|
|
|
Затруднения при тонких |
0 |
1 |
2 |
3 |
движениях |
|
|
|
|
Затруднения при захвате одной |
0 |
1 |
2 |
3 |
рукой |
|
|
|
|
Затруднения при захвате двумя |
0 |
1 |
2 |
3 |
руками |
|
|
|
|
Опсоклонус при фиксации |
0 |
1 |
2 |
3 |
взора |
|
|
|
|
Опсоклонус в покое |
0 |
1 |
2 |
3 |
Дизартрия |
0 |
1 |
2 |
3 |
Примечание. По результатам обследования определяется соответст- |
||||
вующая величина баллов и они суммируются. |
|
|
|
|
Рис. 1. Распределение больных по возрасту к моменту появ- |
||||
ления первых симптомов при ОМС. |
|
|
|
|
Здесь и на рис. 2: по оси ординат — число случаев. |
|
|||
Наличие вирусного продрома отмечено в 11 (55%) случаях, развитие синдрома после вакцинации — в 3 (15%), после легкой черепно-мозговой травмы — у 1 (5%) ребенка.
Более подробно соответствующие данные представлены в табл. 2. Период между действием указанных факторов (период последействия фактора) составил в среднем 12,6±3,52 дня.
Семейных случаев заболевания не было, и оно оказалось спорадическим в 100% случаев.
Среди сопутствующих заболеваний можно отметить только аллергические состояния, которые имелись у 5 (25%) детей. Но у большинства детей — 17 (85%) в анамнезе отмечалось гипоксическое повреждение головного мозга перинатального генеза легкой и средней степени тяжести. Ранее 17 (85%) детей переносили также острые респираторно-вирусные ин-
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 2, 2007 |
5 |

КЛИНИКА НЕРВНЫХ И ПСИХИЧЕСКИХ ЗАБОЛЕВАНИЙ
Рис. 2. Распределение больных в зависимости от месяца заболевания.
Таблица 2. Состояния, предшествовавшие развитию |
ÎÌÑ |
||
в наблюдавшихся случаях |
|
|
|
|
|
||
Нозологическая форма |
Kоличество пациентов |
||
|
|
||
àáñ. |
% |
||
|
|||
|
|
|
|
Острая респираторная вирусная |
10 |
50 |
|
инфекция |
|
|
|
Грипп |
1 |
5 |
|
Вакцинация |
3 |
15 |
|
Черепно-мозговая травма |
1 |
5 |
|
|
|
|
|
фекции, 3 (15%) ребенка болели ветряной оспой, 2 (10%) — пневмонией.
Психомоторное развитие детей до возникновения настоящего заболевания во всех случаях соответствовало возрасту.
Начало ОМС было острым в 18 (90%) случаях, подострым — в 2 (10%). Полная клиническая симптоматика разворачивалась при остром начале заболевания в период от 1—2 нед, при подостром дебюте — в течение 4 мес.
Клиническая картина ОМС
Уже в продромальном периоде заболевания родители замечали нарушения поведения у детей: повышенную возбудимость, агрессивность (у 17 пациентов, 85%), нарушения сна — выраженную сонливость (у 8, или 40%) либо бессонницу (у 4, т.е. 19%). С момента дебюта заболевания у 18 (90%) больных отмечалась также выраженная гиперсаливация.
Неврологические симптомы обычно появлялись на 1—2-й неделе продрома. Отмечались частые падения и шаткость походки, затем присоединялся тремор головы, туловища и конечностей, усиливавшийся при малейшем беспокойстве ребенка, переходе из горизонтального положения в вертикальное, при пробуждении. Атаксия и тремор наблюдались в дебюте заболевания у всех больных. Одновременно или несколькими днями позже появлялся опсоклонус — миоклонии глазных мышц в виде непроизвольных неритмичных (беспорядочных), но сопряженных, быстрых, иногда сгруппированных в серии движений глазных яблок, идущих с неправильным интервалом («порхание глаз», «танцующие глаза»). Опсоклонус
наблюдался в 19 случаях из 20 (95%) и являлся основным патогномоничным признаком ОМС. Он усиливался при утомлении, возбуждении, фиксации взгляда и сохранялся во время сна, часто сочетался с миоклониями век. Миоклонии носили полиморфный характер, но наиболее характерными были короткие, быстрые, с небольшой амплитудой. Миоклонии вовлекали преимущественно мышцы век, губ, туловища и проксимальных отделов конечностей. Они чаще наблюдались при движении и усугублялись беспокойством, но могли быть и в покое. Усиление миоклоний иногда достигало «двигательной бури», и такое состояние напоминало эпилептический приступ. Так, один из пациентов до госпитализации в нашу клинику лечился противосудорожными препаратами в связи с ошибочным диагнозом эпилепсии.
Âпериод развернутой клинической картины ОМС дети не могли сидеть, стоять или ходили с поддержкой на широко расставленных ногах вследствие атаксии. При переходе из горизонтального положения в вертикальное усиливались генерализованный тремор
èмиоклонии в ногах («танцующие ноги»). Манипуляции предметами были нарушены вследствие интенционного тремора и миоклоний (миоклонии намерения).
У 12 (60%) детей отмечалась мышечная дистония в конечностях, которая приводила к неправильной установке стопы при ходьбе, или дистония шейных мышц (легкий наклон головы при ходьбе). Но элементы торсионной дистонии не прогрессировали, носили локальный характер и довольно быстро проходили.
Âбольшинстве наблюдений у детей отмечалась мышечная гипотония.
На момент обследования по шкале оценки двигательных функций тяжесть состояния пациентов соответствовала 24,25±1,54 балла, при этом I степень тяжести нарушений была выявлена у 2 (10%), II степень — у 7 (35%), III степень — у 11 (55%).
Таким образом, у 85% наблюдавшихся больных была II и III степень тяжести двигательных нарушений.
Из черепных нервов в патологический процесс вовлекались глазодвигательные — VI у 9 (45%) детей
èIII у 6 (30%). Центральное поражение VII и ХII че- репных нервов отмечено у 10 (50%) пациентов.
Отмечались также нарушения в эмоциональноволевой сфере.
6 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 2, 2007 |

Таблица 3. Показатели СМЖ у больных с ОМС
Признак |
Процент |
Средний |
|
детей |
показатель |
||
|
|||
|
|
|
|
Цитоз, число клеток в 1 мм3 |
|
|
|
(норма 0—5): |
|
|
|
5 и менее |
40 |
18,44±12,99 |
|
6—11 |
53 |
|
|
15 и более |
7 |
|
|
Белок, г/л (норма 0,08—0,42): |
|
|
|
0,18 и менее |
53 |
0,27±0,05 |
|
0,19—0,25 |
13 |
|
|
0,26 и более |
33 |
|
|
Глюкоза, ммоль/л |
|
|
|
(норма 2,78—3,89): |
|
|
|
2,78 |
40 |
2,75±0,26 |
|
2,78—3,89 |
53 |
|
|
более 3,89 |
7 |
|
|
IgG, мг/дл (норма 0,5—6,1) |
|
0,99±0,02 |
|
|
|
|
Нарушения поведения в отличие от двигательных сохранялись и в периоды длительной ремиссии. Дети были гиперактивны, раздражительны, для них были характерны приступы ярости, агрессия по отношению к окружающим и аутоагрессия. Отмечены следующие типы нарушения поведения: гиперактивность (75%), дефицит внимания (42%), приступы ярости (8%), обсессивно-компульсивные расстройства (4%).
С началом заболевания у детей происходили задержка, а иногда и регресс в речевом развитии.
Течение ОМС
Течение заболевания во всех случаях было хроническим с ремиссиями и обострениями (мультифазное). Обострения, как правило, провоцировались вирусными инфекциями (60%), вакцинацией (5%), лихорадкой (10%) или стрессом (10%). Другой причи- ной обострений являлась преждевременная отмена терапии, в частности быстрая отмена гормональных средств (20%). Частота обострений за период наблюдения (12 мес) составила 3,16±0,4. Одно обострение было у 16% пациентов, два-три — у 52%, более четырех — у 32%.
Полное выздоровление можно было констатировать только в одном случае (5%), у 90% состояние улучшилось и у одного (5%) лечение оказалось неэффективным.
Выше уже говорилось о том, что тяжесть состояния больных, оценивавшаяся по степени нарушения двигательных функций, при поступлении в стационар составляла 24,25±0,14 балла, что соответствовало II—III степени; при последнем осмотре она составила 13,85±2,10 балла, т.е. I—II степени.
Результаты лабораторных исследований
Вирусологическое исследование было проведено 15 детям в начальном периоде заболевания с приме-
ОПСОКЛОНУС-МИОКЛОНУС СИНДРОМ У ДЕТЕЙ
нением ПЦР и ИФА в биологических жидкостях на наличие различных возбудителей — вирусов герпеса, цитомегаловируса и др. При этом положительный результат анализа крови методом ПЦР на HSV1,2 был получен в двух случаях, на CMV — в одном, на HSV6
— в одном. Данные серологических исследований не подтвердили инфекционного характера текущего патологического процесса.
Основные результаты исследования СМЖ в дебюте заболевания (у 15 детей) приведены в табл. 3.
У 14 (93%) детей цитоз был в пределах возрастной нормы и только у одного ребенка повышен до 200 клеток в 1 мм3, по составу являлся лимфоцитарным. Среднее содержание белка в СМЖ составило 0,27±0,05 г/л (от 0,12 до 0,32 г/л), содержание глюкозы — 2,75±0,26 г/л (от 1,8 до 4,5 г/л). Уровень глюкозы был в пределах нормы у 14 (93%) детей и у одного (7%) слегка повышен (4,5 г/л), содержание IgG в СМЖ (0,99±0,02 мг/дл) находилось в пределах нормальных величин, диапазон варьировал в пределах 0,92—1,04 мг/дл.
Проведенные исследования дают основания предполагать, что для ОМС нехарактерны какие-либо существенные изменения показателей СМЖ, клеточ- но-белковая диссоциация может встречаться, но это не является правилом.
Определение содержания общего IgG в СМЖ при ОМС не отражало в достаточной мере активности патологического процесса. По всей вероятности, необходимо с диагностической целью оценивать другие фракции IgG, в частности олигоклональные полосы.
Иммунологические исследования. Уровень сывороточных иммуноглобулинов исследовали у 10 больных. У 7 он был нормальным, лишь у одного отмечалось повышение содержания IgA до 260 мг/дл и у двух небольшое повышение уровня IgG (15,8 мг/дл). Среднее содержание сывороточных иммуноглобулинов было в пределах нормы: IgA — 61,16±28,56 мг/дл; IgM — 3,97±0,92 мг/дл; IgG — 11,8±1,42 мг/дл.
Иммунофенотипирование субпопуляций лимфоцитов крови проведено 9 детям с ОМС (табл. 4).
Средние абсолютные значения большинства показателей ИФА были в пределах нормы, но отмечена тенденция к снижению абсолютного содержания CD3+, CD3+CD4+, низкой величине соотношения CD4/CD8. Детальный анализ гематологических показателей и особенностей популяционного состава лимфоцитов показал гетерогенность изменений в отношении как абсолютного содержания лимфоцитов, так и их популяционного состава: у 4 больных отмеча- лась лимфоцитопения без выраженных изменений структуры популяции лимфоцитов, у 2 больных содержание лимфоцитов в крови превышало возрастную норму, в субпопуляции лимфоцитов при этом отме- чалось повышение CD19 (B-лимфоцитов). В последних случаях интерес вызывает корреляция клиниче- ского улучшения состояния больных с нормализацией содержания В-лимфоцитов в крови на фоне терапии (см. описание приведенного ниже клинического наблюдения).
МРТ головного мозга. Она была проведена 15 детям. У большинства (87%) изменений не было выявлено. Только у двух (13%) при исследовании в стан-
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 2, 2007 |
7 |

КЛИНИКА НЕРВНЫХ И ПСИХИЧЕСКИХ ЗАБОЛЕВАНИЙ
Таблица 4. Результаты иммунофенотипирования лимфоцитов периферической крови при ОМС
Популяция лимфоцитов |
Kоличество позитивных клеток (M±m) |
Возрастная норма [10] |
|||
|
|
|
|
||
% |
àáñ. |
% |
àáñ. |
||
|
|||||
|
|
|
|
|
|
CD3+ |
57,05±3,18 |
1,86±0,17 |
65 (50—73) |
4,4 (2,3—5,9) |
|
CD3+CD4+ |
31,05±1,93 |
1,01±0,1 |
50 (30—62) |
3,2 (1,5—5,0) |
|
CD3+CD8+ |
20,11±2,49 |
0,59±0,07 |
16 (8—34) |
1,0 (0,6—1,5) |
|
CD4/CD8 |
1,2±0,11 |
— |
2,9 (1,8—7,0) |
— |
|
CD3+HLA-DR+ |
1,11±0,13 |
0,08±0,03 |
3 (2—7) |
0,1 (0,1—0,3) |
|
CD3+TCR α/β+ |
— |
5,5±0,97 |
— |
4,0 (2,0—5,8) |
|
CD3+TCR γ/δ+ |
— |
0,2±0,08 |
— |
0,2 (0,1—0,3) |
|
CD(16+56)+CD3 |
14,33 ±1,34 |
0,27±0,08 |
6 (3—11) |
0,4 (0,3—0,9) |
|
CD19 |
25,51±2,06 |
1,29±0,32 |
28 (19—36) |
1,7 (1,2—2,8) |
|
|
|
|
|
|
|
Примечание. Приведенные абсолютные значения показателя нужно увеличить (½109).
дартных импульсных последовательностях SE и FSE |
дии от 146 до 196 в минуту. Нестабильность процес- |
|
и на T1- и T2-взвешенных изображениях в аксиаль- |
сов реполяризации в миокарде наблюдалась у 2 (29%) |
|
ной, коронарной и сагиттальной проекциях на фоне |
детей, у одного из них выявлен синдром ранней ре- |
|
общей структурной нормы и компенсированной ли- |
поляризации желудочков. Обнаруженные изменения |
|
квородинамики отмечалась недостаточная степень |
можно расценить как проявления функциональной |
|
миелинизации белого вещества — проявление струк- |
кардиопатии вследствие вегетативной дисфункции. Но |
|
турной незрелости мозга. При этом у одного больного |
эта группа детей требует дальнейшего углубленного |
|
(7%) это сочеталось с наличием изоинтенсивного на |
изучения кардиологов для выяснения других возмож- |
|
Т1-взвешенном изображении ограниченного очага |
ных причин кардиопатии, встречающейся при ОМС. |
|
повышения Т2-сигнала размером 3½6 мм, локализо- |
Специфическая терапия (назначение антиаритмиче- |
|
ванного в подкорковых ядрах слева по латеральному |
ских препаратов) потребовалась только одному ре- |
|
контуру центральных отделов заднего бедра левой |
бенку. |
|
внутренней капсулы. При повторной (спустя 6 мес) |
Лечение ОМС |
|
МРТ головного мозга у этого ребенка очаговых изме- |
||
|
||
нений не выявлялось. |
Поскольку ОМС является редким заболеванием |
|
Электроэнцефалография, проведенная 16 детям, |
с неустановленными этиологией и патогенезом, к |
|
ни у одного из них не обнаружила локальной, диф- |
настоящему времени не разработано стандартизиро- |
|
фузной или генерализованной эпилептиформной ак- |
ванных схем его терапии. Для его лечения применяют |
|
тивности. Отмечались лишь функциональные изме- |
адренокортикотропный гормон, кортикостероиды, |
|
нения биоэлектрической активности с органическим |
цитостатики (азатиоприн, циклофосфамид), плазма- |
|
компонентом в виде диффузного замедления ритми- |
ферез, IgG внутривенно [2]. Основанием для назна- |
|
ки и нарушения физиологического электрогенеза в |
чения кортикостероидов является их способность |
|
10 (63%) случаях, выраженных ирритативных нару- |
снижать воспаление, уменьшать отек, стабилизиро- |
|
шений биоэлектрической активности в височных от- |
вать гематоэнцефалический барьер, что способствует |
|
делах в 6 (37%). |
уменьшению дальнейшего притока активных иммун- |
|
При электронейромиографии, проведенной 11 |
ных клеток и гуморальных факторов, способствую- |
|
детям, у 10 (91%) определялось нарушение регуля- |
щих демиелинизации. В литературе обсуждаются пре- |
|
ции мышечного тонуса по надсегментарному типу. У |
имущества высоких и низких доз, а также короткого |
|
3 (27%) на этом фоне отмечались субклинические |
и длительного курсов кортикостероидной терапии [18]. |
|
изменения показателей по типу демиелинизирующей |
В нашей клинической практике при коротком |
|
полиневропатии. У 2 (18%) детей, получавших гор- |
курсе кортикостероидной терапии отмечены рециди- |
|
мональную терапию, был выявлен первично-мышеч- |
вы заболевания. С целью предупреждения обострения |
|
ный характер поражения, возможно, обусловленный |
процесса и с учетом спектра действия иммуноглобу- |
|
развитием субклинической стероидной миопатии |
линов (противовоспалительный, нейтрализация ау- |
|
вследствие длительного приема гормонов. |
тоантител, активированного комплемента, угнетение |
|
Электрокардиография. Необходимость в ее прове- |
В-клеточной пролиферации) данных типирования |
|
дении — 7 (35%) случаев определялась изменением |
субпопуляций лимфоцитов крови пациентов с ОМС |
|
ритма и частоты сердечных сокращений, выявлен- |
мы сочли целесообразным проведение длительного |
|
ном при аускультации. У одного ребенка имели место |
курса кортикостероидной терапии в сочетании с им- |
|
частые желудочковые, редкие суправентрикулярные |
муномодулирующей. |
|
экстрасистолы (максимально 38 в минуту), у 5 (71%) |
В острой фазе ОМС при II степени тяжести при- |
|
отмечалась синусовая аритмия с периодами тахикар- |
меняли преднизолон в дозе 1,5—2 мг/кг для купиро- |
8 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 2, 2007 |

вания неврологических симптомов (обычно на это требовалось 2—3 нед), затем назначали иммуноглобулин IgG внутривенно в дозе 2 г/кг на курс капельно — одна инфузия в месяц в течение 3—6 мес в зависимости от выраженности клинических проявлений и показателей ИФА субпопуляций лимфоцитов. Снижение преднизолона проводили медленно (по 1,25 мг — 1/4 таблетки в 7—10 дней). Препарат способствовал снижению частоты интеркуррентных (инфекционных) заболеваний, предотвращая тем самым повторные обострения ОМС, и стабилизировал состояние больных.
При первых признаках клинического рецидива возвращались к предыдущей дозе гормонов и не снижали ее до полного купирования обострения. В среднем период лечения кортикостероидами продолжался от 6 до 8 мес. Такая схема была применена у 3 детей со средней тяжестью по шкале ОМС, при которой, по данным литературы, высока частота рецидивов [18]. У одного ребенка наступило полное выздоровление, у двух — отчетливое улучшение состояния (в настоящий момент эти дети находятся в стадии длительной клинической ремиссии).
Приводим одно из наших клинических наблюдений.
Больная Ш. — 1 года 3 мес. Клинический диагноз: ОМС (энцефалопатия Кинсбурна).
Анамнез жизни: ребенок от первой нормально протекавшей беременности, родился в срок. Масса тела при рождении 2850 г, длина тела 49 см, оценка по шкале Апгар при рождении 7—10 баллов. До настоящего заболевания психомоторное развитие соответствовало возрасту.
Анамнез заболевания: заболела в возрасте 1 года. С 28.05 по 02.06.04 отмечались признаки ОРВИ (умеренные катаральные проявления в зеве, повышение температуры тела до фебрильных цифр). Температура оставалась фебрильной в течение 3 дней, затем нормализовалась и самочувствие ребенка улучшилось. В период выздоровления девочка была искусана комарами, отмечался отек лица (по типу отека Квинке). 05.06 появились выраженная вялость, однократная рвота, нистагмоидные подергивания глазных яблок, которые постепенно усилились по амплитуде, частоте и продолжительности; через 2 дня присоединились атаксия, тремор рук, головы, туловища, что сочеталось с нарушением поведения — появились капризность, возбудимость, затем выраженная сонливость. Ребенок был госпитализирован в Детскую городскую клиническую больницу ¹1 Москвы с подозрением на стволовой энцефалит.
Результаты проведенных исследований: общий анализ крови без патологии; результаты исследования биологиче-
ских жидкостей методами ИФА и PCR на HSV1,2,6, EBV, CMV, Mycoplasma hominis отрицательные. Анализ СМЖ: про-
зрачная, цитоз 7/3 (лимфоцитов 3, нейтрофилов 4), белок 0,16 г/л, глюкоза 4,5 ммоль/л; посев роста не дал. МРТ головного мозга с контрастированием: патологии не выявлено. Иммунный статус от 18.06.04 (табл. 5): абсолютное содержание лимфоцитов превышает возрастную норму (68%), при этом в их популяции отмечалось снижение содержания общих Т-лимфоцитов (CD3+) и супрессорно-цитотоксиче- ских Т-лимфоцитов (CD8+), повышение абсолютного и относительного содержания CD19 (В-лимфоцитов).
Проводилась симптоматическая терапия: дексазон 2 мг 4 раза в сутки внутривенно в течение 5 дней с переходом на преднизолон per os. На фоне гормональной терапии отме- чено значительное улучшение состояния; через 2 нед дозу преднизолона стали снижать по 2,5 мг в неделю. Опсоклонус исчез, сохранялись единичные миоклонии мимических
ОПСОКЛОНУС-МИОКЛОНУС СИНДРОМ У ДЕТЕЙ
мышц, девочка начала вставать в кровати и ходить с поддержкой.
После непродолжительной ремиссии она вновь заболела ОРВИ (это совпало с отменой преднизолона). Через несколько дней отмечен рецидив заболевания. По причине тяжелого состояния ребенок госпитализирован в Российскую детскую клиническую больницу.
При поступлении в РДКБ: состояние тяжелое; непостоянная субфебрильная температура тела; выраженная вялость, общая слабость и раздражительность; общемозговых и менингеальных симптомов нет; разнонаправленный нистагм глазных яблок с ротаторным компонентом, миоклонии век, мышц лица, головы, туловища, конечностей; тремор рук, усиливающийся при беспокойстве. Самостоятельно не стоит, не ходит. Диффузная мышечная гипотония. Сухожильные рефлексы оживлены, анизорефлексия S>D. Патологических рефлексов не выявлено. Гипергидроз ладоней и стоп. Гиперсаливация.
Данные лабораторных исследований: общий анализ крови без патологии; биохимический анализ крови без патологии.
С целью исключения паранеопластического ОМС были проведены дополнительные исследования. При МРТ признаков наличия объемных образований в заднем средостении, забрюшинном пространстве не выявлено. При УЗИ органов брюшной полости и забрюшинного пространства, органов малого таза, тимуса, щитовидной железы изменений также не выявлено. Данных о наличии нейрогенной опухоли не получено. Исследование крови на наличие болезней обмена веществ методом тандемной масс-спектро- метрии: данных о наличии наследственных аминоацидопатий и органической ацидурии не получено. Анализ мочи на катехоламины: адреналин 0,02 (норма 0—3,5), норадреналин 0,2 (норма 1,0—1,7), дофамин 1,79 (норма 10—140). Результаты исследования крови на вирусы кори и краснухи отрицательные.
Была назначена гормональная терапия: солу-мидрол 180 мг внутривенно в течение 3 дней, затем метипред 16 мг/сут внутрь. На фоне лечения отмечена значительная положительная динамика: нивелирование неврологической симптоматики — опсоклонуса, миоклоний, тремора, атаксии, нормализация поведения, улучшение психоэмоционального фона.
Выписана домой с рекомендацией приема метипреда (16 мг/сут) при постепенном снижении дозы.
Девочка стала самостоятельно ходить, миоклонии и атаксия купировались полностью.
В ноябре 2004 г. на фоне снижения дозы гормонов до 2,5 мг и заболевания ринофарингитом и лакунарной ангиной состояние больной вновь ухудшилось: появились миоклония, опсоклонус и признак торсионной дистонии (при ходьбе элементы мышечной торсии — наклон туловища и головы вправо и приведение правой стопы внутрь). Дозу метипреда вновь увеличили до 1 мг/кг и начали вводить иммуноглобулин (октагам — 2 г/кг на курс в течение 3 дней). Введение октагама повторяли ежемесячно на протяжении 4 мес. Снижение дозы гормонов (по 1/4 таблетки в неделю до критической дозы, затем по 1/8 таблетки в 7—10 дней) на- чали при полной стабилизации неврологического статуса и на фоне введения октагама. Отмена гормональной терапии проводилась в течение 7 мес после второго рецидива. Побочных явлений гормональной терапии не отмечено.
Ребенок наблюдается после полного восстановления здоровья и отмены терапии на протяжении 12 мес. В дальнейшем обострений заболевания не отмечалось.
Приведенное наблюдение отражает наш первый опыт лечения ребенка с тяжелым ОМС под контролем иммунного статуса. Иммуномониторинг проводился для определения длительности иммуномодулирующей терапии и предупреждения очередного обо-
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 2, 2007 |
9 |

КЛИНИКА НЕРВНЫХ И ПСИХИЧЕСКИХ ЗАБОЛЕВАНИЙ
Таблица 5. Показатели иммунофенотипирования лимфоцитов в процессе лечения
|
|
Kоличество позитивных клеток |
|
Возрастная норма |
||||
Популяция |
|
|
|
|
|
|
||
18.06.04 |
30.03.05 |
|
20.07.05 |
(1 ãîä) |
||||
лимфоцитов |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
% |
àáñ.½109 |
% |
àáñ.½109 |
% |
àáñ.½109 |
% |
àáñ.½109 |
CD3+ |
46,5↓ |
3,1 |
46,0↓ |
1,0 |
64,0 |
3,6 |
65 (50—73) |
4,4 (2,3—5,9) |
CD3+CD4+ |
35,5 |
2,30 |
27,0 |
0,6 |
38,0 |
2,1 |
50 (30—62) |
3,2 (1,5—5,0) |
CD3+CD8+ |
13,0 |
0,86 |
18,0 |
0,4 |
20,0 |
1,1 |
16 (8—34) |
1,0 (0,6—1,5) |
CD4/CD8 |
2,7 |
|
1,5 |
|
1,9 |
— |
2,9 (1,8—7,0) |
— |
CD (16+56)+CD3 |
2,7 |
0 |
13,0 |
0,3 |
4,0 |
0,2 |
6 (3—11) |
0,4 (0,3—0,9) |
CD19 |
51,6↑ |
3,4↑ |
28,0 |
0,6 |
27,0 |
1,5 |
28 (19—36) |
1,7 (1,2—2,8) |
|
|
|
|
|
|
|
|
|
Примечание. Полужирным шрифтом выделены патологические отклонения, стрелкой показано их направление.
стрения заболевания. Приводим (см. табл. 5) динамику уровня субпопуляций лимфоцитов крови у описанной больной в процессе лечения.
Как видно из данных табл. 5, в дебюте заболевания отмечалось повышение количества В-клеток и снижение содержания Т-клеток (CD3). На фоне лече- ния достигнута полная нормализация иммунограммы, что коррелировало с клиническим улучшением состояния больной.
К сожалению, применение приведенной схемы терапии не вызвало должного эффекта у ребенка с III степенью тяжести по шкале ОМС. Клинический эффект был непродолжительным — после коротких ремиссий у ребенка имели место новые рецидивы заболевания, протекавшие тяжело. В настоящее время больная лечится синактеном-депо (схема лечения любезно предоставлена профессором Pranzatelli из Национального педиатрического миоклонического центра США). На фоне такой терапии ее состояние улучшилось: она самостоятельно ходит, улучшилась речь, пополнился словарный запас, нормализовалось поведение.
Обсуждение
Представляет интерес сопоставление наших наблюдений с соответствующими данными литературы. Согласно им, возраст детей при дебюте параинфекционного ОМС варьирует от 4 мес до 6 лет, составляя в среднем 17—19 мес [5, 11]. В нашем исследовании минимальным был возраст пациентов 8 мес, максимальным — 3 года. Медиана возраста заболеваемости равнялась 1,45±0,15 года, что согласуется с данными Е. Тate и соавт. [21] — по ним средний возраст детей при дебюте заболевания составлял 1,6±0,7 года.
Возникновение неврологической симптоматики многие авторы [5, 11, 20] связывают с перенесенным инфекционным заболеванием или проведенной вакцинацией; этому соответствуют и наши наблюдения. Частота вирусной инфекции в продроме ОМС по нашим данным составила 55% случаев, вакцинации — 15%. Полностью соответствуют информации других авторов и данные относительно выраженной сезонности заболевания (осень, весна). Нетрудно заметить:
такое распределение совпадает с сезонным пиком острых респираторных заболеваний, что еще раз под- черкивает возможную ассоциацию ОМС с аденовирусной и респираторно-синтициальной инфекцией.
Существуют предположения относительно роли разных вирусов в этиологии ОМС [12, 14, 15, 17, 19, 22]. Речь идет о вирусах Коксаки В, Эпштейна—Барр, парвовирусе В19, энтеровирусе 71, вирусах паротита и полиомиелита. Однако прямая их связь с развитием заболевания не доказана. Как говорилось выше, при скрининге биологических жидкостей у наших больных в единичных случаях были выявлены положи-
тельные реакции крови на HSV1,2, CMV, HSV6, но результаты серологических исследований не подтвер-
дили наличия текущего инфекционного воспалительного процесса. Возможно, вирусы опосредованно влияют на развитие параинфекционного ОМС, инициируя аутоиммунный процесс.
Как следует из изложенного выше, клиническая картина ОМС в наших наблюдениях была достаточ- но типичной, отражая сочетание экстрапирамидных и психовегетативных нарушений.
Патоморфологической основой синдрома, вероятно, является повреждение в дентоталамокортикальных связях. Как известно, зубчатое ядро, располагающееся на пути от коры мозжечка до красного ядра, выполняет функции перераспределителя импульсов. Вокруг оливы, как и вокруг зубчатого ядра, находится густое сплетение, образуемое конечными разветвлениями волокон центрального пучка покрышки. В этот пучок собираются коллатерали от двигательных волокон экстрапирамидных путей, проходящих че- рез стволовую часть мозга и предназначенных именно для тех движений, которые нуждаются в мозжеч- ковых поправках. При поражении центрального пуч- ка покрышки, а также нижней оливы и зубчатого ядра мозжечка и появляются миоклонические подергивания скелетных и мимических мышц. Эти подергивания ритмичны, ритм отличается постоянством при сохранности всех участвующих движений. Таким образом, в возникновении миоклоний, опосоклонуса принимают непосредственное участие зубчатое ядро мозжечка, ствол мозга, а в вегетативном обеспече- нии этих двигательных нарушений участвуют надсегментарные отделы вегетативных центров. По всей ве-
10 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 2, 2007 |

роятности, при ОМС имеет место демиелинизация проводникового аппарата ствола мозга и мозжечка (восходящие и нисходящие специфические и неспецифические пути). M. Kinsburne [13] отмечал преимущественную демиелинизацию проводящих волокон от зубчатого ядра мозжечка, умеренную диффузную демиелинизацию белого вещества полушарий большого мозга, уменьшение числа клеток Пуркинье, что соответствует клиническим данным.
ОМС имеет хроническое рецидивирующее тече- ние (мультифазное). Его патогенез пока до конца неясен, но очевидно, что важную роль в его развитии играет аутоиммунный процесс [4, 16, 18]. Развитию последнего могут способствовать врожденные или приобретенные нарушения регуляторных механизмов в иммунной системе. При иммунофенотипировании субпопуляций лимфоцитов крови выявляется тенденция к изменениям, характерным для аутоиммунного воспалительного процесса. Продолжительность заболевания в прослеженных нескольких случаях заболевания была связана с низким соотношением CD4/ CD8, снижением числа СD4+ Т-клеток; в двух случа- ях при исследовании в начальном остром периоде заболевания отмечалось повышение уровня СD19+ (В-клеток). Аналогичные изменения находили М. Pranzatelli и соавт. [17] при исследовании активности В-лимфоцитов в СМЖ у 36 детей с ОМС. Эти авторы вообще предлагают считать высокий уровень В-кле- ток маркером активности патологического процесса. К сожалению, в связи с техническими ограничениями нам не удалось провести иммунофенотипирова-
ОПСОКЛОНУС-МИОКЛОНУС СИНДРОМ У ДЕТЕЙ
ние субпопуляций лимфоцитов СМЖ больных с ОМС. Но изучение субпопуляций лимфоцитов крови в активном периоде заболевания у двух больных подтвердило отмеченные тенденции. Несомненно, выявленные тенденции к изменению структуры лимфоцитов при ОМС нуждаются в дальнейшем изучении.
Из других особенностей изучавшейся патологии следует отметить отсутствие специфических изменений при МРТ головного мозга, а также редкость выраженных отклонений показателей СМЖ: лишь иногда могут выявляться лимфоцитарный цитоз и повышение уровня IgG в периоды обострения заболевания.
Наш опыт лечения ОМС показывает, что его необходимо проводить дифференцированно с учетом степени тяжести клинических проявлений и периода заболевания (обострение или ремиссия). В периоде обострений должна проводиться гормональная терапия, при этом отменять гормоны нужно при клини- ческом улучшении состояния больных медленно, с учетом показателей иммунного статуса.
Учитывая предположительно аутоиммунный характер заболевания, на наш взгляд, в лечении необходимо использовать и иммуномодуляторы. В этом случае речь может идти о высоких дозах иммуноглобулинов.
В заключение еще раз подчеркнем, что для точ- ного определения этиологии, патогенеза и выбора наиболее рациональной терапии такого редкого заболевания, как ОМС, необходимы дальнейшие исследования во всех указанных направлениях.
ЛИТЕРАТУРА
1.Гусев Е.И., Бурд Г.С., Никифоров А.С. Неврологические симпто12. Gennery A.J., Gennery A.I., Cant A., Forsyth R.J. Development of parain-
мы, синдромы, симптомокомплексы и болезни. М: Медицина |
fectious opsoclonus in an infant by a non-humoral immune mecha- |
1999. |
nism. Develop Med and Child Neurol 2001; 43: 213—216. |
2.Петрухин А.С., Бембеева Р.Ц., Самойлова М.В. Опсоклонус-мио- 13. Кinsburne M. Muoclonic encephalopathy of infants. J Nevrol Neuro-
клонус синдром (обзор). Журн неврол и психиат 2006; 106: 2:… 63—66.
3.Филиппов П.П. Паранеопластические антигены и ранняя диагностика рака. Соровский образовательный журнал 2000; 6: 9.
4.Antunes N.L., Khakoo Y., Matthay K.K. et al. Antineuronal antibodies in patients with neuroblastoma and paraneoplastic opsoclonus-myo- clonus. J Pediat Hematol Oncol 2000; 22: 15—320.
5.Boltshauser E., Deonna T., Hirt H.R. Myoclonic encephalopathy of infants or «dancing eyes syndrome». Helv Paediat Acta 1979; 34: 119—133.
6.Bray P.F., Ziter F.A., Lahey M.E., Myers C.G. The coincidence of neuroblastoma and acute cerebellar encephalopathy. J Pediat 1969; 75: 983—990.
surg and Psychiat 1962; 25: 271—276.
14.Kuban K.C., Ephros M.A., Freeman R.I. et al. Syndrome of opso- clonus-myoclonus caused by coxsackie B3 infection. Ann Neurol 1983; 13: 69—71.
15.Mc Minn P. Adult paraneoplastic opsoclonus-myoclonus syndrome associated with antimitochondrial autoantibodies. J Neurol Neurosurg and Psychiat 2003; 74: 1595—1596.
16.Pranzatelli M.R., Tate E.D., Wheeler A. et al. Screening for autoantibodies in children with opsoclonus-myoclonus-ataxia. Pediat Neurol 2002; 27: 5: 384—387.
17.Pranzatelli M.R., Travelstead A.L., Tate E.D. et al. B- and T-cell markers in opsoclonus-myoclonus syndrome. Neurology 2004; 62: 1526—1532.
7.Cooper R., Khakoo Y., Matthay K.K. et al. Opsoclonus-myoclonus- 18. Pranzatelli M.R., Tate E.D., Travelstead A.L., Longee D. Immunologic
ataxia syndrome in neuroblastoma: Histopathologic features — a report from the Children´s Cancer Group. Med and Pediat Oncol 2001; 36: 623—629.
8.Cushing H., Wolbach S.B.The transformation of a malignant paravertebral sympathicoblastoma ito a benign ganglioneuroma. Am J Pathol 1927; 3: 203—205.
9.Dyken P., Kolar O. Dansing eyes, dancing feet infantile polymyoclonus. Brain 1968; 91: 305—320.
10.Esther de Vries. Immunophenotyping of lymphocytes in healthy and immunodeficient children. Rotterdam: Erasmus Universiteit Rotterdam, Afdeling Immunologils 1999; 181.
11.Fernandes-Alvares E., Aicardi J. Movement disorders in children. ICNA 2001; 177—182.
and clinical responses to Rituximab in a child with opsoclonus-my- oclonus syndrome. Pediatrics 2005; 115: 1: 115—119.
19.Sheth R.D., Horwitz S.1., Aronoff S. et al. Opsoclonus-myoclonus syndrome secondary to Epstein-Barr virus infection. J Chil Neurol 1995; 10: 297—299.
20.Tabarki B., Palmer P., Lebon P., Sebire G. Spontaneous recovery of opsoclonus-myoclonus syndrome caused by enterovirus infection. J Neurol Neurosurg Psychiat 1998; 64: 406—422.
21.Tate E.D., Allison T.J., Pranzatelli M.R., Verhulst S.J. Neuroepidemiologic trends in 105 US cases of pediatric opsoclonus-myoclonus syndrome. J Pediat Oncol Nursing 2005; 22: 8—19.
22.Vukelic D., Bozinovic D., Morovic M. et al. Opsoclonus-myoclonus syndrome in a child with neuroborreliosis. J Infect 2000; 40: 2: 189—191.
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 2, 2007 |
11 |
