22. Адиабатический процесс. Уравнение Пуассона. Работа при адиабатическом процессе
Адиабатическимназывается процесс,
при котором отсутствует теплообмен
(Q=0)
между системой и окружающей средой.
К адиабатическим процессам можно
отнести все быстропротекающие процессы.
Из первого начала термодинамики
(Q=dU+A)
для адиабатического процесса следует,
что

 Полученное
выражение есть уравнение адиабатического
процесса,называемое такжеуравнением
Пуассона.
Полученное
выражение есть уравнение адиабатического
процесса,называемое такжеуравнением
Пуассона.
соответственно
давление или объем:
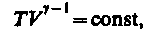

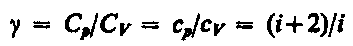 называется
показателем адиабаты(или коэффициентом
Пуассона).Для одноатомных газов (Ne,Heи др.), достаточно хорошо
удовлетворяющих условию идеальности,i=3,=1,67.
Для двухатомных газов (Н2,N2,
О2 и др.)i=5,=1,4.
Вычислим работу, совершаемую газом в
адиабатическом процессе.
называется
показателем адиабаты(или коэффициентом
Пуассона).Для одноатомных газов (Ne,Heи др.), достаточно хорошо
удовлетворяющих условию идеальности,i=3,=1,67.
Для двухатомных газов (Н2,N2,
О2 и др.)i=5,=1,4.
Вычислим работу, совершаемую газом в
адиабатическом процессе.
Работасовершаемая при адиабатическом
процесссе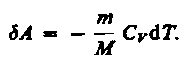
Если
газ адиабатически расширяется от объема
V1доV2,то его температура уменьшается отT1доT2и работа расширения идеального газа

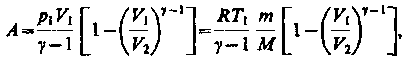

24. Второе начало термодинамики. Энтропия.
Второе
начало термодинамикиможно
сформулировать как закон возрастания
энтропиизамкнутой системы при
необратимых процессах:любой необратимый
процесс в замкнутой системе происходит
так, что энтропия системы при этом
возрастает.Краткая формулировка:
в процессах, происходящих в
замкнутой системе, энтропия не убывает.
возрастание энтропииозначает переход
системы изменее вероятных в более
вероятныесостояния
Две
формулировки второго начала термодинамики:
1)
по Кельвину: невозможен круговой
процесс, единственным результатом
которого является превращение теплоты,
полученной от нагревателя, в эквивалентную
ей работу; 2) по Клаузиусу:
невозможен круговой процесс,
единственным результатом которого
является передача теплоты от менее
нагретого тела к более нагретому.
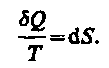 Функция
состояния,дифференциалом которой
являетсяQ/T,называетсяэнтропиейи обозначаетсяS.Дляобратимых
процессовизменение энтропии
Функция
состояния,дифференциалом которой
являетсяQ/T,называетсяэнтропиейи обозначаетсяS.Дляобратимых
процессовизменение энтропии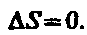 В термодинамике доказывается, что
энтропия системы, совершающейнеобратимый
цикл,возрастает:
В термодинамике доказывается, что
энтропия системы, совершающейнеобратимый
цикл,возрастает: Выражения
относятся только кзамкнутым системам,если же система обменивается теплотой
с внешней средой, то ее энтропия может
вести себя любым образом.Неравенства
Клаузиуса
Выражения
относятся только кзамкнутым системам,если же система обменивается теплотой
с внешней средой, то ее энтропия может
вести себя любым образом.Неравенства
Клаузиуса
энтропия
замкнутой системыможетлибо
возрастать(в случае необратимых
процессов),либо оставаться постоянной(в случае обратимых процессов).
Если
система совершает равновесный переход
из состояния 1в состояние2, то,
согласно изменение энтропии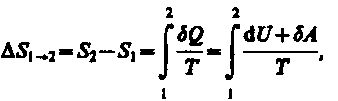 Так как для адиабатического процессаQ
= 0,тоS= 0 и, следовательно,S=const,
т. е.адиабатический обратимый
процесспротекаетпри постоянной
энтропии.Поэтому его называют
изоэнтропийным процессом.При
изотермическом процессе (T1=T2)
Так как для адиабатического процессаQ
= 0,тоS= 0 и, следовательно,S=const,
т. е.адиабатический обратимый
процесспротекаетпри постоянной
энтропии.Поэтому его называют
изоэнтропийным процессом.При
изотермическом процессе (T1=T2)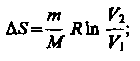 при
изохорном (V1
= V2)
при
изохорном (V1
= V2)
Термодинамическая
вероятностьWсостояния системы — эточисло способов,которыми может быть реализовано данное
состояние макроскопической системы.
Энтропия обладает свойствомаддитивности:
энтропия системы равна сумме энтропий
тел, входящих в систему.
Согласно
Больцману, энтропиясистемы итермодинамическая вероятность связаны
между собой следующим образом:


