
- •Кафедра биохимии
- •Лекция № 17 Тема: Белки I. Механизмы переваривание и всасывания белков
- •Понятие, классификация, свойства и функции белков
- •Роль белка в питании. Показатели качества пищевого белка
- •Количество белка в некоторых пищевых продуктах
- •3. Азотистый баланс. Принципы нормирования белка в питании. Белковая недостаточность
- •Нормы белка в питании
- •Белковая недостаточность
- •Переваривание белков в жкт
- •Переваривание белков в желудке
- •Состав желудочного сока
- •Нарушения переваривания белков в желудке
- •Защита клеток от действия протеаз
- •Регуляция желудочно-кишечной секреции
- •Нарушение переваривания белков и транспорта аминокислот
- •4. «Гниение» белков в кишечнике. Роль удф-глюкуроновой кислоты и фафс в процессах обезвреживания и выведения продуктов «гниения» (фенол, индол, скатол, индоксил и др.).
- •Кафедра биохимии
- •Лекция № 18 Тема: Белки II. Общие пути обмена аминокислот. Биосинтез мочевины.
- •Пути образования пула аминокислот в крови и его использование в организме
- •Общие реакции обмена аминокислот
- •Трансаминирование (переаминирование) аминокислот
- •Дезаминирование аминокислот
- •Прямое дезаминирование ак
- •2. Оксидаза l-аминокислот
- •3. Оксидаза d-аминокислот
- •Пути обмена безазотистого остатка аминокислот
- •Связывание (обезвреживание) аммиака
- •Орнитиновый цикл
- •Гипераммониемия
- •Обмен аминокислот и аммиака между тканями
- •Декарбоксилирование аминокислот и их производных
- •Кафедра биохимии
- •Лекция № 19 Тема: Белки III. Специфические пути обмена аминокислот
- •Фолиевая кислота
- •Кобаламин (в12)
- •Обмен серина и глицина
- •Метионин
- •Цистеин
- •Фенилаланин
- •Тирозин
- •1. Обмен тирозина в надпочечниках и нервной ткани
- •2. Обмен тирозина в меланоцитах
- •3. Превращение тирозина в щитовидной железе
- •5. Катаболизм тирозина в печени
- •Триптофан
- •Глутамат
- •Глутамин
- •Аспартат
- •Аспарагин
Дезаминирование аминокислот
Дезаминирование АК— реакция отщепления α-аминогруппы от АК, в результате чего образуется соответствующая α-кетокислота и выделяется молекула аммиака.
Дезаминирование бывает прямым и непрямым.
Прямое дезаминирование ак
Прямое дезаминирование- это дезаминирование, которое происходит в 1 стадию с участием одного фермента. Прямому дезаминированию повергаются глу, гис, сер, тре, цис.
Существует 5 видов прямого дезаминирования АК:
окислительное;
неокислительное;
внутримолекулярное;
восстановительное;
гидролитическое.
Окислительное дезаминирование - самый активный вид прямого дезаминирования АК.
1. Глутаматдегидрогеназа(глу-ДГ) - олигомер, состоящий из 6 субъединиц (молекулярная масса 312 кД), содержит кофермент НАД+. Глу-ДГ катализирует обратимое дезаминирование глу, очень активна в митохондриях клеток практически всех органов, кроме мышц. Глу-ДГ аллостерически ингибируют АТФ, ГТФ, НАДH2, активирует избыток АДФ. Индуцируется Глу-ДГ стероидными гормонами (кортизолом).
Реакция идёт в 2 этапа. Вначале происходит ферментативное дегидрирование глутамата и образование α-иминоглутарата, затем — неферментативное гидролитическое отщепление иминогруппы в виде аммиака, в результате чего образуется α-кетоглутарат. При избытке аммиака реакция протекает в обратном направлении (как восстановительное аминирование α-кетоглутарата).

Глу + НАД++ Н2О ↔ α-КГ + НАДН2+NH3
2. Оксидаза l-аминокислот
В печени и почках есть оксидаза L-АК, способная дезаминировать некоторые L-аминокислоты:

Оксидаза L-АК имеет кофермент ФМН. Т.к. оптимум рН оксидазы L-АК равен 10,0, активность фермента очень низка и вклад ее в дезаминирование незначителен.
3. Оксидаза d-аминокислот
Оксидаза D-аминокислот также обнаружена в почках и печени. Это ФАД-зависимый фермент, с оптимумом рН в нейтральной среде. Оксидаза D-аминокислот превращает, спонтанно образующиеся из L-аминокислот, D-аминокислоты в кетокислоты.

Неокислительное дезаминирование
В печени человека присутствуют специфические пиридоксальфосфатзависимые ферменты сериндегидратаза, треониндегидратаза, катализирующие реакции неокислительного дезаминирования аминокислот серина и треонина.
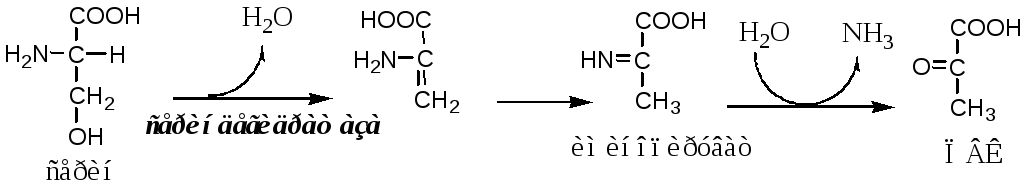
Внутримолекулярное дезаминирование
Внутримолекулярное дезаминирование характерно для гистидина. Реакцию катализирует гистидаза(гистидин-аммиаклиаза). Эта реакция происходит только в печени и коже.

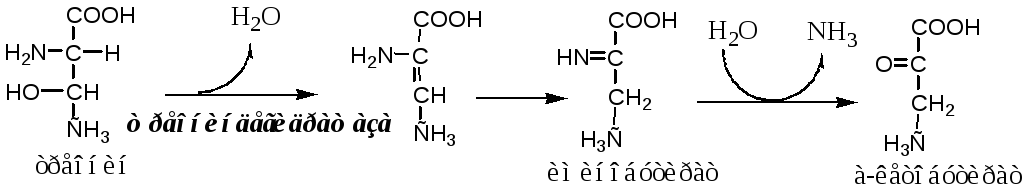
Непрямое дезаминирование (трансдезаминирование) АК
Непрямое дезаминирование- это дезаминирование, которое происходит в 2 стадий с участием нескольких ферментов. Оно характерно для большинства АК, так как они не способны к прямому дезаминированию (нет ферментов).
На первой стадии происходит одна и несколько реакций переаминирования с участием аминотрансфераз, в результате аминогруппа АК переходит на кетосоединение (α-КГ, ИМФ).
На второй стадии происходит реакция дезаминирования аминосоединения (глу, АМФ), в результате чего образуется аммиак.
Последовательность реакций непрямого дезаминирования зависит от набора ферментов в тканях.
Непрямое дезаминирование в печени
Непрямое дезаминирование АК происходит при участии 2 ферментов: аминотрансферазы и глу-ДГ. Аминогруппы АК в результате трансаминирования переносятся на α-КГ с образованием глутамата, который затем подвергается прямому окислительному дезаминированию.
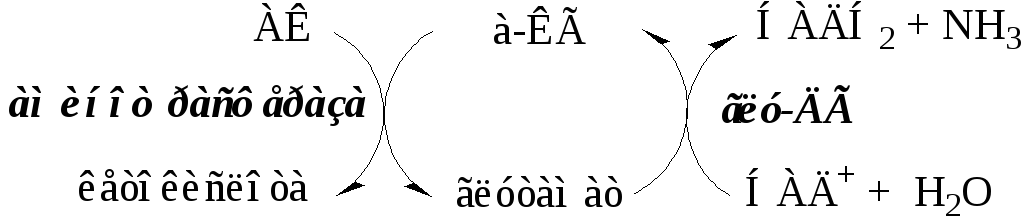
Обе стадии непрямого дезаминирования обратимы, что обеспечивает как катаболизм АК, так и возможность образования практически любой АК из соответствующей α-кетокислоты.
При энергодефиците АДФ активирует Глу-ДГ, что усиливает катаболизм АК и образование а-кетоглутарата, поступающего в ЦТК как энергетический субстрат.
Таким образом, Глу-ДГ играет ключевую роль в регуляции обмена АК и энергии.
Непрямое дезаминирование в мышцах (и нервной ткани)
В мышечной ткани активность глу-ДГ низка, поэтому при интенсивной физической нагрузке функционирует ещё один путь непрямого дезаминирования с участием цикла ИМФ-АМФ.

Можно выделить 4 стадии этого процесса:
трансаминирование с а-кетоглутаратом, образование глутамата (аминотрансфераза);
трансаминирование глутамата с ЩУК, образование аспартата (АСТ);
реакция переноса аминогруппы от аспартата на ИМФ (инозинмонофосфат), образование АМФ и фумарата (аденилосукцинасинтаза и аденилосукцинатлиаза);
гидролитическое дезаминирование АМФ (АМФ-дезаминаза).
Этот путь дезаминирования преобладает в мышцах при интенсивной работе, в результате которой накапливается молочная кислота. Выделяющийся аммиак предотвращает закисление среды в клетках, вызванное образованием лактата.
