- •Кафедра биохимии
- •Лекция № 17 Тема: Белки I. Механизмы переваривание и всасывания белков
- •Понятие, классификация, свойства и функции белков
- •Роль белка в питании. Показатели качества пищевого белка
- •Количество белка в некоторых пищевых продуктах
- •3. Азотистый баланс. Принципы нормирования белка в питании. Белковая недостаточность
- •Нормы белка в питании
- •Белковая недостаточность
- •Переваривание белков в жкт
- •Переваривание белков в желудке
- •Состав желудочного сока
- •Нарушения переваривания белков в желудке
- •Защита клеток от действия протеаз
- •Регуляция желудочно-кишечной секреции
- •Нарушение переваривания белков и транспорта аминокислот
- •4. «Гниение» белков в кишечнике. Роль удф-глюкуроновой кислоты и фафс в процессах обезвреживания и выведения продуктов «гниения» (фенол, индол, скатол, индоксил и др.).
- •Кафедра биохимии
- •Лекция № 18 Тема: Белки II. Общие пути обмена аминокислот. Биосинтез мочевины.
- •Пути образования пула аминокислот в крови и его использование в организме
- •Общие реакции обмена аминокислот
- •Трансаминирование (переаминирование) аминокислот
- •Дезаминирование аминокислот
- •Прямое дезаминирование ак
- •2. Оксидаза l-аминокислот
- •3. Оксидаза d-аминокислот
- •Пути обмена безазотистого остатка аминокислот
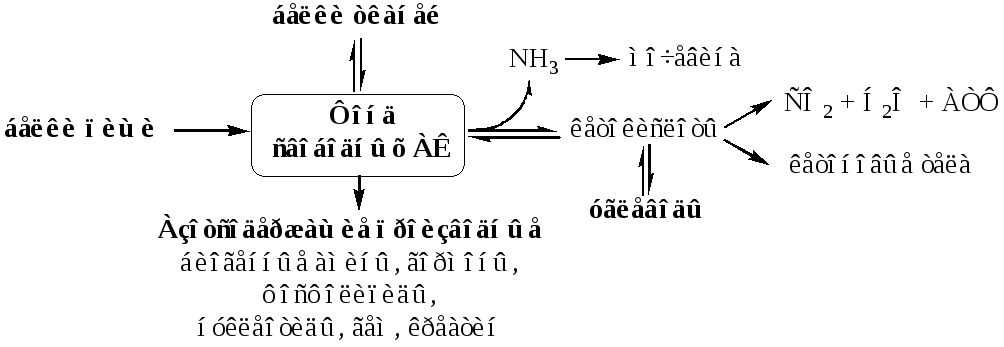
- •Связывание (обезвреживание) аммиака
- •Орнитиновый цикл
- •Гипераммониемия
- •Обмен аминокислот и аммиака между тканями
- •Декарбоксилирование аминокислот и их производных
- •Кафедра биохимии
- •Лекция № 19 Тема: Белки III. Специфические пути обмена аминокислот
- •Фолиевая кислота
- •Кобаламин (в12)
- •Обмен серина и глицина
- •Метионин
- •Цистеин
- •Фенилаланин
- •Тирозин
- •1. Обмен тирозина в надпочечниках и нервной ткани
- •2. Обмен тирозина в меланоцитах
- •3. Превращение тирозина в щитовидной железе
- •5. Катаболизм тирозина в печени
- •Триптофан
- •Глутамат
- •Глутамин
- •Аспартат
- •Аспарагин
Пути образования пула аминокислот в крови и его использование в организме
Большая часть аминокислот организма человека, примерно 15кг, входит в состав белков. Фонд свободных АК организма составляет примерно 35г.
Источниками АК в организме являются белки пищи, белки тканей и синтез АК из углеводов. В сутки у человека распадается на АК около 400г белков, примерно такое же количество синтезируется. Специальной формы депонирования АК, подобно глюкозе (в виде гликогена) или жирных кислот (в виде ТГ), не существует. Поэтому резервом АК служат все белки тканей, но преимущественно белки мышц (т.к. их много).
Общие реакции обмена аминокислот
АК, появившиеся в организме, включаются в общие и специфические реакции обмена.
К общим реакциям обмена АК относят реакции трансаминирования, дезаминирования и декарбоксилирования, биосинтеза белков и рацемизации (LпереходыD).
Трансаминирование (переаминирование) аминокислот
Трансаминирование — реакция переноса α-аминогруппы с АК на α-кетокислоту, в результате чего образуются новая α-кетокислота и новая АК. Процесс трансаминирования легко обратим, при нем общее количество АК в клетке не меняется.
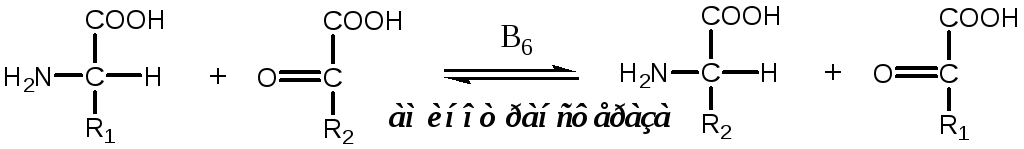
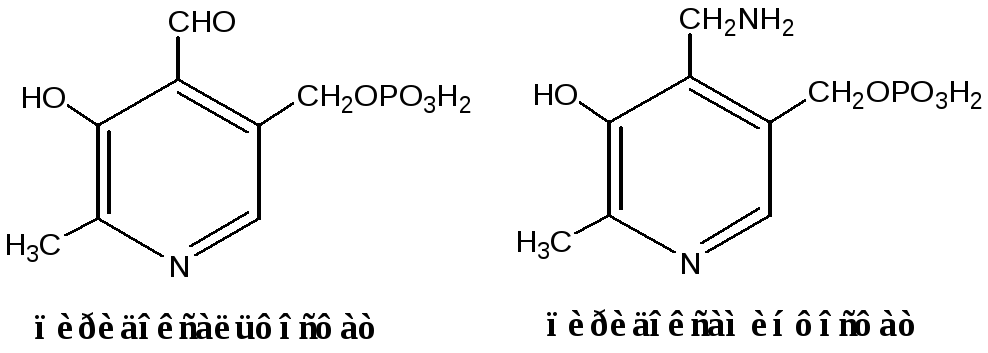
|
Реакции катализируют аминотрансферазы, коферментом которых служит пиридоксальфосфат (ПФ) — производное витамина В6(пиридоксина). |
|
У человека найдено более 10 аминотрансфераз, которые локализуются в цитоплазме и митохондриях клеток. В реакции трансаминирования вступают почти все АК, за исключением лизина, треонина ипролина.
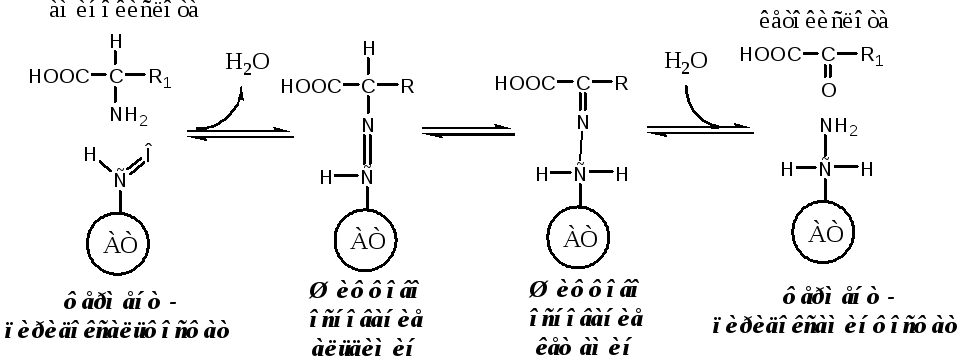
Механизм переаминирования

Вначале, АК передает свою аминогруппу на пиродоксальфосфат. АК при этом превращается в кетокислоту, а пиродоксальфосфат - в пиридоксаминфосфат.
Затем, реакции идут в обратную сторону: но уже другая кетокислота, принимает аминогруппу от пиридоксаминфосфата и превращается в новую АК, а пиридоксаминфосфат в пиродоксальфосфат.
Органоспецифичные аминотрансферазы АЛТ и АСТ
Чаще всего в трансаминировании участвуют АК и кетокислоты, которых много в организме — глу, ала, асп, α-КГ, ПВК и ЩУК. Основным донором аминогруппы служит глу, а кетогруппы - α-КГ.
Наиболее распространёнными аминотрансферазами в большинстве тканей млекопитающих являются аланинаминотрансфераза (АЛТ) и аспартатаминотрансфераза (ACT).
АЛТкатализирует реакцию трансаминирования между ала и α-КГ: ала+α-КГ↔ПВК+глу АЛТ локализуется в цитозоле клеток многих органов, больше всего ее в клеткахпечении миокарде.
ACTкатализирует реакцию трансаминирования между асп и α-КГ: асп+α-КГ↔ЩУК+глу
ACT имеет как цитоплазматическую, так и митохондриальную формы. Наибольшее ее количество обнаружено в миокардеи печени.
АСТ и АЛТ являются органоспецифичными ферментами, их определяют в крови для диагностики заболеваний печени, сердца и, в меньшей степени, скелетных мышц. Соотношение активностей АСТ/АЛТ называют «коэффициент де Ритиса». В норме он равен 1,33±0,42.
При инфаркте миокардаактивность ACT в крови увеличивается в 8—10 раз, а АЛТ — в 1,5—2,0 раза, коэффициент де Ритиса резко возрастает.
При гепатитахактивность АЛТ в сыворотке крови увеличивается в - 8—10 раз по сравнению с нормой, a ACT — в 2—4 раза. Коэффициент де Ритиса снижается до 0,6.
Биологическое значение трансаминирования
Реакции трансаминирования обеспечивают синтез и распад амино- и кетокислот, перераспределение аминного азота в тканях организма.