
- •Задания по модулю №2 «Элементы химической термодинамики. Элементы химической кинетики» для специальности 060101 «Лечебное дело»
- •Задания по модулю №2 «Элементы химической термодинамики. Элементы химической кинетики» для специальности 060101 «Лечебное дело»
- •Задания по модулю №2 «Элементы химической термодинамики. Элементы химической кинетики» для специальности 060101 «Лечебное дело»
- •Задания по модулю №2 «Элементы химической термодинамики. Элементы химической кинетики» для специальности 060101 «Лечебное дело»
- •Задания по модулю №2 «Элементы химической термодинамики. Элементы химической кинетики» для специальности 060101 «Лечебное дело»
- •Задания по модулю №2 «Элементы химической термодинамики. Элементы химической кинетики» для специальности 060101 «Лечебное дело»
- •Задания по модулю №2 «Элементы химической термодинамики. Элементы химической кинетики» для специальности 060101 «Лечебное дело»
- •Задания по модулю №2 «Элементы химической термодинамики. Элементы химической кинетики» для специальности 060101 «Лечебное дело»
- •Задания по модулю №2 «Элементы химической термодинамики. Элементы химической кинетики» для специальности 060101 «Лечебное дело»
- •Задания по модулю №2 «Элементы химической термодинамики. Элементы химической кинетики» для специальности 060101 «Лечебное дело»
- •Задания по модулю №2 «Элементы химической термодинамики. Элементы химической кинетики» для специальности 060101 «Лечебное дело»
- •Задания по модулю №2 «Элементы химической термодинамики. Элементы химической кинетики» для специальности 060101 «Лечебное дело»
- •Ответы к модулю №2 «Элементы химической термодинамики. Элементы химической кинетики» для специальности 060101 «Лечебное дело»
Задания по модулю №2 «Элементы химической термодинамики. Элементы химической кинетики» для специальности 060101 «Лечебное дело»
Вариант №9
Ферментативную реакцию изучают при 2-х температурах 27ºС и 37ºС. Константы равновесия при этих температурах равны соответственно 2,3·10–6 и 5,1·10–6. Константы скорости прямой реакции при этих температурах равны соответственно 3,4 и 8,5 мин–1. Определите:
Порядок (П) реакции:
П=1;
П=2;
П=0.
Энтальпию процесса:
–7,08 кДж/моль;
70,8 кДж/моль;
–708 кДж/моль.
Энергию активации:
61,6 кДж/моль;
6,16 кДж/моль;
616 кДж/моль.
Необходимость повышения или понижения температуры для оптимального протекания процесса:
термодинамический фактор требует повышения температуры;
термодинамический и кинетический факторы требуют повышения температуры;
кинетический фактор требует понижения температуры.
Направление смещения равновесия при повышении температуры (путём анализа изобары реакции)
равновесие не смещается;


Возможность протекания самопроизвольного процесса в изолированной и открытой системах при 37ºС. Является ли данный процесс экзэргоническим или эндэргоническим?
Δ
 Gº=31,35;
эндэргонический процесс
Gº=31,35;
эндэргонический процессΔ
 Gº>0;
экзэргонический процесс
Gº>0;
экзэргонический процессΔ
 Gº<0;
экзэргонический процесс
Gº<0;
экзэргонический процесс
Задания по модулю №2 «Элементы химической термодинамики. Элементы химической кинетики» для специальности 060101 «Лечебное дело»
Вариант №10
Константы равновесия ферментативной реакции при 37ºС и 27ºС равны соответственно 1,6·10–2 и 0,74·10–2. Константы скорости прямой реакции при этих температурах равны соответственно 0,141 с–1 и 0,056 с–1. Определите:
Порядок (П) реакции:
П=3;
П=2;
П=1;.
Энергию активации:
7,133 кДж/моль;
71,33 кДж/моль;
713,3 кДж/моль.
Энтальпию процесса:
59,58 кДж/моль;
–59,58 кДж/моль;
5,96 кДж/моль.
Необходимость повышения или понижения температуры для оптимального протекания процесса:
Еа=71,33 кДж/моль, понижение температуры;
ΔН>0, повышение температуры;
ΔН>0, понижение температуры.
Направление смещения равновесия при повышении температуры (путём анализа изобары реакции)
смещение равновесия не происходит;


Возможность протекания самопроизвольного процесса в изолированной и открытой системах при 37ºС. Является ли данный процесс экзэргоническим или эндэргоническим?
Δ
 Gº=10,65
кДж/моль, эндэргонический процесс
Gº=10,65
кДж/моль, эндэргонический процессΔ
 Gº=
–10,65 кДж/моль, экзэргонический процесс
Gº=
–10,65 кДж/моль, экзэргонический процессΔGº=0, равновесный процесс
Задания по модулю №2 «Элементы химической термодинамики. Элементы химической кинетики» для специальности 060101 «Лечебное дело»
Вариант №11
Реакция между диоксидом кремния и едким натром протекает по уравнению:
![]()
Определите:
Молекулярность (М) и порядок (П) реакции:
при условии одностадийности процесса: М=3, П=2;
М=3, П=3;
М=5, П=3.
Как изменится скорость прямой реакции при увеличении концентрации едкого натра в 2 раза?
увеличится в 2 раза;
увеличится в 4 раза;
уменьшится в 2 раза.
Возможность прохождения прямой реакции (возможность выпаривания щёлочи в стеклянной посуде), если известно, что значения ΔGº кДж/моль равны: SiO2= –803,75; NaOH= –419,5; Na2SiO3= –1427,8; H2O= –237,5.
Δ
 Gº=0
Gº=0Δ
 Gºреакции=+22,55
Gºреакции=+22,55Δ
 Gºреакции=
–22,55
Gºреакции=
–22,55
Возможность протекания данного процесса в изолированной системе, если известно, что ΔНºреакции = –518 кДж/моль:
Δ
 Sºреакции=+166
Дж/моль∙К,
Sºреакции=+166
Дж/моль∙К,Δ
 Sºреакции=–1,66
кДж/моль,
Sºреакции=–1,66
кДж/моль,Δ
 Sºреакции=+1,66
кДж/моль,
Sºреакции=+1,66
кДж/моль,
Направление смещения равновесия при понижении температуры (путём анализа изобары реакции)
смещения равновесия не наблюдается;


Скорость реакции в момент, когда прореагировало 50% щёлочи. Константа скорости реакции равна 0,5
 .
Исходная концентрация щёлочи равна
0,6
.
Исходная концентрация щёлочи равна
0,6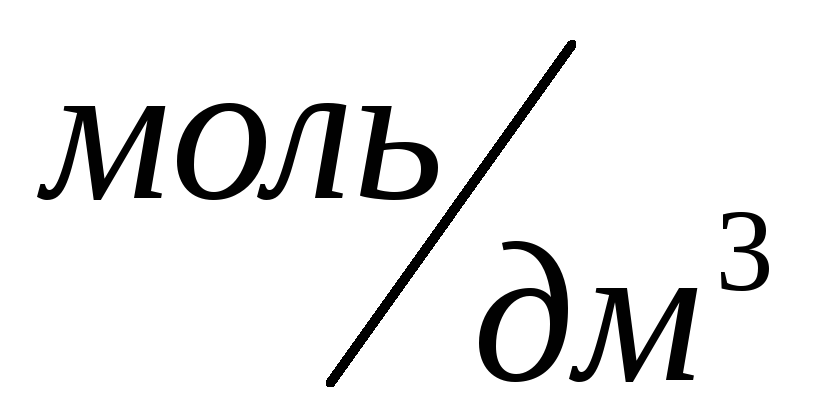 .
.45 моль·л–1·с–1;
0,045 моль·л–1·с–1;
0,045 с–1.
