
- •Задания по модулю №2 «Элементы химической термодинамики. Элементы химической кинетики» для специальности 060101 «Лечебное дело»
- •Задания по модулю №2 «Элементы химической термодинамики. Элементы химической кинетики» для специальности 060101 «Лечебное дело»
- •Задания по модулю №2 «Элементы химической термодинамики. Элементы химической кинетики» для специальности 060101 «Лечебное дело»
- •Задания по модулю №2 «Элементы химической термодинамики. Элементы химической кинетики» для специальности 060101 «Лечебное дело»
- •Задания по модулю №2 «Элементы химической термодинамики. Элементы химической кинетики» для специальности 060101 «Лечебное дело»
- •Задания по модулю №2 «Элементы химической термодинамики. Элементы химической кинетики» для специальности 060101 «Лечебное дело»
- •Задания по модулю №2 «Элементы химической термодинамики. Элементы химической кинетики» для специальности 060101 «Лечебное дело»
- •Задания по модулю №2 «Элементы химической термодинамики. Элементы химической кинетики» для специальности 060101 «Лечебное дело»
- •Задания по модулю №2 «Элементы химической термодинамики. Элементы химической кинетики» для специальности 060101 «Лечебное дело»
- •Задания по модулю №2 «Элементы химической термодинамики. Элементы химической кинетики» для специальности 060101 «Лечебное дело»
- •Задания по модулю №2 «Элементы химической термодинамики. Элементы химической кинетики» для специальности 060101 «Лечебное дело»
- •Задания по модулю №2 «Элементы химической термодинамики. Элементы химической кинетики» для специальности 060101 «Лечебное дело»
- •Ответы к модулю №2 «Элементы химической термодинамики. Элементы химической кинетики» для специальности 060101 «Лечебное дело»
Задания по модулю №2 «Элементы химической термодинамики. Элементы химической кинетики» для специальности 060101 «Лечебное дело»
Вариант №3
Установлено, что скорость реакции
CO2(г)+2NH3(г)(NH2)2CO(т)+H2O(ж)
ускоряется в 3 раза при увеличении концентрации CO2 в 3 раза и в 4 при увеличении концентрации NH3 в 2 раза.
Определите:
Молекулярность (М) и порядок (П) реакции:
П=3; независимо от механизма реакции, М=3;
П=3, М=3;
П=3; при условии одностадийности процесса М=3.
Как изменится скорость прямой реакции при увеличении концентрации реагирующих веществ в 2 раза?
уменьшится в 8 раз;
увеличится в 8 раз;
увеличится в 2 раза.
Энтальпию образования (NH2)2CO, если ΔН реакции равна –134,4 кДж/моль, а энтальпии образования CO2, NH3 и H2O (в кДж/моль) равны соответственно –393,0, –46,2, –286,0.
–333,8 кДж/моль;
+333,8 кДж/моль;
–33,38 кДж/моль.
Направление процесса в закрытой и открытой системах, учитывая, что энтропии веществ Дж/моль∙К равны:
Sº(CO2)=213,6;
Sº(NH3)=110,0;
Sº((NH2)2CO)=104,0;
Sº(H2O)=70,0.
Δ
 Gº=
–256,3 Дж/моль∙К;
Gº=
–256,3 Дж/моль∙К;Δ
 Gº=
+256,3 Дж/моль∙К;
Gº=
+256,3 Дж/моль∙К;Δ
 Gº=
–57,04 Дж/моль∙К.
Gº=
–57,04 Дж/моль∙К.
Направление смещения равновесия при повышении концентрации аммиака (путем анализа изотермы реакции):
смещение равновесия отсутствует;


Путём анализа энтальпии процесса и энергии активации установить причину повышения скорости реакции с ростом температуры. Известно, что повышению температуры (21—41ºС) соответствует увеличение скорости реакции в 22 раза:
Еа=118,4 кДж/моль;
Еа<40 кДж/моль;
ΔH<0.
Задания по модулю №2 «Элементы химической термодинамики. Элементы химической кинетики» для специальности 060101 «Лечебное дело»
Вариант №4
Ориентируясь на уравнение реакции
2NO2(г)2NO(г)+O2(г),
определите:
Молекулярность (М) и порядок (П) реакции:
М=2, П=2;
М=5, П=2;
М=3, П=3.
Выражение для константы скорости и единицы её измерения:
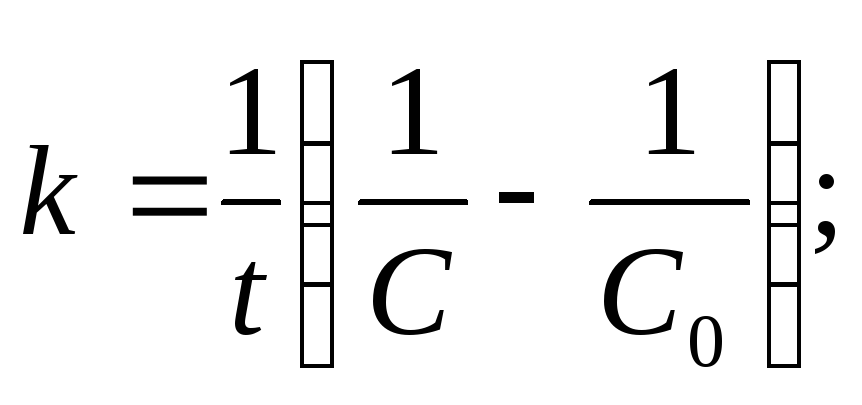 моль·с–1·л–1;
моль·с–1·л–1; с–1;
с–1;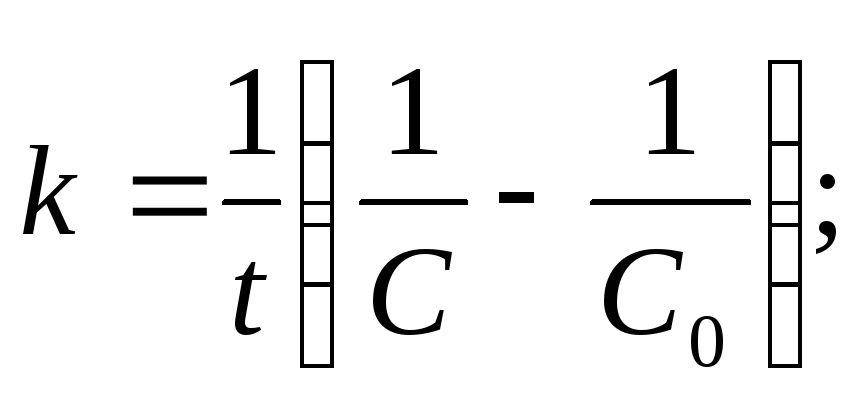 л·моль–1·с–1.
л·моль–1·с–1.
Энтальпию реакции, если энтальпии образования диоксида и оксида азота равны кДж/моль +33,89 и 90,37 соответственно:
11,3 Дж/моль;
113 кДж/моль;
113 Дж/моль;
Направление процесса в закрытой и открытой системах, учитывая, что энтропии веществ Дж/моль∙К равны:
Sº(NO2)=240,45
Sº(NO)=210,62
Sº(O2)=205,03
Δ
 Gº=
+69,79 кДж/моль
Gº=
+69,79 кДж/мольΔ
 Gº=
+113 кДж/моль
Gº=
+113 кДж/мольΔ
 Gº=
–113 кДж/моль
Gº=
–113 кДж/моль
Направление смещение равновесия при увеличения давления (дать мотивированный ответ)


смещение отсутствует.
Энергию активации реакции разложения диоксида азота, если константы скорости при 600 и 640 К соответственно равны 83,9 и 407,0 л·моль–1·с–1
≈126 кДж/моль;
≈126 кДж/моль;
12,6 кДж/моль.
Задания по модулю №2 «Элементы химической термодинамики. Элементы химической кинетики» для специальности 060101 «Лечебное дело»
Вариант №5
Ориентируясь на уравнение реакции
![]() ,
,
определить:
Молекулярность (М) и порядок (П) реакции:
без знания механизма М и П определить нельзя;
М=4, П=4;
М=6, П=4.
Как изменится скорость реакции при уменьшении давления в 4 раза?
увеличится в 256 раз;
уменьшится в 256 раз;
уменьшится в 4 раза.
Энтальпию образования аммиака, если известно, что энтальпия его разложения равна 46,2 кДж/моль
+46,2 кДж/моль;
462 кДж/моль;
–46,2 кДж/моль.
Направление процесса в закрытой и открытой системах, учитывая, что энтропии Дж/моль∙К равны:
Sº(NН3)=192,6
Sº(N2)=200
Sº(Н2)=130,5
Δ
 Gº=
15,28 кДж/моль
Gº=
15,28 кДж/мольΔ
 Gº=
–15,28 кДж/моль
Gº=
–15,28 кДж/мольΔ
 Gº=
152,8 кДж/моль
Gº=
152,8 кДж/моль
Направление смещения равновесия при повышении температуры (путём анализа изобары реакции)


смещение равновесия отсутствует.
Необходимость повышения или понижения температуры для оптимального протекания процесса, учитывая энтальпию реакции и значение констант скорости реакции:
k1(500К)=80,1 л·моль–1·с–1.
k2(540К)=400,0 л·моль–1·с–1.
повышения температуры требует кинетический фактор
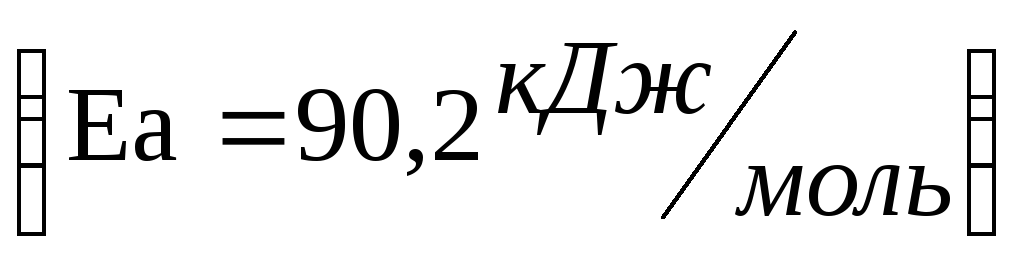 ;
;повышения температуры требует термодинамический фактор;
кинетический фактор
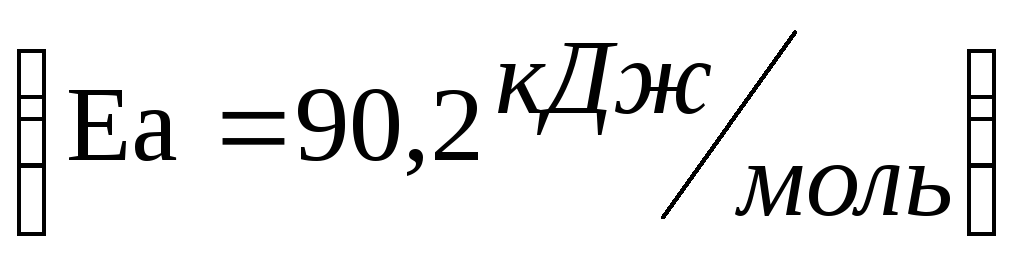 требует понижения температуры.
требует понижения температуры.
