
- •Задания по модулю №2 «Элементы химической термодинамики. Элементы химической кинетики» для специальности 060101 «Лечебное дело»
- •Задания по модулю №2 «Элементы химической термодинамики. Элементы химической кинетики» для специальности 060101 «Лечебное дело»
- •Задания по модулю №2 «Элементы химической термодинамики. Элементы химической кинетики» для специальности 060101 «Лечебное дело»
- •Задания по модулю №2 «Элементы химической термодинамики. Элементы химической кинетики» для специальности 060101 «Лечебное дело»
- •Задания по модулю №2 «Элементы химической термодинамики. Элементы химической кинетики» для специальности 060101 «Лечебное дело»
- •Задания по модулю №2 «Элементы химической термодинамики. Элементы химической кинетики» для специальности 060101 «Лечебное дело»
- •Задания по модулю №2 «Элементы химической термодинамики. Элементы химической кинетики» для специальности 060101 «Лечебное дело»
- •Задания по модулю №2 «Элементы химической термодинамики. Элементы химической кинетики» для специальности 060101 «Лечебное дело»
- •Задания по модулю №2 «Элементы химической термодинамики. Элементы химической кинетики» для специальности 060101 «Лечебное дело»
- •Задания по модулю №2 «Элементы химической термодинамики. Элементы химической кинетики» для специальности 060101 «Лечебное дело»
- •Задания по модулю №2 «Элементы химической термодинамики. Элементы химической кинетики» для специальности 060101 «Лечебное дело»
- •Задания по модулю №2 «Элементы химической термодинамики. Элементы химической кинетики» для специальности 060101 «Лечебное дело»
- •Ответы к модулю №2 «Элементы химической термодинамики. Элементы химической кинетики» для специальности 060101 «Лечебное дело»
Задания по модулю №2 «Элементы химической термодинамики. Элементы химической кинетики» для специальности 060101 «Лечебное дело»
Вариант №6
Для реакции гидролиза карбоната натрия:
![]()
скорость в начальный
момент соответствовала 2·10–3
![]() ,
константа скорости при 273К равна
2·10–2с–1.
Определите:
,
константа скорости при 273К равна
2·10–2с–1.
Определите:
Молекулярность (М) и порядок (П) реакции:
М=2, П=2;
М=2, П=1;
М=4, П=2.
Начальную концентрацию соды:
0,001 моль/дм3;
0,01 моль/дм3;
0,1 моль/дм3.
Выражение для константы скорости данной реакции и константы равновесия системы:
 ;
; ;
; .
.
Значение константы равновесия реакции если
![]() =
–1047,7 кДж/моль,
=
–1047,7 кДж/моль,
![]() =
–1127,7 кДж/моль,
=
–1127,7 кДж/моль,
![]() =
–377,0 кДж/моль,
=
–377,0 кДж/моль,
![]() =
–237,5 кДж/моль:
=
–237,5 кДж/моль:
2,55·10–38;
2·1038;
20.
Смещение равновесия при разбавлении раствора соды (путём анализа изотермы реакции)
Δ
 G<0
G<0Δ
 G>0
G>0Δ
 G=0
G=0
Целесообразность проведения процесса при повышенной температуре, если известно, что энтропия процесса равна 95 Дж/моль∙К, а константы скорости этой реакции при 273 и 280 К соответственно равны 2·10–5 и 5,72·10–5 с.
ΔН= –190,7 кДж/моль, Еа=95,37 кДж/моль, повышение температуры необходимо для увеличения скорости реакции;
ΔН= +190,7 кДж/моль, Еа=95,37 кДж/моль, повышения температуры требует термодинамический фактор (эндотермический процесс);
повышение температуры не является необходимым.
Задания по модулю №2 «Элементы химической термодинамики. Элементы химической кинетики» для специальности 060101 «Лечебное дело»
Вариант №7
Скорость реакции
NO
c
Н2
возрастает прямо пропорционально
квадрату парциального давления NO
(при
![]() –const)
и прямо пропорционально давлению Н2
(при
–const)
и прямо пропорционально давлению Н2
(при
![]() –const).
Дописать уравнение реакции, учитывая,
что коэффициенты соответствуют
показателям степени в кинетическом
уравнении и определить:
–const).
Дописать уравнение реакции, учитывая,
что коэффициенты соответствуют
показателям степени в кинетическом
уравнении и определить:
Молекулярность (М) и порядок (П) реакции:
без знания механизма М определить нельзя; П=5;
М=3, П=3;
без знания механизма М определить нельзя, П=3.
Как изменится скорость реакции при увеличении общего давления вдвое?
увеличится в 2 раза;
увеличится в 8 раз;
уменьшится в 2 раза.
Выражение для константы равновесия системы и его вывод
 ;
; ;
; .
.
Значение константы равновесия реакции, если ΔGº(NO)=86,69 кДж/моль, ΔGº(Н2O)= –228,8 кДж/моль, ΔGº(N2O)=103,6 кДж/моль:
1·1052;
2,3·1052;
2,3·1050.
Смещение равновесия при уменьшении давления (дать мотивированный ответ)


смещение равновесия отсутствует.
Во сколько раз возрастёт скорость процесса при повышении температуры с 20º до 30ºС, если энергия активации равна 65,9 кДж/моль:
3;
2,54;
2,45.
Задания по модулю №2 «Элементы химической термодинамики. Элементы химической кинетики» для специальности 060101 «Лечебное дело»
Вариант №8
Установлено, что сложная реакция
![]()
является реакцией 1-го порядка по каждому из участвующих в ней веществ. Определите:
Молекулярность (М) и порядок (П) реакции:
М=6, П=6;
М=4, П=2;
П=2, М определить нельзя.
Как изменится скорость обратной реакции при увеличении давления в 2 раза?
увеличится в 8 раз;
уменьшится в 8 раз;
увеличится в 2 раза.
Энтальпию образования Р2О5, если известно, что
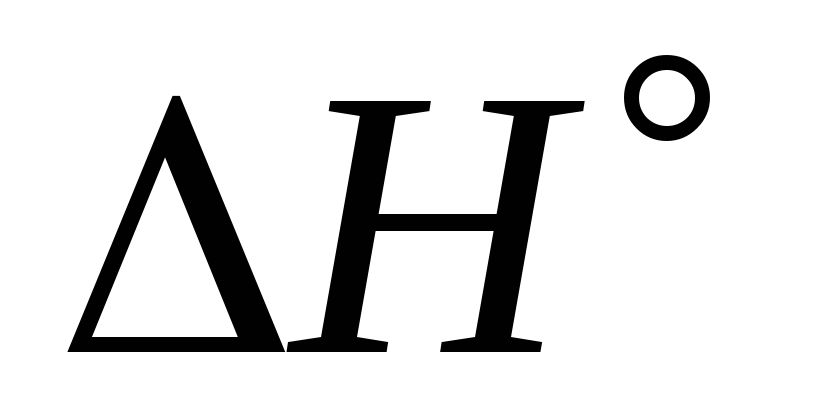 реакции равна
реакции равна
–222,86 кДж/моль, а
![]() =
–241,8 кДж/моль,
=
–241,8 кДж/моль,![]() =
–997,5 кДж/моль:
=
–997,5 кДж/моль:
+1492,5 кДж/моль;
–1492,5 кДж/моль;
–14,925 кДж/моль.
Направление процесса в закрытой и открытой системах, учитывая, что энтропии веществ Дж/моль∙К равны:
 ,
, ,
, ,
, :
:Δ
 Gº=
–56 кДж/моль
Gº=
–56 кДж/мольΔ
 Gº=
1492,5 кДж/моль
Gº=
1492,5 кДж/мольΔ
 Gº=
+56 кДж/моль
Gº=
+56 кДж/моль
Направление смещения равновесия при повышении температуры (путём анализа изобары реакции)
смещение равновесия не наблюдается;


Необходимость повышения или понижения температуры для оптимального прохождения процесса, учитывая энтальпию реакций и значения констант скорости реакции: k1(20ºС)=0,055 мин–1; k2(40ºС)=0,156 мин–1:
ΔН<0, Еа=41,84 кДж/моль, термодинамический фактор требует понижения температуры;
ΔН<0, Еа=41,84 кДж/моль, кинетический фактор требует повышения температуры;
необходимости в повышении или понижении температуры нет.
