
- •Классы органических соединений
- •Изомерия
- •Номенклатура
- •Углеводороды
- •Ациклические углеводороды
- •Алициклические углеводороды
- •Ароматические углеводороды
- •Галогенпроизводные углеводородов
- •Элементоорганические соединения
- •Органические кислоты
- •Оксикислоты (гидроксикислоты)
- •2С17н35соон стеариновая кислота
- •Фосфатиды
- •Стеарины
- •Углеводы
- •Моносахариды
- •Дисахариды
- •Полисахариды
- •Азотсодержащие соединения Амины
- •Аминокислоты
- •Красители
- •Азокрасители
- •Трифенилметановые красители
- •Индигоидные красители
- •Антрахиноновые красители
- •Техническая классификация красителей
- •Гетероциклические соединения
Галогенпроизводные углеводородов
Галогенопрошводные углеводородов – это органические соединения, образующиеся при замене атомов водорода в углеводородах на атомы галогена. Например, СН3Сl– хлористый метил, СНСl3–хлороформ, ССl4– четырёххлористый углерод. Характерной особенностью галогенопроизводных является лёгкость замещения атома галогена на другие атомы или группы атомов, поэтому их широко используют для синтеза различных соединений.
Получают галогенопроизводные различными методами: действием галогенов на углеводороды, из спиртов и других веществ.
СН3–СН3+ Сl2![]() СН3–СН2Сl+
НСl
СН3–СН2Сl+
НСl
С6Н6+ Сl2![]() C6H5Cl+HCl
C6H5Cl+HCl
R–ОН + РСl5![]() RCl+HCl+ РОСl3
RCl+HCl+ РОСl3
СН3–СН=СН2+HCl![]() СН3–CHCl–СН32-хлорпропан
СН3–CHCl–СН32-хлорпропан
СН=СН + HCl![]() СН2=СНСlвинилхлорид
СН2=СНСlвинилхлорид
Из галогенопроизводных ненасыщенных углеводородов получают пластмассы и каучуки (например, полихлорвинилы, хлоропреновые каучуки и т.д.).
Путем полимеризации получают
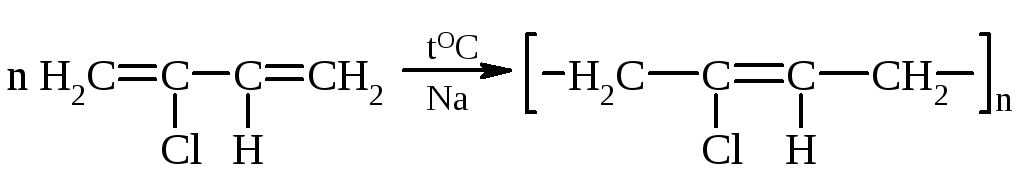
хлоропрен наирит
Путем сополимеризации получаются более износостойкие каучуки.
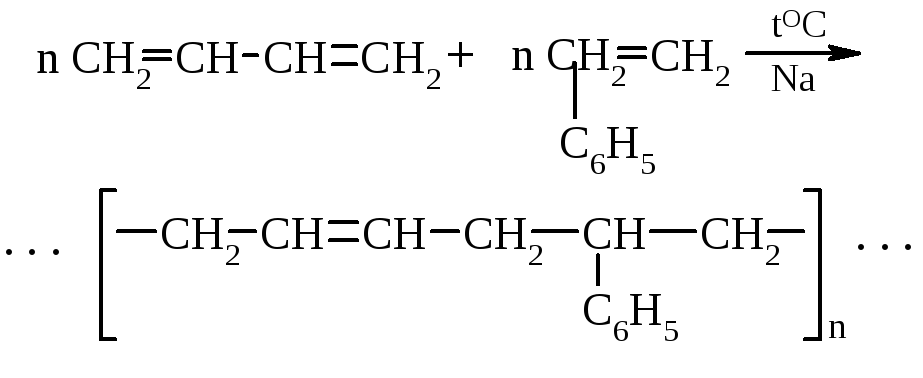
бутадиен – стирольный каучук
Многие из этих каучуков обладают ценными специфическими свойствами, выгодно отличающими их от природных каучуков.
Элементоорганические соединения
Металлоорганические соединения всё шире применяются в промышленности. Очень многие металлы могут занимать место углерода в органических молекулах или связывать эти молекулы в более сложные соединения, например тетраэтилсвинец (С2Н5)4Рb, который улучшает антидетонационные свойства бензина.
Большое будущее принадлежит силикону – каучуку из кремнезёма.

Вместо этильных групп могут быть и другие радикалы, что придаёт синтезируемым продуктам специфические свойства.
Силикон сохраняет эластичность от –60 до 200°С, устойчив к действию органических растворителей, масел, озону, ультрафиолетовому свету. Он может быть получен и в виде масел, вязкость которых очень мало зависит от температуры.
Элементоорганические соединения чаще всего в своём составе содержат фосфор и являются сильными отравляющими веществами.

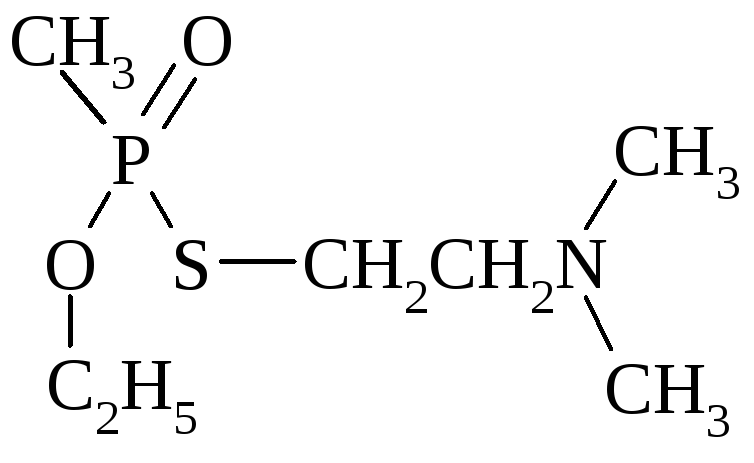
хлорофос V-газы
Но есть и фосфорорганические соединения, применяемые как лекарственные препараты.
СПИРТЫ
Спирты – это производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на гидроксильную группу –ОН. По числу гидроксильных групп в молекуле спирты делятся на одноатомные, двухатомные и т. д.
Различают первичные, вторичные, третичные одноатомные спирты (изомерия положения гидроксильных групп). Для спиртов существует и структурная изомерия.
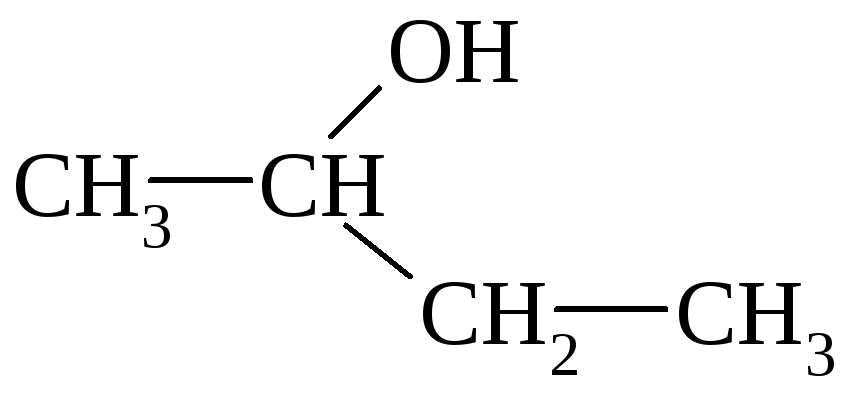 2-бутанол; вторичный бутиловый спирт
2-бутанол; вторичный бутиловый спирт
 2-метил-2-пропанол;
третичный бутиловый спирт
2-метил-2-пропанол;
третичный бутиловый спирт
По международной (систематической) номенклатуре в названии спирты имеют окончание «ол» – метанол, этанол, однако низшим спиртам дают и тривиальные названия (винный спирт).
Представителями многоатомных спиртов являются этиленгликоль, глицерин.
![]()
![]()
этиленгликоль глицерин
1,2-этандиол 1,2,3-пропантриол
Спирты могут быть предельными (СН3–СН2ОН, этиловый спирт) и непредельными (СН2=СН–СН2–ОН, аллиловый спирт). Ароматические спирты в своем составе имеют бензольное кольцо и боковую цепь.
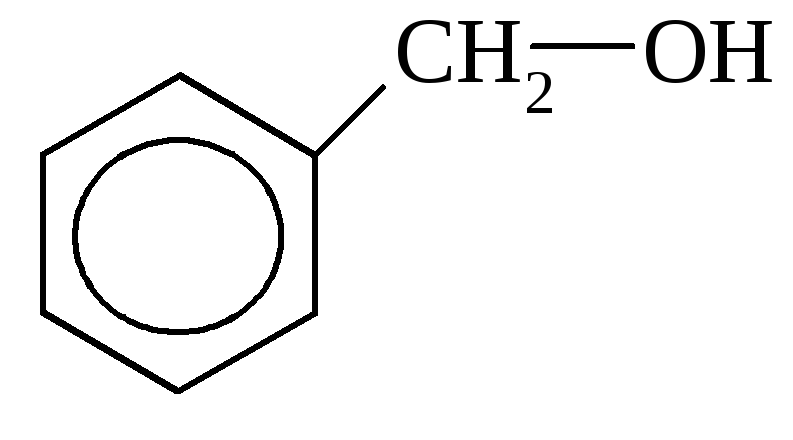
бензиловый спирт
Получают спирты гидролизом галогенопроизводных, присоединением воды к алкенам, восстановлением альдегидов и кетонов, спиртовым брожением глюкозы, полученной гидролизом крахмала и целлюлозы или синтезом из смеси газов СО + Н2.
Физические свойства. Первые представители гомологического ряда спиртов – жидкости, высшие спирты – твёрдые вещества. Метанол, этанол и пропанол смешиваются с водой в любых соотношениях. С ростом молекулярной массы растворимость спиртов в воде резко падает.
Многоатомные спирты – этиленгликоль и глицерин – хорошо растворимые в воде жидкости.
Химические свойства.
1. Взаимодействие спиртов со щелочными металлами (образование алкоголятов).
2СН3–СН2–ОН + 2Na![]() 2СН3–СН2–ONa+H2↑
2СН3–СН2–ONa+H2↑
этилат натрия
2. Образование простых эфиров (межмолекулярная дегидратация спиртов).
2СН3–СН2–ОН![]() С2H5–O–C2Н5+ Н2О
С2H5–O–C2Н5+ Н2О
этанол диэтиловый эфир
3. Образование сложных эфиров (реакция этерификации).
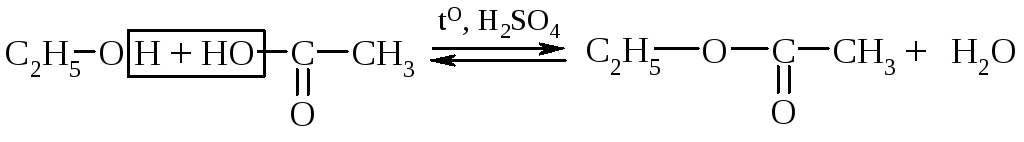
этанол уксусная кислота уксусно-этиловый эфир
(этилацетат)
4. Окисление спиртов:
а) Мягкое окисление.
П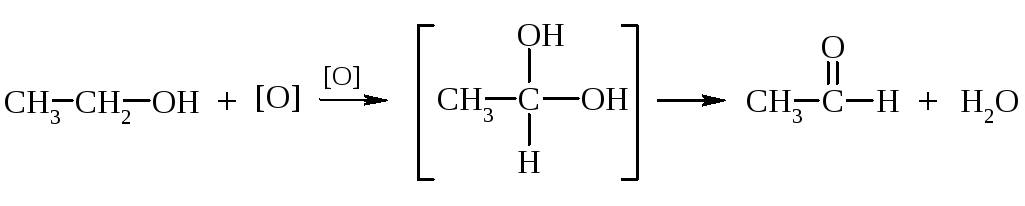 ервичные
спирты окисляются в альдегиды, а вторичные
– в кетоны.
ервичные
спирты окисляются в альдегиды, а вторичные
– в кетоны.
этанол уксусный альдегид
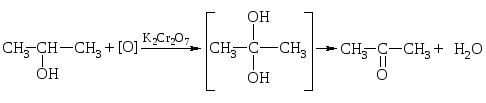
2-пропанол ацетон
б) Жесткое окисление.
горение
СН3–СН2–ОН + 3О2![]() 2СО2+ ЗН2О
2СО2+ ЗН2О
этанол
5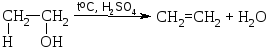 .
Внутримолекулярная дегидратация спиртов
(образование ал-кенов).
.
Внутримолекулярная дегидратация спиртов
(образование ал-кенов).
этилен
Многоатомные спирты со щелочными металлами образуют полные и неполные гликоляты, с минеральными и органическими кислотами – полные и неполные эфиры.
Процесс окисления гликолей идет ступенчато:
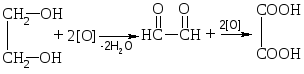
глиоксаль
этиленгликоль щавелевая кислота
Глицерин – представитель трёхатомных спиртов, получают его из жиров или синтетически из пропилена или ацетилена.
Химические свойства глицерина близки к свойствам гликолей. Взаимодействие глицерина с неорганическими и органическими кислотами:

нитроглицерин

триацетат глицерина
Глицерин подвергается дегидратации с образованием акролеина.
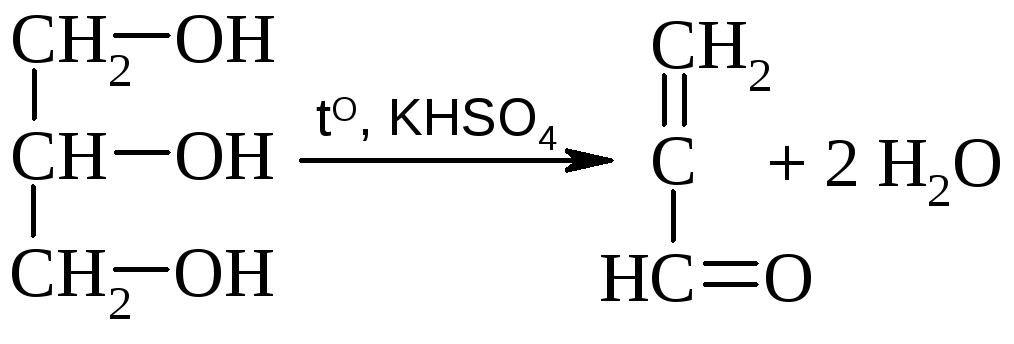
акролеин
Качественной реакцией на многоатомные спирты, с помощью |которой их отличают от одноатомных, является реакция с Cu(ОН)2:
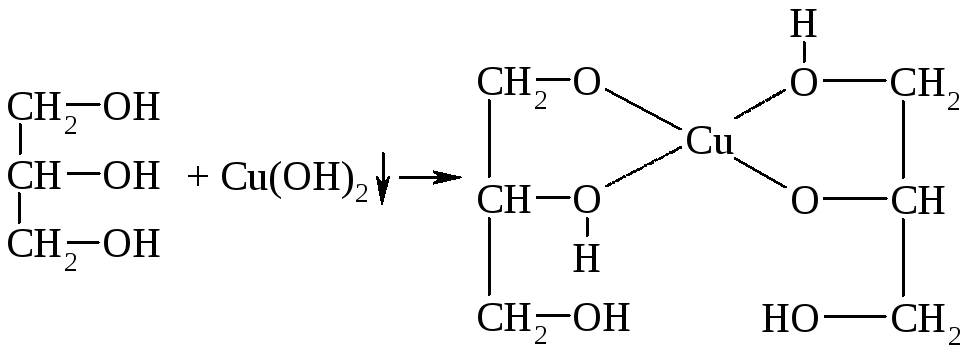
глицерат меди
Глицерат меди хорошо растворяется в воде и имеет ярко-синий цвет.
Многоатомные (сахарные) спирты, ксилит, сорбит, маннит, получают восстановлением ксилозы, глюкозы, маннозы.
Ксилит образуется при восстановлении ксилозы, которую получают из отрубей, шелухи подсолнечника:
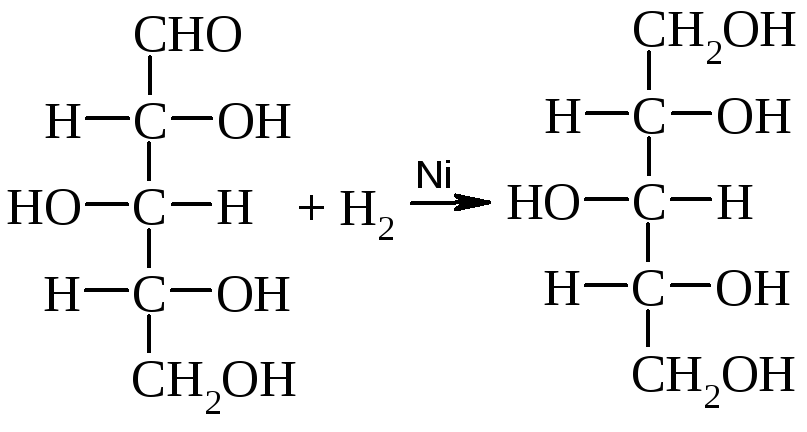
D-ксилозаD-ксилит
Сорбит получают восстановлением глюкозы:

D-глюкозаD-сорбит
Сорбит является исходным веществом для получения аскорбиновой кислоты.
ФЕНОЛЫ
Фенолами называются производные ароматических углеводородов, в которых один или несколько атомов водорода бензольного ядра замещены гидроксильными группами.
В зависимости от числа гидроксильных групп фенолы делятся на:
а) одноатомные
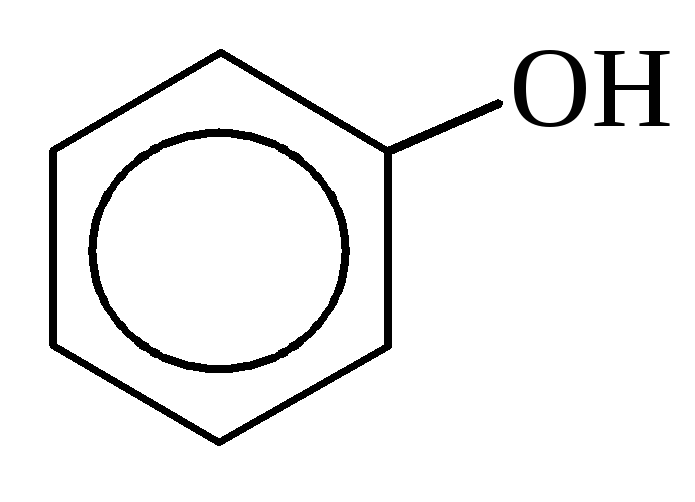
фенол
б) двухатомные

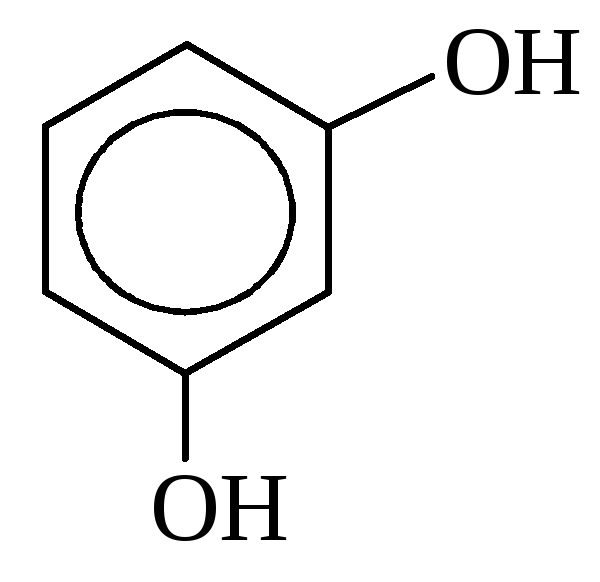
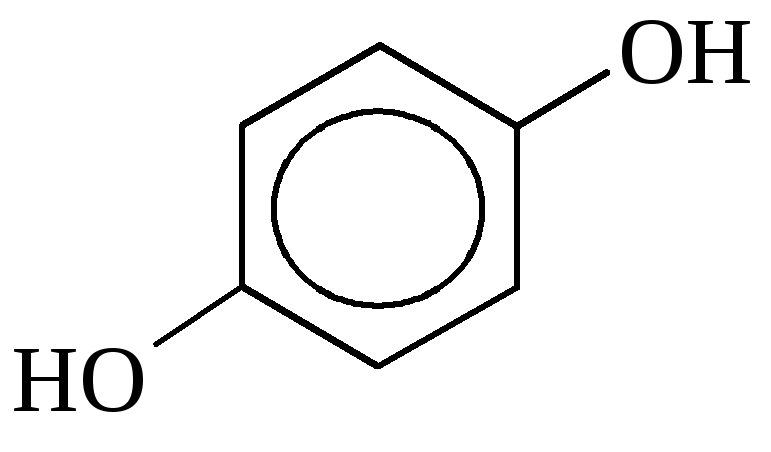
пирокатехин резорцин гидрохинон
в) трёхатомные
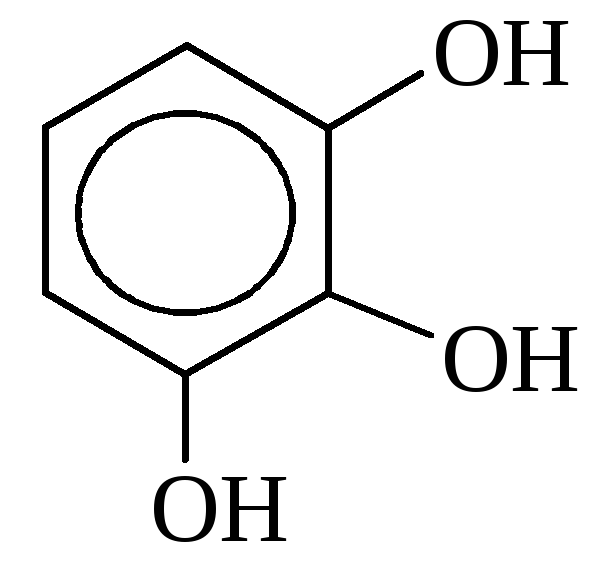
пирогаллол
Физические свойства. Все фенолы – твёрдые вещества. Одноатомные фенолы имеют сильный специфический запах, очень ядовиты, при попадании на кожу вызывают сильные химические ожоги.
Фенолы растворимы в спирте, эфире, бензоле, плохо растворимы в воде. Растворимость фенолов зависит от температуры, от числа гидроксильных групп в молекуле фенола и их расположения.
Химические свойства фенолов определяются наличием в молекуле как гидроксильной группы, так и бензольного кольца.
1. Кислотные свойства – фенолы реагируют с водными растворами щелочей с образованием фенолятов, которые хорошо растворяются в воде:
С6Н5ОН +NaOH![]() C6H5ONa+ Н2О.
C6H5ONa+ Н2О.
фенолят натрия
2. Образование простых эфиров:
С6Н5ОН + Вr–СН3![]() С6Н5–О–СН3+ КBr.
С6Н5–О–СН3+ КBr.
метилфениловый эфир
3. Образование сложных эфиров (ацилирование):
![]()
хлорангидрид фениловый эфир
уксусной кислоты уксусной кислоты
4. Цветная реакция фенолов с FeCl3(качественная реакция) даёт интенсивное сине-фиолетовое или бурое окрашивание.
5. Реакции электрофильного замещения: гидроксильная группа, являясь ориентантом первого рода, направляет новый заместитель (электрофильную частицу) в орто-, параположение:
а) Реакция бромирования:

2,4,6-трибромфенол
б )
Реакция нитрования:
)
Реакция нитрования:
о-нитрофенол
п-нитрофенол
Фенолы легко окисляются даже кислородом воздуха, при этом изменяют свой цвет. Фенолы обладают антисептическими свойствами, например, карболовая кислота; эти свойства определяются способностью фенолов денатурировать белки. Гомологи фенола – крезолы – обладают более сильным бактерицидным действием, чем сам фенол.
Фенол (карболовая кислота) используется в медицине в небольших количествах, большое же количество фенола идёт на изготовление красителей, пикриновой кислоты, салициловых препаратов и других лекарственных веществ, инсектицидов, а также для производства синтетических смол – фенолоформальдегидных смол (бакелитов).
Пикриновая кислота (тринитрофенол) применяется как взрывчатое и как красящее вещество (жёлтый цвет). Производное соединение – хлорпикрин применяют для борьбы с некоторыми видами насекомых.
Фенолоформальдегидные смолы, применяемые с наполнителями, называются фенопластами: карболит (смола + древесная мука), текстолит (смола + хлопчатобумажная ткань), гетинакс (смола + бумага), стеклотекстолит (смола + стекловолокно) и т.д.
Применяют смолы и для изготовления ионитов, которые используются для умягчения воды, для выделения из смесей различных органических веществ, например витаминов, и как лекарственные препараты.
Получение фенолоформальдегидных смол основано на реакции поликонденсации фенола и формальдегида.
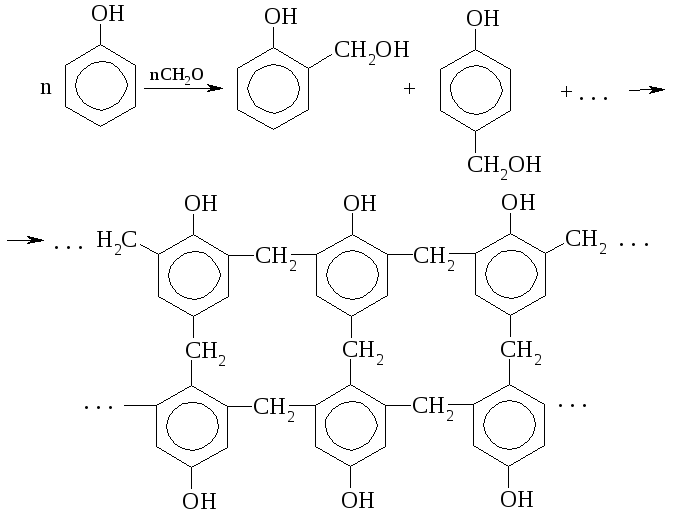
Многие алкилфенолы благодаря лёгкой окисляемости применяются в качестве антиоксидантов (ингибиторов). Прекрасным консервантом являются эфиры п-оксибензойной кислоты.
Гидрохинон легко окисляется и поэтому используется в фотографии. Пирокатехин содержится в дубильных веществах, а его производным является гормон адреналин (сужает кровеносные сосуды). Пирогаллол очень легко окисляется и поэтому используется при анализе газов, при синтезе красителей.
Нафтолы – вещества, аналогичные фенолам, обладают дезинфицирующими свойствами и применяются для производства красителей.

нафталин α-нафтол
Хинонами называются шестичленные циклические дикетоны с двумя двойными связями, например:
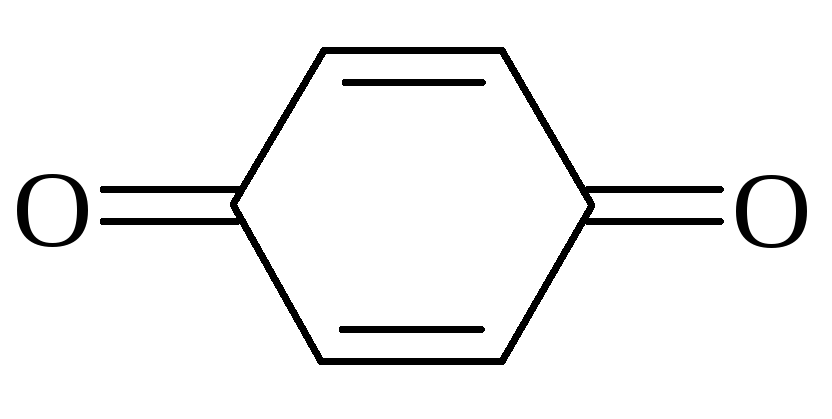
(парабензохинон)
Витамин К является производным нафтохинона, содержится в зелёных травах, листьях, овощах; представляет собой жёлтое масло, нерастворимое в воде; препятствует кровоизлиянию сосудов.

Ароматические спирты – соединения, у которых гидроксильная группа связана с бензольным кольцом через атомы углерода:
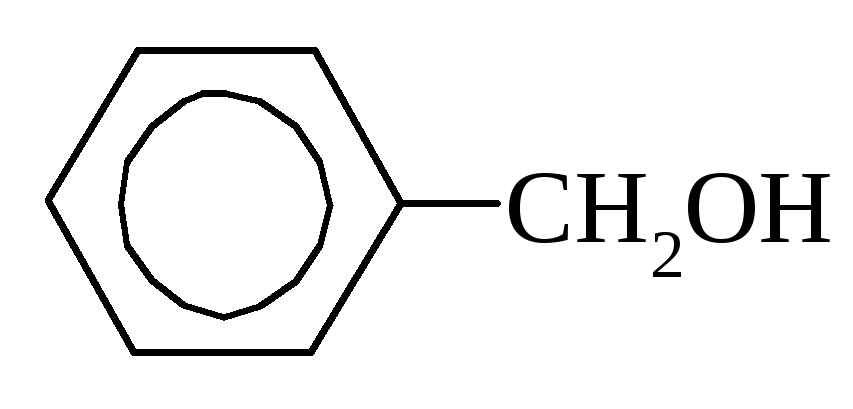 бензиловый спирт
бензиловый спирт
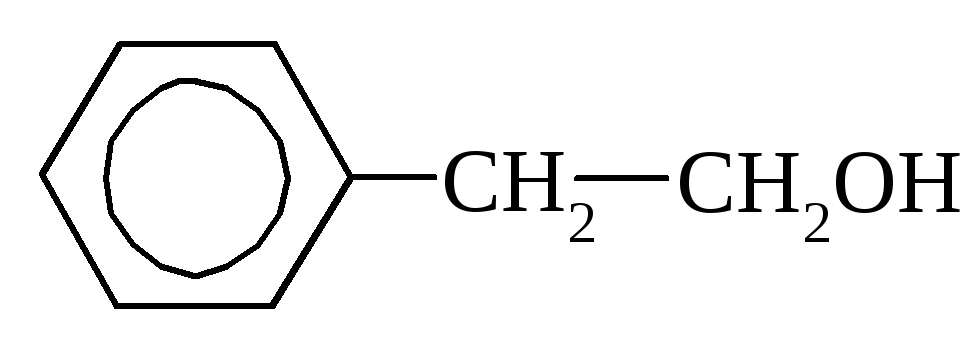 2-фенилэтиловый спирт
2-фенилэтиловый спирт
Некоторые из ароматических спиртов входят в состав розового и других цветочных масел и используются в парфюмерии. Их химические свойства аналогичны алифатическим спиртам, но они способны проявлять и свойства ароматических соединений.
