
- •2.2. Функциональные производные углеводородов. Галогенпроизводные углеводородов
- •Строение и номенклатура
- •Химические свойства
- •Особенности реакций ароматических галогенопроизводных с галогеном в ароматическом ядре
- •II. Реакции отщепления.
- •Физические свойства галогенопроизводных, их применение
- •Способы получения галогенопроизводных
- •Задания для выполнения кр № 2 по теме «функциональные производные углеводородов. Галогенопроизводные углеводородов» Галогенпроизводные углеводородов
- •2.3. Функциональные производные углеводородов. Кислородсодержащие производные углеводородов
- •2.3.1.Спирты
- •Химические свойства одноатомных спиртов
- •Способы получения одноатомных спиртов
- •Особенности многоатомных спиртов
- •Химические свойства
- •Физические и пожароопасные свойства многоатомных спиртов, их применение
- •Способы получения
- •Строение фенола
- •Химические свойства
- •Физические свойства и применение
- •Способы получения
- •Простые эфиры
- •Химические свойства
- •Физические и пожароопасные свойства простых эфиров
- •Способы получения простых эфиров
- •2.3.2. Альдегиды и кетоны
- •Номенклатура альдегидов и кетонов
- •Химические свойства
- •Физические и пожароопасные свойства альдегидов и кетонов, их применение
- •Способы получения альдегидов и кетонов
- •2.3.3. Карбоновые кислоты
- •Физические свойства.
- •Химические свойства
- •Особенности ненасыщенных карбоновых кислот.
- •Важнейшие представители карбоновых кислот и их производных.
Способы получения альдегидов и кетонов
Окисление спиртов.


Гидратация алкинов.

Оксосинтез.
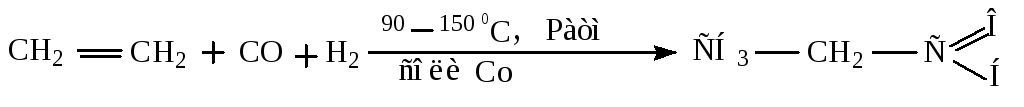
2.3.3. Карбоновые кислоты
Карбоновые кислоты – производные углеводородов, содержащие карбоксильную группу -СООН.
Классификация карбоновых кислот:
Предельные монокарбоновые кислоты – производные алканов, содержащие одну карбоксильную группу;
Предельные ди- и поликарбоновые кислоты – производные алканов, содержащие две и более карбоксильных групп;
Непредельные моно, ди- и поликарбоновые кислоты – производные непредельных углеводородов;
Ароматические карбоновые кислоты – производные ароматических углеводородов.
Номенклатура карбоновых кислот.
Названия карбоновых кислот образуют от названий родоначальных углеводородов с тем же числом атомов углерода, считая и атом углерода карбоксильной группы, с добавлением окончания -овая кислота. Нумерацию начинают от атома углерода карбоксильной группы.
Многие карбоновые кислоты имеют тривиальные названия.
Примеры карбоновых кислот:
НСООН – метановая кислота; муравьиная кислота;
СН3СООН – этановая кислота; уксусная кислота;
СН3СН2СООН – пропановая кислота; пропионовая кислота;
СН3(СН2)2СООН – бутановая кислота; масляная кислота;
и т.д.
СН2=СН-СООН – 2-пропеновая кислота; акриловая кислота;

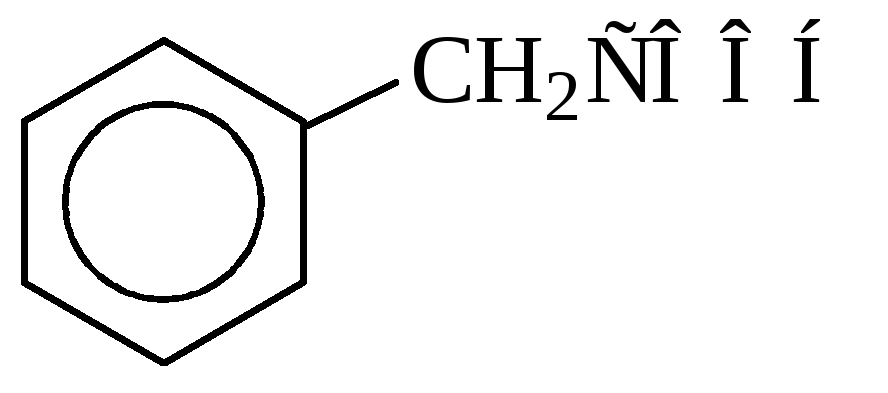
бензойная кислота фенилуксусная кислота
При отнятии у карбоновой кислоты группы ОН получают остаток карбоновой кислоты – ацильную группу :
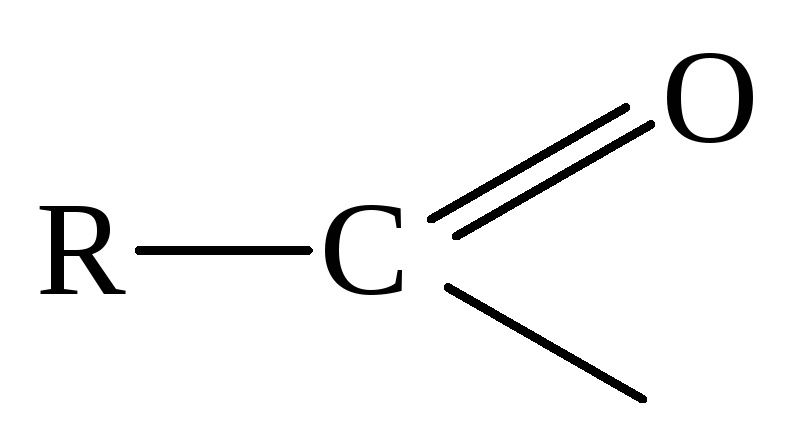
Названия ацильных групп образуют из названий соответствующих карбоновых кислот, наиболее часто из тривиальных латинских названий, если такие есть.
Примеры ацильных групп:
НСО - формил
СН3СО- ацетил
СН3СН2СО- пропионил
СН3СН2СН2СО- бутирил
и т.д.
Строение карбоксильной группы.

Атом углерода в карбоксильной группе находится в sp2 гибридном состоянии, углы между - связями 120, поэтому группа плоская. Неподеленная пара электронов кислородного атома гидроксильной группы взаимодействует с -электронами карбонильной группы. Это увеличивает полярность связи О-Н, но в то же время уменьшает положительный заряд на углеродном атоме по сравнению с карбонильными соединениями. В связи с этим реакции нуклеофильного присоединения по карбонильной группе не проходят, но увеличивается кислотность связи О-Н. Длины связей:
lС=О = 0.124нм; lC-O = 0.131 нм; lO-H = 0.095 нм.
Физические свойства.
Насыщенные монокарбоновые кислоты – бесцветные жидкие или кристаллические вещества с острым и своеобразным запахом. Высшие кислоты (С15-С18) имеют слабый запах стеарина. Они имеют высокие температуры кипения, что свидетельствует о межмолекулярной ассоциации вследствие образования межмолекулярных водородных связей.
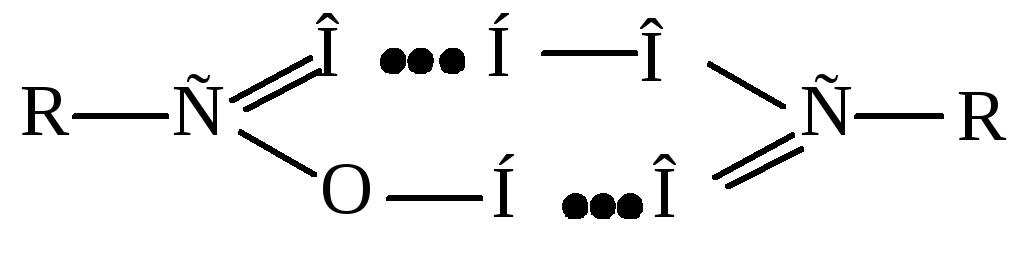
Карбоновые кислоты образуют водородные связи и с молекулами воды.

Химические свойства
Кислотность.
Уравнение кислотной ионизации карбоновых кислот:
R- COOH + H2O R-COO- + H3O+
карбоксилат-ион
Карбоксилат-ион построен симметрично и имеет систему сопряженных связей.
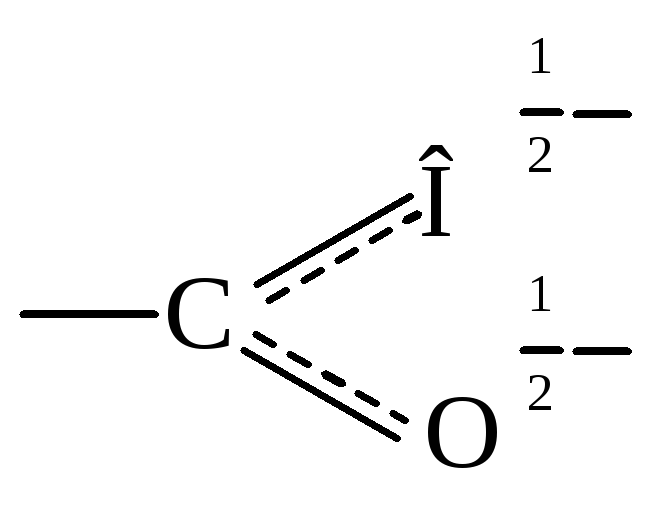
Оба атома кислорода одинаково связаны с атомом углерода и несут по половине заряда аниона. Данные рентгеноструктурного анализа показали, что длина связи l C-O = 0.127нм.
Введение в молекулу карбоновой кислоты электронодонорных заместителей уменьшает кислотность, а введение электроноакцепторных – увеличивает кислотность карбоновых кислот. Так, монохлоруксусная кислота в 10 раз сильнее уксусной кислоты, а трихлоруксусная – в 10000 раз. Ароматические кислоты сильнее алифатических (жирных) кислот.
Солеобразование.
Кислоты образуют соли с однозарядными, двухзарядными и трехзарядными ионами металлов.
R-COOH + NaOH R-COONa + H2O
Соли щелочных металлов растворяются в воде. Щелочные соли высших жирных карбоновых кислот (С14-С20) – мыла. Мыла в воде гидролизуются.
R-COONa + H2O R-COOH + NaOH
Протонирование карбоновых кислот.
В кислой среде происходит присоединение протона к карбонильной группе.
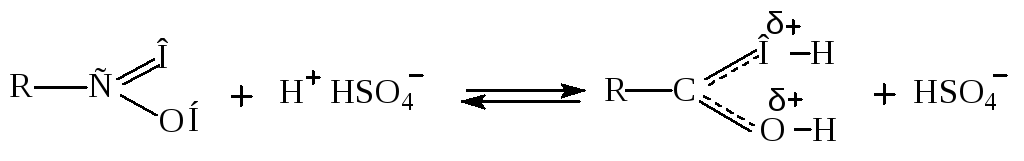
В протонированной форме оба атома кислорода становятся одинаковыми. Её можно представить следующими резонансными структурами.

Реакции нуклеофильного замещения в карбоксильной группе.
Реакции нуклеофильного замещения позволяют получать функциональные производные карбоновых кислот. Все функциональные производные содержат ацильную группу:

сложный эфир хлорангидрид ангидрид амид
карбоновой кислоты карбоновой кислоты карбоновой кислоты
Механизм нуклеофильного замещения:
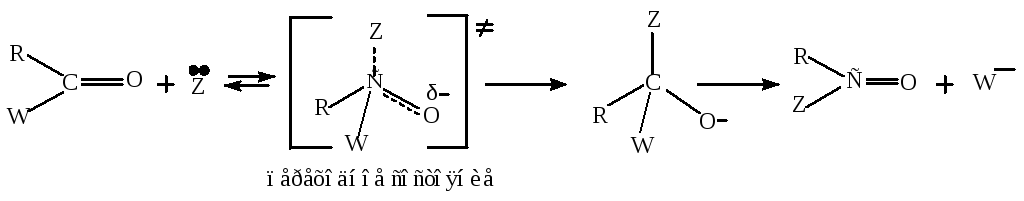
Реакции нуклеофильного замещения могут катализироваться кислотами.
Примеры реакций нуклеофильного замещения:
1) Получение сложных эфиров.
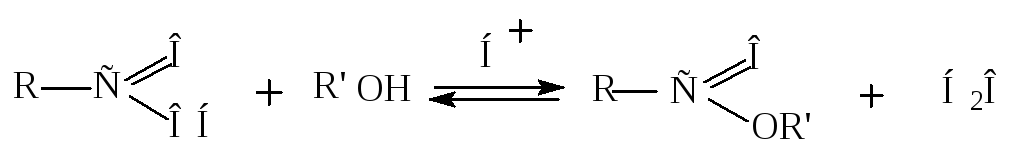
Взаимодействие карбоновых кислот со спиртами называется реакцией этерификации. Катализаторами реакции являются конц. H2SO4, HCl (сухой, газ.) и др. Реакция этерификации является равновесной. Обратная реакция (взаимодействие сложного эфира с водой ) называется реакцией гидролиза. Для смещения равновесия в сторону образования эфира либо берут избыток спирта, либо удаляют образующуюся воду в виде воднобензольного азеотропа.
2) Получение хлорангидридов карбоновых кислот.
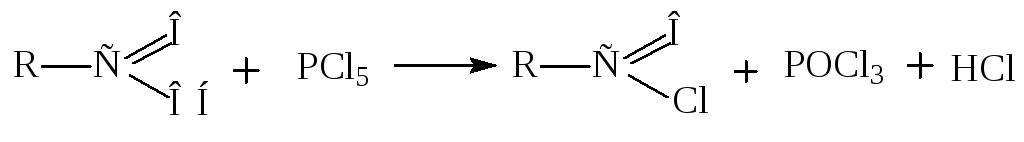
Кроме пятихлористого фосфора реагентами могут быть тионилхлорид, фосген.
3) Получение ангидридов карбоновых кислот.

4) Получение амидов карбоновых кислот.
а) из аммонийных солей карбоновых кислот.

б) из хлорангидридов.
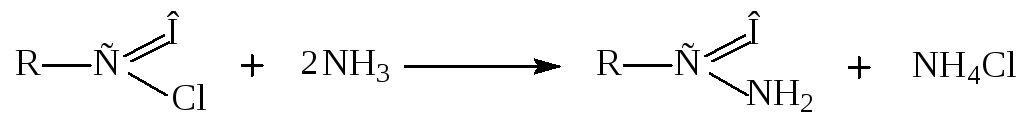
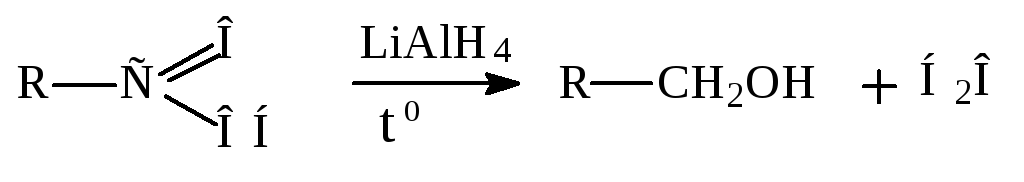
Восстановление карбоновых кислот.
Окисление карбоновых кислот.
В отличие от других карбоновых кислот окислению подвергается муравьиная кислота, так как она содержит формальноальдегидную группу
![]() .
.
При действии окислителей она превращается в СО2 и Н2О.
![]()
Реакции у - углеродного атома.
Водородные атомы у -углеродного атома более подвижны, чем другие водородные атомы углеродной цепи. Возможно их замещение, например галогеном.
Пример:

Декарбоксилирование карбоновых кислот.
При нагревании натриевых солей карбоновых кислот со щелочью до 3000С образуются углеводороды.
Пример:

Пиролиз кальциевых солей карбоновых кислот.
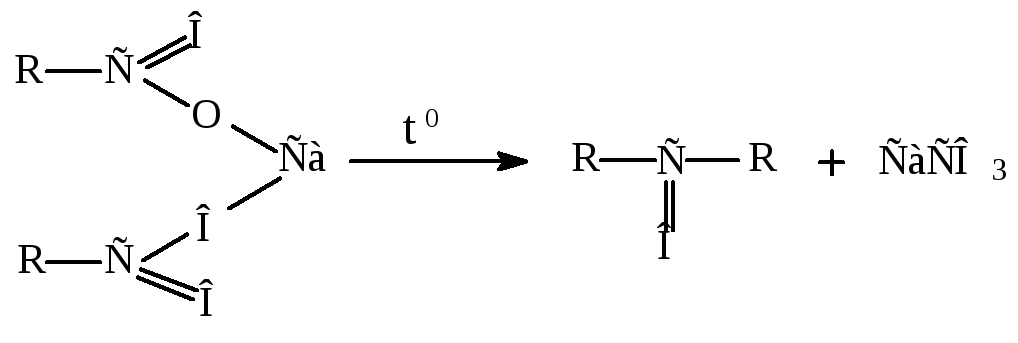
кетон
