
- •2.2. Функциональные производные углеводородов. Галогенпроизводные углеводородов
- •Строение и номенклатура
- •Химические свойства
- •Особенности реакций ароматических галогенопроизводных с галогеном в ароматическом ядре
- •II. Реакции отщепления.
- •Физические свойства галогенопроизводных, их применение
- •Способы получения галогенопроизводных
- •Задания для выполнения кр № 2 по теме «функциональные производные углеводородов. Галогенопроизводные углеводородов» Галогенпроизводные углеводородов
- •2.3. Функциональные производные углеводородов. Кислородсодержащие производные углеводородов
- •2.3.1.Спирты
- •Химические свойства одноатомных спиртов
- •Способы получения одноатомных спиртов
- •Особенности многоатомных спиртов
- •Химические свойства
- •Физические и пожароопасные свойства многоатомных спиртов, их применение
- •Способы получения
- •Строение фенола
- •Химические свойства
- •Физические свойства и применение
- •Способы получения
- •Простые эфиры
- •Химические свойства
- •Физические и пожароопасные свойства простых эфиров
- •Способы получения простых эфиров
- •2.3.2. Альдегиды и кетоны
- •Номенклатура альдегидов и кетонов
- •Химические свойства
- •Физические и пожароопасные свойства альдегидов и кетонов, их применение
- •Способы получения альдегидов и кетонов
- •2.3.3. Карбоновые кислоты
- •Физические свойства.
- •Химические свойства
- •Особенности ненасыщенных карбоновых кислот.
- •Важнейшие представители карбоновых кислот и их производных.
2.3. Функциональные производные углеводородов. Кислородсодержащие производные углеводородов
2.3.1.Спирты
Спирты – гидроксилпроизводные углеводородов, у которых один или несколько атомов водорода замещены на гидроксильную группу (ОН). В группу гидроксилпроизводных углеводородов со связью С(sp3) – OH входят:
а) гидроксилпроизводные алканов – насыщенные одноатомные спирты или алканолы;
б) гидроксилпроизводные алкенов и алкинов – ненасыщенные одноатомные спирты или алкенолы и алкинолы;
в) ди-, три- и полигидроксилпроизводные – диолы, триолы и полиолы (многоатомные спирты).
Спирты делят на первичные, вторичные и третичные в зависимости от атома углерода, с которым связана гидроксильная группа. Изомерия спиртов определяется местом гидроксильной группы в углеродной цепи и разветвлением цепи.
Примеры:
СН3ОН – метанол; метиловый спирт (первичный спирт)
СН3СН2ОН – этанол; этиловый спирт (первичный спирт)
СН3СН2СН2ОН – 1 – пропанол; пропиловый спирт (первичный спирт)

(вторичный спирт)
По номенклатуре ИЮПАК углеродные цепи спиртов нумеруют таким образом, чтобы гидроксильная группа имела меньший номер. Гидроксильная группа обозначается суффиксом ол. Если молекула имеет очень сложное строение, то гидроксильную группу обозначают префиксом гидрокси- (или окси-).
Спирты содержат в молекуле две полярные связи:

На атоме кислорода имеются две неподеленные электронные пары, поэтому спирты проявляют электронодонорные свойства.

Угол между С-О-Н ( угол ) равен 109 28. Энергия связи С-О равна 350 кДж/моль, а связи О-Н – 463 кДж/моль.
Химические свойства одноатомных спиртов
Реакции, протекающие с разрывом связи С-О.
Взаимодействие с галогеноводородами.
Пример:
СН3СН2ОН
+ HBr
![]() CH3CH2Br
+ H2O
CH3CH2Br
+ H2O
Спирты по реакционной способности располагаются в ряд:
трет. спирты втор. спирты перв. спирты
Галогеноводороды по реакционной способности располагаются в ряд:
HI HBr HCl
Взаимодействие с галогенангидридами неорганических кислот (PCl3, PCl5, PBr3, SOCl2).
Примеры:
СН3СН2ОН
+ PCl5
![]() СН3СН2Cl
+ POCl3
+ HCl
СН3СН2Cl
+ POCl3
+ HCl
СН3СН2ОН
+ SOCl2![]() СН3СН2Cl
+ SO2
+ HCl
СН3СН2Cl
+ SO2
+ HCl
Взаимодействие с серной кислотой.
Пример:
СН3СН2ОН
+ H2SO4
![]() СН3СН2ОSO3H
+ H2O
СН3СН2ОSO3H
+ H2O
Образование простых эфиров.
Пример:
СН3СН2ОН
+ СН3СН2ОН
![]() СН3СН2-О-СН2СН3
+ Н2О
СН3СН2-О-СН2СН3
+ Н2О
В качестве водоотнимающего средства используется концентрированная H2SO4. Эфиры образуются, если кислота взята не в избытке.
Дегидратация спиртов.
Пример:

Отщепление воды происходит в присутствии сильных кислот или над катализатором (Al2O3) при повышенной температуре.
Реакции, протекающие с разрывом связи О-Н.
Ионизация спиртов.
Эта реакция связана с высокой полярностью связи О-Н.
Пример:

В общем случае анионы называют: алкоксид-анион, алканолят-анион, алкоголят-анион.
Одноатомные спирты являются очень слабыми ОН-кислотами, слабее, чем вода. Это обусловлено (+I) – эффектом алкильных групп, увеличивающих ковалентность связи О-Н. Кислотность спиртов уменьшается в ряду:
СН3ОН перв. спирты втор. спирты трет. спирты
Спирты хорошо подвергаются ионизации в щелочной среде. Пример:
СН3ОН
+ ОН-
![]() СН3О-
+ Н2О
СН3О-
+ Н2О
Спирты взаимодействуют со щелочными металлами, но очень трудно с растворами щелочей.
Пример:
2СН3ОН
+ 2Na
![]() 2СН3ОNa
+ H2
2СН3ОNa
+ H2
Алканоляты легко гидролизуются.
Пример:
СН3ОNa
+ Н2О
![]() СН3ОН
+ NaOH
СН3ОН
+ NaOH
Алкилирование алканолятов (получение простых эфиров).
Пример:
СН3ОNa
+ СН3I
![]() СН3ОСН3
+ NaI
СН3ОСН3
+ NaI
Окисление одноатомных спиртов.
Окисление осуществляется кислородом воздуха в присутствии катализаторов (CuO, Cu) или различными неорганическими окислителями (KMnO4, Na2Cr2O7 + H2SO4, CrO3 и др.). Продуктами окисления являются альдегиды или кетоны, карбоновые кислоты.


Физические и пожароопасные свойства одноатомных спиртов, их применение
Одноатомные спирты – бесцветные жидкости или кристаллические вещества с характерным запахом. Своеобразным является высокая температура кипения спиртов, что вызвано значительным межмолекулярным взаимодействием – ассоциацией молекул. Ассоциация осуществляется за счет образования водородных связей между молекулами спирта вследствие полярности связи О-Н и наличием неподеленных электронных пар на атоме кислорода.
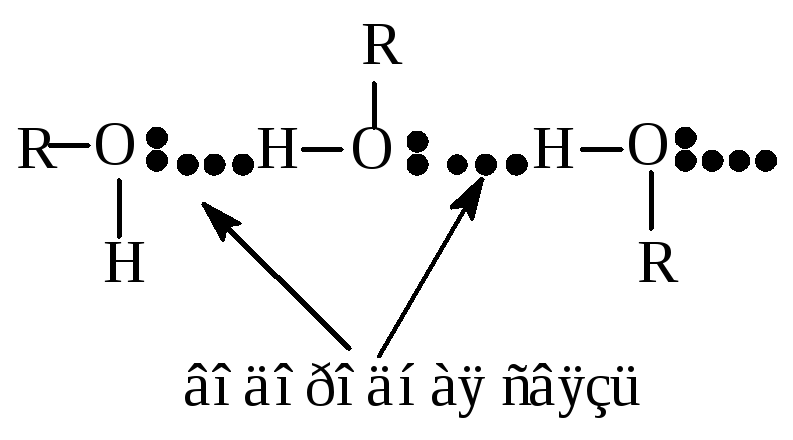
Низшие спирты хорошо растворяются в воде за счет образования водородных связей с молекулами воды.

Метиловый спирт (метанол) – бесцветная, легковоспламеняющаяся жидкость, с водой и многими органическими жидкостями смешивается в любых соотношениях. Метиловый спирт очень ядовит. Отравление спиртом приводит к потере зрения, часто к смертельному исходу. Пары спирта с воздухом образуют взрывчатые смеси. Концентрационные пределы воспламенения: НВП – 6%, ВПВ – 34,5%.. Водные растворы, содержащие 25% спирта и более, являются легковоспламеняющимися веществами. От контакта с сильными окислителями спирт самовозгорается.
Метанол используют в качестве растворителя и исходного вещества для синтеза простых и сложных эфиров. Большое количество метанола используется для получения формальдегида.
Этиловый спирт (этанол) и его водные растворы также представляют пожарную опасность. Этанол является дешевым растворителем, его применяют для изготовления лаков, косметических продуктов, медикаментов. Он является сырьем для получения бутадиена, уксусного альдегида, этилацетата и т.д. Используют этанол в пищевой промышленности.
