
- •2.2. Функциональные производные углеводородов. Галогенпроизводные углеводородов
- •Строение и номенклатура
- •Химические свойства
- •Особенности реакций ароматических галогенопроизводных с галогеном в ароматическом ядре
- •II. Реакции отщепления.
- •Физические свойства галогенопроизводных, их применение
- •Способы получения галогенопроизводных
- •Задания для выполнения кр № 2 по теме «функциональные производные углеводородов. Галогенопроизводные углеводородов» Галогенпроизводные углеводородов
- •2.3. Функциональные производные углеводородов. Кислородсодержащие производные углеводородов
- •2.3.1.Спирты
- •Химические свойства одноатомных спиртов
- •Способы получения одноатомных спиртов
- •Особенности многоатомных спиртов
- •Химические свойства
- •Физические и пожароопасные свойства многоатомных спиртов, их применение
- •Способы получения
- •Строение фенола
- •Химические свойства
- •Физические свойства и применение
- •Способы получения
- •Простые эфиры
- •Химические свойства
- •Физические и пожароопасные свойства простых эфиров
- •Способы получения простых эфиров
- •2.3.2. Альдегиды и кетоны
- •Номенклатура альдегидов и кетонов
- •Химические свойства
- •Физические и пожароопасные свойства альдегидов и кетонов, их применение
- •Способы получения альдегидов и кетонов
- •2.3.3. Карбоновые кислоты
- •Физические свойства.
- •Химические свойства
- •Особенности ненасыщенных карбоновых кислот.
- •Важнейшие представители карбоновых кислот и их производных.
Химические свойства
Кислотность фенолов.

Образование фенолятов.
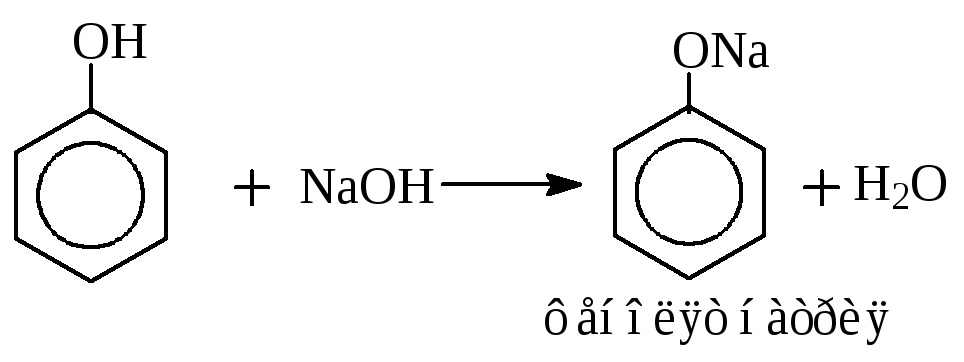
Феноляты легко гидролизуются.

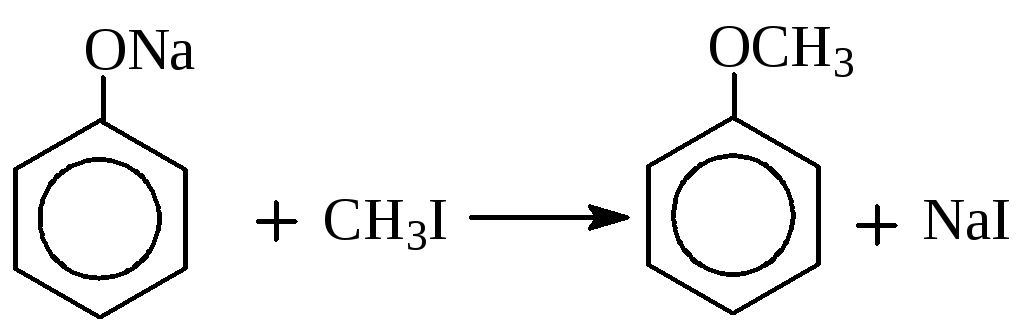
Алкилирование фенолов.
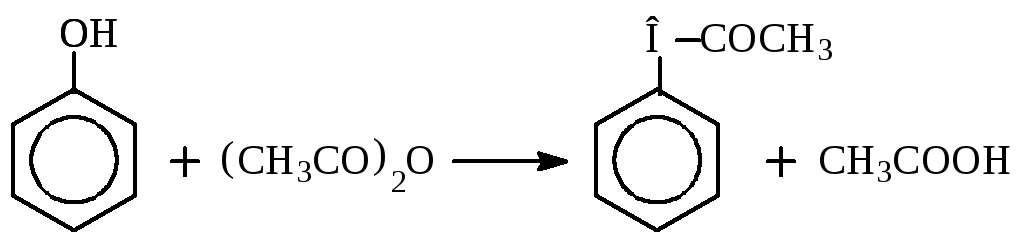
Ацилирование фенолов.
Ацилирующие агенты: ангидриды и хлорангидриды карбоновых кислот.
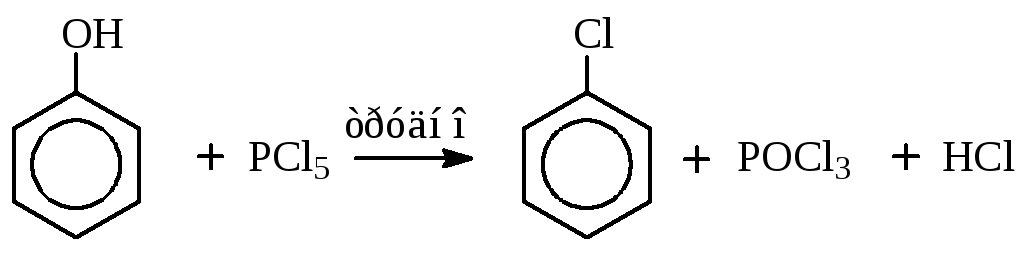
Нуклеофильное замещение гидроксильной группы на галоген.
Особенности реакций электрофильного замещения фенолов.
а) Галогенирование.
Реакции галогенирования проходят очень легко и не требуют катализатора. Особенно легко проходит бромирование в разбавленных водных растворах. Предполагается, что активно бромируется фенолят – ион.

б) Сульфирование.

Соотношение орто- и пара- изомеров при сульфировании определяется температурой реакции, орто - изомер при температурах выше 1000С перегруппировывается в пара – изомер.
в) Нитрование.
Фенол нитруют до мононитрофенола 20%-ной азотной кислотой, так как концентрированная азотная кислота окисляет фенол.
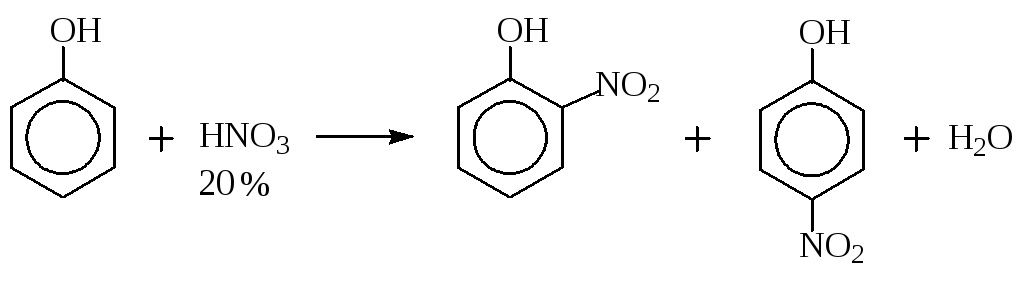
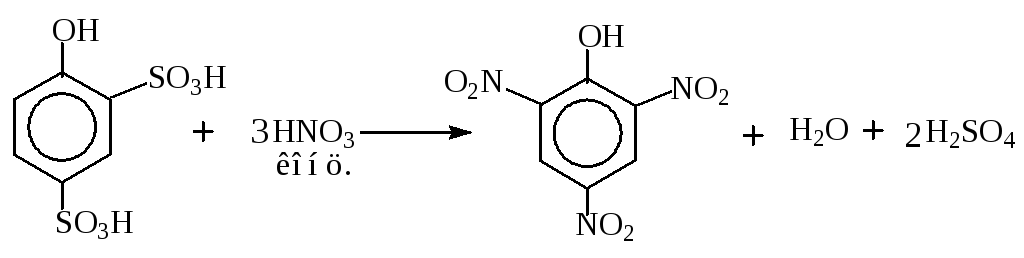
В результате введения нитро-группы, сильного электроноакцепторного заместителя, активность мононитрофенола к реакциям электрофильного замещения понижается, и вторую, и третью нитро-группы можно вводить действием концентрированной азотной кислоты.

Пикриновую кислоту можно также получить следующим способом.
Физические свойства и применение
Фенолы являются бесцветными жидкостями или кристаллическими веществами с очень своеобразным и сильным запахом. В холодной воде мало растворимы, но растворяются в спиртах и теплой воде. Фенолы ядовиты, на коже вызывают ожоги. Они обладают антисептическими свойствами.
Наибольшие количества фенола используются для получения фенолформальдегидных смол, которые применяются в производстве фенопластов. Большое количество фенола перерабатывается в циклогексанол, который необходим в производстве синтетического волокна.
Пикриновая кислота находит применение в качестве бризантного взрывчатого вещества, но вытесняется тротилом, так как ее кислотные свойства создают ряд неудобств – коррозия металла, образование солей, высокая чувствительность к удару. Находит применение как взрывчатое вещество и аммонийная соль пикриновой кислоты.
Способы получения
Фенол и его гомологи получают из продуктов коксования каменного угля.
Синтетические способы получения.
Сплавление солей ароматических сульфокислот со щелочью.

Кумольный способ.
Простые эфиры
Простые эфиры - это органические соединения, молекулы которых состоят из двух углеводородных радикалов, связанных атомом кислорода.
СН3 - О - СН3 диметиловый эфир
С2Н5 - О - С2Н5 диэтиловый эфир.
Химические свойства
Простые эфиры – малореакционноспособные вещества. Они устойчивы к действию воды, кислот, щелочей, не вступают в реакции со щелочными металлами.
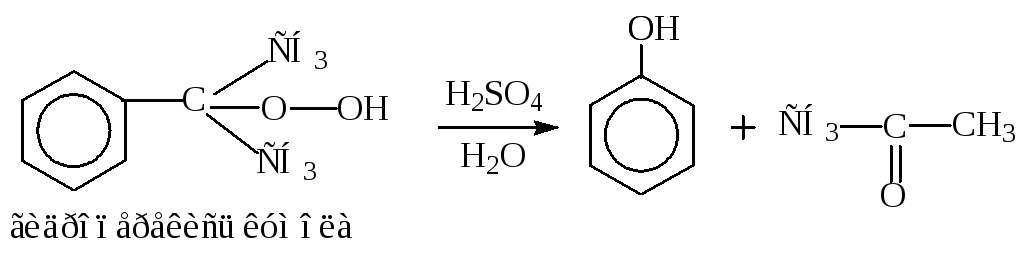
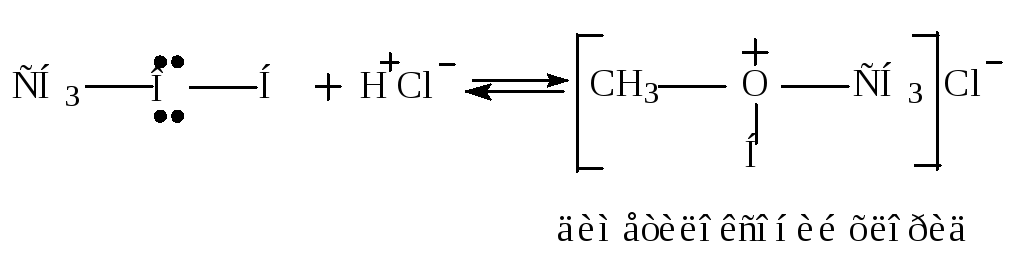
Образование солей оксония.
Пример:
Расщепление эфиров.
Пример:
С2Н5 - О - С2Н5 + НI С2Н5I + С2Н5ОН
Автоокисление
Пример:
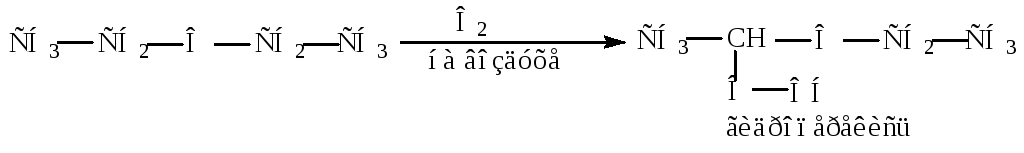
Перекиси - малолетучие соединения, с острым запахом, легко взрываются.
Их образование активизируется под действием света.
Физические и пожароопасные свойства простых эфиров
В качестве примера рассмотрим свойства наиболее используемого соединения – диэтилового эфира.
Диэтиловый эфир - бесцветная жидкость с температурой кипения 35.60С, плохо растворим в воде, легче воды (плотность 0.714), имеет специфический запах. Диэтиловый эфир склонен к электризации. Разряды статического электричества могут возникать в моменты переливания и служат причиной возгорания эфира. Устройство надежного заземления аппаратов и емкостей для эфира может исключать накопление статического электричества.
Пары эфира в 2,5 раза тяжелее воздуха и образуют с ним взрывчатые смеси. Концентрационные пределы воспламенения: НПВ -1,7%, ВПВ – 49,0%. Пары эфира могут распространяться на большие расстояния, сохраняя способность к горению. Основной мерой предосторожности при обращении с эфиром является удаление его от открытого огня.
Температура вспышки эфира – 450С, а температура самовоспламенения 1640С. При самовоспламенении пламя эфира быстро увеличивается. Эфир самовозгорается при контакте с сильными окислителями.
Диэтиловый эфир используют как растворитель органических веществ, для чистки тканей, как растворитель нитроклетчатки, для изготовления порохов, коллодия. Его также применяют для наркоза при хирургических операциях.
