
- •Оглавление
- •2. Химические свойства Металлов и Неметаллов
- •4. Коррозия Металлов, способы устранения коррозии
- •5. Кислота (классификация, слабые и сильные, номенклатура, химические свойства кислот, взаимодействие с неметаллами, получение, применение)
- •6. Химические свойства солей, получение, применение, классификация, номенклатура
- •1. Реакция нейтрализации
- •7. Химические свойства оксидов, определение, свойства, получение, номенклатура.
- •8. Химические свойства оснований, классификация, номенклатура, получение. Амфотерные гидроксиды и оксиды
- •10.Дисперсные системы. Строение мицелл. Воздействие на систему.
- •11. Скорость химической реакции. Факторы, влияющие на скорость.
- •12. Химическое равновесие. Принцип Ле-Шателье, обратимые, необратимые реакции
- •13. Окислительно-восстановительные реакции. Основные окислители и восстановители
- •14. Электролиз
- •15. Алканы, алкены, алкины. Химические свойства, применение.
- •16. Реакции полимеризации и поликонденсации
- •17. Химическая связь. Типы химической связи
- •18. Гидролиз и электрическая диссоциация
- •19. Способы выражения концентрации раствора. Растворы
- •20. Строение атомов: Модель Томсана, Теория Резерфорда, ядерная модель Резерфорда.
- •21. Правила заполнения электрических уровней: правило Хунда, Клечковского, принцип Паули.
- •22. Современное представление о строение атома: принцип неопределенности Гейзенберга, двойственная природа электрона.
- •Природный газ - сн4 (Метан)
- •Типы классификаций реакции.
- •По тепловому эффекту.
- •По присутствию других веществ.
14. Электролиз
Электролиз - это окислительно-восстановительный процесс, который происходит на электродах во время прохождения электрического тока через расплав или раствор.
Различают электролиз растворов и электролиз расплавов. Оба эти процесса существенно отличаются друг от друга. Отличие - в наличии растворителя. При электролизе растворов кроме ионов самого вещества в процессе участвуют ионы растворителя. При электролизе расплавов - только ионы самого вещества.
На катоде: передача электронов катионам из раствора или расплава, поэтому катод является восстановителем.
На аноде: отдача электронов анионами, поэтому анод – окислитель.
На катодах и анодах могут протекать конкурирующие реакции. При проведении электролиза с использованием инертного анода конкурирующими процессами является 2 окислительных и 2 восстановительных процесса:
На аноде – окисление анионов и гидроксид-ионов.
На катоде – восстановление катионов и ионов водорода.
Если ее используют активный анод, то процесс более сложен:
На аноде: окисление анионов и гидроксид-ионов, анодное растворение металла – материала анода.
На катоде: восстановление катиона соли и ионов водорода, восстановление металла катионами, полученными при растворении анода.
При электролизе расплавов в процессе участвуют только ионы вещества, которое подвергается электролизу. Например, если подвергнуть электролизу расплав поваренной соли (NaCl), то на аноде будет выделяться тот же газ - хлор, а вот на катоде вместо водорода будет восстанавливаться чистый металл - натрий (Na). Именно таком способом в промышленности получают металлический натрий и другие щелочные и щелочноземельныеметаллы. Таким же образом получают другие щелочные металлы (калий (K), литий (Li), кальций (Ca)), проводя ток через расплавы их солей.
Способы электризации тел:
Электризация тел при соприкосновении. В этом случае при тесном контакте небольшая часть электронов переходит с одного вещества, у которого связь с электроном относительно слаба, на другое вещество.
Электризация тел при трении. При этом увеличивается площадь соприкосновения тел, что приводит к усилению электризации.
Влияние. В основе влияния лежит явление электростатической индукции, то есть наведение электрического заряда в веществе, помещённом в постоянное электрическое поле.
Электризация тел под действием света. В основе этого лежит фотоэлектрический эффект, или фотоэффект, когда под действием света из проводника могут вылетать электроны в окружающее пространство, в результате чего проводник заряжается.
15. Алканы, алкены, алкины. Химические свойства, применение.
Алканы – насыщенные (предельные) углеводороды. Представителем этого класса является метан (СН4). Все последующие предельные углеводороды отличаются на СН2 – группу, которая называется гомологической группой, а соединения – гомологами.
Общая формула – СnH2n+2.
Из синтетических методов получения алканов можно выделить следующие:
1. Получение из ненасыщенных углеводородов. Взаимодействие алкенов или алкинов с водородом ("гидрирование") происходит в присутствии металлических катализаторов (Ni, Pd) при нагревании:
|
|
tº. Ni |
|
|
СН3-СН=СН2 + Н2 |
→ |
СН3-СН2-СН3, |
СНз—C≡СН + 2Н2 → СН3-СН2-СН3.
2. Получение из галогенпротводных. При нагревании моногалогензамещенных алканов с металлическим натрием получают алканы с удвоенным числом атомов углерода (реакция Вюрца):
С2Н5Br + 2Na + Br—C2H5 → C2H5—C2H5 + 2NaBr.
Подобную реакцию не проводят с двумя разными галогензамещенными алканами, поскольку при этом получается смесь трех различных алканов
3. Получение из солей карбоновых кислот. При сплавлении безводных солей карбоновых кислотс щелочами получаются алканы, содержащие на один атом углерода меньше по сравнению с углеродной цепью исходных карбоновых кислот:
t°
CH3COONa + NaOH
→
СН4↑ + Na2CO3.
4.Получение метана. В электрической дуге, горящей в атмосфере водорода, образуется значительное количество метана:
С + 2Н2 → СН4.
Такая же реакция идет при нагревании углерода в атмосфере водорода до 400-500 °С при повышенном давлении в присутствии катализатора.
В лабораторных условиях метан часто получают из карбида алюминия:
Аl4С3 + 12Н2О = ЗСН4↑ + 4Аl(ОН)3.
Химические свойства. В обычных условиях алканы химически инертны. Они устойчивы к действию многих реагентов: не взаимодействуют с концентрированными серной и азотной кислотами, с концентрированными и расплавленными щелочами, не окисляются сильными окислителями — перманганатом калия KMnО4 и т.п.
Алкины – углеводороды, молекулы которых содержат тройную связь углерод-углерод. Общая формула алкинов – CnH2n-2.
Номенклатура алкинов
Тройную связь обозначают суффиксом -ин.
![]() ацетилен
(этин)
ацетилен
(этин)
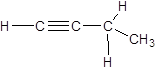 бутин-1
бутин-1
Главная цепь должна включать в себя тройные связи, а нумерация проводится так, чтобы они получили наименьшие номера.
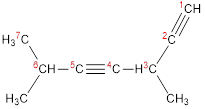 3,6-диметилгептадиин-1,4
3,6-диметилгептадиин-1,4
Получение.
1. Общий способ получения алкинов — отщепление двух молекул галогеноводорода от дигалогеналканов, которые содержат два атома галогена либо у соседних, либо у одного атома углерода, под действием спиртового раствора щелочи.
|
|
С2Н5ОН |
|
|
СН2Вr — СН2Вr + 2КОН |
→ |
НС ≡ СН + 2КВr + 2Н2О, |
|
|
С2Н5ОН |
|
|
|
СН3 — СВr2 — СН3 + 2КОН |
→ |
СН3-С ≡ СН + 2КВr + 2Н2О, |
|
2. Гомологи ацетилена можно также получать, действуя галогеналканами на соли ацетиленовых углеводородов (ацетилениды):
CH3 — C ≡ CNa + I-R → CHg — C ≡ C-R + NaI.
Эта реакция представляет собой пример нуклеофильного замещения, а нуклеофилом в ней является ацетиленидный карбанион
![]()
3. Ацетилен получают в промышленности путем высокотемпературного крекинга метана:
|
|
1500°С |
|
|
2СН4 |
→ |
CH ≡ NCH + ЗН2 |
или его ближайших гомологов — этана и пропана, причем в этом случае ацетилен образуется при более низких температурах:
|
|
1200°С |
|
|
1200°С |
|
|
C2Hg |
→ |
C2Hg + 2Н2, |
2С3Н8 |
→ |
ЗС2Н2 + 5Н2 |
Сырьем в этих способах служит природный газ или нефть.
В лабораторных условиях ацетилен получают гидролизом карбида кальция:
СаС2 + 2Н2О = Са(ОН)2 + С2Н2 ↑
Химические свойства алкинов обусловлены наличием в их молекулах тройной связи. Типичными реакциями для ацетилена и его гомологов являются реакции электрофильного присоединения АE. Отличие алкинов от алкенов заключается в том, что реакции присоединения могут протекать в две стадии. На первой стадии идет присоединение к тройной связи с образованием двойной связи, а на второй стадии — присоединение к двойной связи. Реакции присоединения для алкинов протекают медленнее, чем для алкенов. Это объясняется тем, что p-электронная плотность тройной связи расположена более компактно, чем в алкенах, и поэтому менее доступна для взаимодействия с различными реагентами.
Алкены – углеводороды, которые содержат в молекуле одну двойную связь. Общая формула – CnH2n.
Первый член ряда – этилен (этен) C2H4:
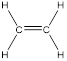
Номенклатура алкенов
Двойную связь обозначают с помощью суффикса -ен. Основная цепь должна включать кратную связь. Нумерация цепи проводится с того конца, к которому ближе двойная связь.
CH3-CH2-CH2-CH=CH-CH3
гексен-2 (гексен-4)
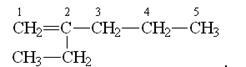
2-этилпентен-1
Получение.
1. Основным промышленным источником алкенов служит крекинг алканов, входящих в состав нефти:
|
С8Н18 |
→ |
С4Н10 + С4Н8 |
Крекинг протекает по свободнорадикальному механизму при высоких температурах (400-700 °С).
2. Другой промышленный способ получения алкенов — дегидрирование алканов:
t, Cr2O3
СН3-СН2-СН3
→
СН3-СН=СН2 + Н2
3. В лабораторных условиях алкены получают по реакциям отщепления (элиминирования), при которых от соседних атомов углерода отщепляются два атома или две группы атомов, и образуется дополнительная p-связь. К таким реакциям относятся следующие.
1)Дегидратация спиртов происходит при их нагревании с водоотнимающими средствами, например с серной кислотой при температуре выше 150 °С:
|
|
H2SO4 |
|
|
СН3-СН2-ОН |
→ |
СН2=СН2 + Н2О |
2) Отщепление галогеноводородов проводят при действии спиртовых растворов щелочей на моноалкилгалогениды:
|
|
С2Н6ОН |
|
|
СН3-СН2-СНВr-СН3 + КОН |
→ |
СН3-СН=СН-СН3 + КВr + Н2О |
При отщеплении Н2O от спиртов, НВr и HCl от алкилгалогенидов атом водорода преимущественно отщепляется от того из соседних атомов углерода, который связан с наименьшим числом атомов водорода (от наименее гидрогенизированного атома углерода). Эта закономерность носит название правила Зайцева.
3) Дегалогенирование происходит при нагревании дигалогенидов, имеющих атомы галогена у соседних атомов углерода, с активными металлами:
CH2Br—CHBr—CH3 + Mg → СН2=СН-СН3 + MgВr2.
Химические свойства алкенов определяются наличием в их молекулах двойной связи. Электронная плотность p-связи достаточно подвижна и легко вступает в реакции с электрофильными частицами. Поэтому многие реакции алкенов протекают по механизмуэлектрофильного присоединения, обозначаемому символом AE(от англ, addition electrophilic).
