- •Оглавление
- •2. Химические свойства Металлов и Неметаллов
- •4. Коррозия Металлов, способы устранения коррозии
- •5. Кислота (классификация, слабые и сильные, номенклатура, химические свойства кислот, взаимодействие с неметаллами, получение, применение)
- •6. Химические свойства солей, получение, применение, классификация, номенклатура
- •1. Реакция нейтрализации
- •7. Химические свойства оксидов, определение, свойства, получение, номенклатура.
- •8. Химические свойства оснований, классификация, номенклатура, получение. Амфотерные гидроксиды и оксиды
- •10.Дисперсные системы. Строение мицелл. Воздействие на систему.
- •11. Скорость химической реакции. Факторы, влияющие на скорость.
- •12. Химическое равновесие. Принцип Ле-Шателье, обратимые, необратимые реакции
- •13. Окислительно-восстановительные реакции. Основные окислители и восстановители
- •14. Электролиз
- •15. Алканы, алкены, алкины. Химические свойства, применение.
- •16. Реакции полимеризации и поликонденсации
- •17. Химическая связь. Типы химической связи
- •18. Гидролиз и электрическая диссоциация
- •19. Способы выражения концентрации раствора. Растворы
- •20. Строение атомов: Модель Томсана, Теория Резерфорда, ядерная модель Резерфорда.
- •21. Правила заполнения электрических уровней: правило Хунда, Клечковского, принцип Паули.
- •22. Современное представление о строение атома: принцип неопределенности Гейзенберга, двойственная природа электрона.
- •Природный газ - сн4 (Метан)
- •Типы классификаций реакции.
- •По тепловому эффекту.
- •По присутствию других веществ.
По тепловому эффекту.
|
Экзотермические реакции (теплота выделяется) |
Эндотермические реакции (теплота поглощается) |
|
4Al+3O2=2Al2O3+Q |
N2+O2 |
По присутствию других веществ.
|
Каталитические ( протекают в присутствии катализаторов-веществ, ускоряющих реакцию) |
Некаталитические |
|
SO2+O2 |
2NO+O2=2NO2 |
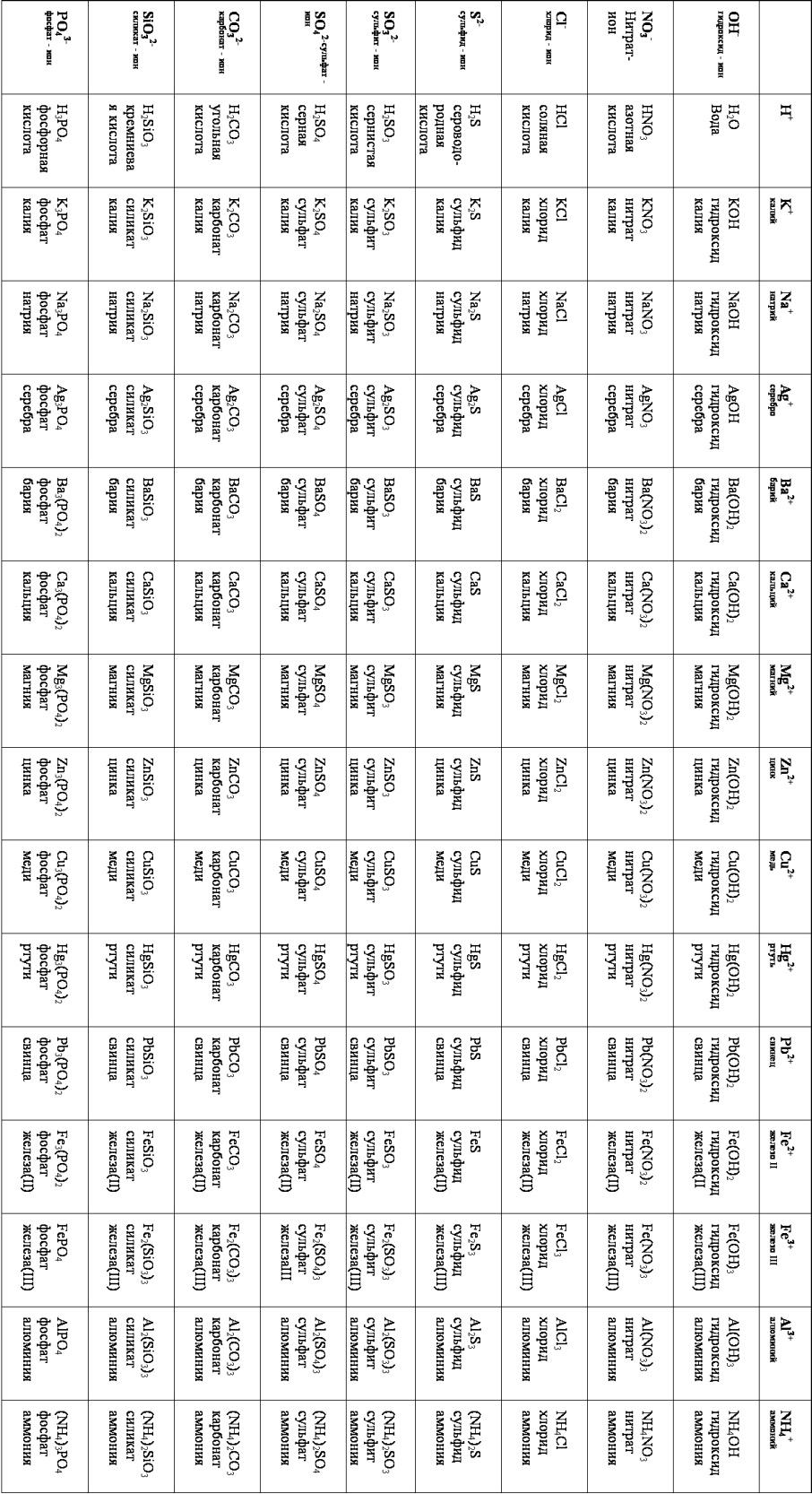
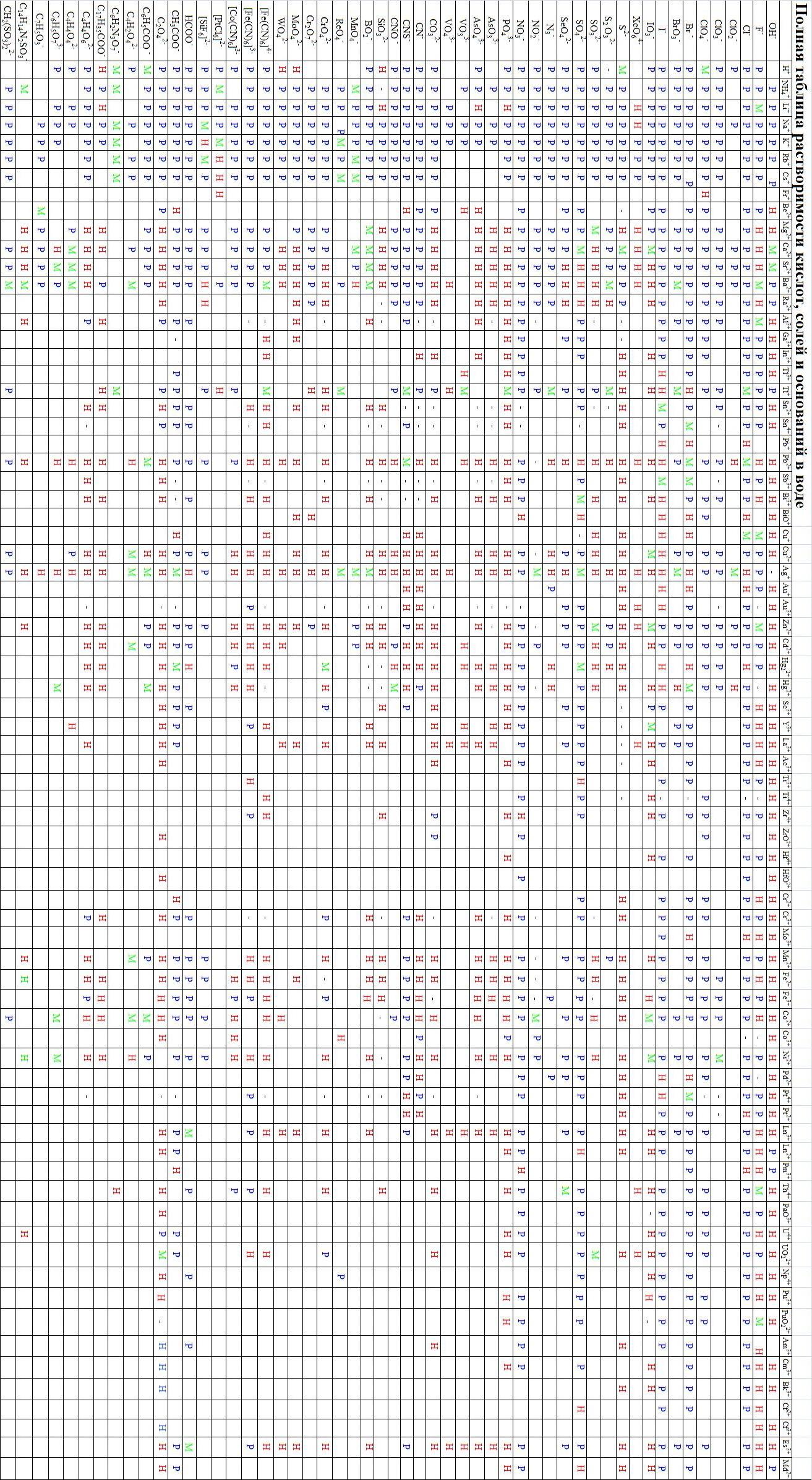
Химические реакции кислот. 1). Кислота + Основание = Соль + Вода. 2). Кислота + Оксид металла = Соль + Вода. 3). Кислота + Металл (в ряду активности до H₂) = Соль + H₂↑. 4). Кислота + Соль = Новая кислота + Новая соль↓ (реакция идёт, если образуется осадок). 5). Кислота + Основный оксид = Соль + Вода. Кислота не взаимодействует с кислотным оксидом! Химические реакции оснований. 1). Основание + Оксид неметалла (это кислотный оксид) = Соль + Вода. 2). Основание + Соль = Новое основание + Новая соль↓ (реакция идёт, если образуется осадок). 3). Основание + Неметалл + Вода = Соль + H₂↑. Основание не взаимодействует с оксидом металла! Соли. Соли - это сложные вещества, состоящие из ионов металлов и кислотных остатков. Примеры: NaNO₃ - нитрат натрия. Na⁺ + NO₃⁻ (катион металла) + (анион кислотного остатка) ; Ca₃(PO₄)₂ - фосфат кальция. 3Ca²⁺ + 2PO₄³⁻ (катион металла) + (анион кислотного остатка) ; MgSO₄ - сульфат магния. Mg²⁺ + SO₄²⁻ (катион металла) + (анион кислотного остатка) .