
- •Оглавление
- •2. Химические свойства Металлов и Неметаллов
- •4. Коррозия Металлов, способы устранения коррозии
- •5. Кислота (классификация, слабые и сильные, номенклатура, химические свойства кислот, взаимодействие с неметаллами, получение, применение)
- •6. Химические свойства солей, получение, применение, классификация, номенклатура
- •1. Реакция нейтрализации
- •7. Химические свойства оксидов, определение, свойства, получение, номенклатура.
- •8. Химические свойства оснований, классификация, номенклатура, получение. Амфотерные гидроксиды и оксиды
- •10.Дисперсные системы. Строение мицелл. Воздействие на систему.
- •11. Скорость химической реакции. Факторы, влияющие на скорость.
- •12. Химическое равновесие. Принцип Ле-Шателье, обратимые, необратимые реакции
- •13. Окислительно-восстановительные реакции. Основные окислители и восстановители
- •14. Электролиз
- •15. Алканы, алкены, алкины. Химические свойства, применение.
- •16. Реакции полимеризации и поликонденсации
- •17. Химическая связь. Типы химической связи
- •18. Гидролиз и электрическая диссоциация
- •19. Способы выражения концентрации раствора. Растворы
- •20. Строение атомов: Модель Томсана, Теория Резерфорда, ядерная модель Резерфорда.
- •21. Правила заполнения электрических уровней: правило Хунда, Клечковского, принцип Паули.
- •22. Современное представление о строение атома: принцип неопределенности Гейзенберга, двойственная природа электрона.
- •Природный газ - сн4 (Метан)
- •Типы классификаций реакции.
- •По тепловому эффекту.
- •По присутствию других веществ.
11. Скорость химической реакции. Факторы, влияющие на скорость.
Скорость химической реакции – число элементарных актов химического взаимодействия, протекающих в единицу времени в единицу объема (гомогенные) или на единице поверхности (гетерогенные).
Истинная скорость реакции:
![]() Факторы,
влияющие на скорость химической реакции
Факторы,
влияющие на скорость химической реакции
Для гомогенных, гетерогенных (протекающих в пределах одной фазы, например, в смеси газов или в растворе) реакций:
1) концентрация реагирующих веществ;
2) температура;
3) катализатор - химическое вещество, ускоряющее реакцию, но не входящее в состав продуктов реакции.
4) ингибитор - общее название веществ, подавляющих или задерживающих течение физиологических и физико-химических (главным образом ферментативных) процессов.
Только для гетерогенных (протекающих на границе раздела фаз, например, твердой и жидкой, твердой и газообразной):
1) скорость подвода реагирующих веществ к поверхности раздела фаз;
2) площадь поверхности.
Главный фактор – природа реагирующих веществ – характер связи между атомами в молекулах реагентов.
Пример:
NO2 – оксид азота (IV) – лисий хвост, СО – угарный газ, монооксид углерода.
Если их окислить кислородом, то в первом случае реакция пойдет мгновенно, стоит приоткрыть пробку сосуда, во втором случае реакция растянута во времени.
12. Химическое равновесие. Принцип Ле-Шателье, обратимые, необратимые реакции
Химическое равновесие — состояние химической системы, в которой протекает одна или несколько химических реакций, причём скорости в каждой паре прямой-обратной реакции равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем.
Например, при нагревании происходят следующие превращения:
INCLUDEPICTURE
"http://www.hemi.nsu.ru/im217_01.gif" \* MERGEFORMATINET
INCLUDEPICTURE "http://www.hemi.nsu.ru/im217_01.gif" \*
MERGEFORMATINET INCLUDEPICTURE
"http://www.hemi.nsu.ru/im217_01.gif" \* MERGEFORMATINET
INCLUDEPICTURE "http://www.hemi.nsu.ru/im217_01.gif" \*
MERGEFORMATINET INCLUDEPICTURE
"http://www.hemi.nsu.ru/im217_01.gif" \* MERGEFORMATINET
INCLUDEPICTURE "http://www.hemi.nsu.ru/im217_01.gif" \*
MERGEFORMATINET INCLUDEPICTURE
"http://www.hemi.nsu.ru/im217_01.gif" \* MERGEFORMATINET
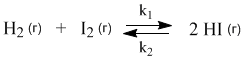
Принцип Ле Шателье — если на систему, находящуюся в равновесии, воздействовать извне, изменяя какое-нибудь из условий (температура, давление, концентрация), то равновесие смещается таким образом, чтобы компенсировать изменение.
Реакции, которые протекают только в одном направлении и завершаются полным превращением исходных реагирующих веществ в конечные вещества, называются необратимыми.
Примером такой реакции может служить разложение хлората калия (бертолетовой соли) при нагревании:
2KClO 3 = 2KCl + 3O 2 ↑
Обратимыми называются такие реакции, которые одновременно протекают в двух взаимно противоположных направлениях.
3H2 + N2 ⇌ 2NH3
13. Окислительно-восстановительные реакции. Основные окислители и восстановители
Окисли́тельно-восстанови́тельные реа́кции — это встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ (или ионов веществ), реализующимся путём перераспределения электронов между атомом-окислителем (акцептором) и атомом-восстановителем (донором).
![]()
![]()
Важнейшие восстановители и окислители
|
Восстановители |
Окислители |
|
Металлы, водород, уголь. Окись углерода (II) (CO). Сероводород (H2S); оксид серы (IV) (SO2); сернистая кислота H2SO3 и ее соли. Галогеноводородные кислоты и их соли. Катионы металлов в низших степенях окисления:SnCl2, FeCl2, MnSO4, Cr2(SO4)3. Азотистая кислота HNO2; аммиак NH3; гидразин NH2NH2; оксид азота(II) (NO). Катод при электролизе. |
Галогены. Перманганат калия(KMnO4); манганат калия (K2MnO4); оксид марганца (IV) (MnO2). Дихромат калия (K2Cr2O7); хромат калия (K2CrO4). Азотная кислота (HNO3). Серная кислота (H2SO4) конц. Оксид меди(II) (CuO); оксид свинца(IV) (PbO2); оксид серебра (Ag2O); пероксид водорода (H2O2). Хлорид железа(III) (FeCl3). Бертоллетова соль (KClO3). Анод при электролизе. |
В окислительно-восстановительных реакциях электроны от одних атомов, молекул или ионов переходят к другим. Процесс отдачи электронов - окисление.
При окислении степень окисления повышается:
H20 - 2ē = 2H+
S-2 - 2ē = S0
Al0 - 3ē = Al+3
Fe+2 - ē = Fe+3
2Br - - 2ē = Br20
Процесс присоединения электронов - восстановление: При восстановлении степень окисления понижается.
Mn+4 + 2ē = Mn+2
S0 + 2ē = S-2
Cr+6 +3ē = Cr+3
Cl20 +2ē = 2Cl-
O20 + 4ē = 2O-2
Атомы или ионы, которые в данной реакции присоединяют электроны являются окислителями, а которые отдают электроны - восстановителями.
NaOH + HCl = NaCl + H2O
СН4 + 2О2 = СО2 + 2Н2О
Существует два типа химических реакций:
A) Реакции, в которых не изменяется степень окисления элементов:
Реакции присоединения
SO2 + Na2O = Na2SO3
Реакции разложения
Cu(OH)2 = CuO + H2O
Реакции обмена
KCl + AgNO3 = AgCl + KNO3
NaOH + HNO3 → NaNO3 + H2O
B) Реакции, в которых происходит изменение степеней окисления атомов элементов, входящих в состав реагирующих соединений:
2Mg0 + O20 = 2Mg+2O-2
2KCl+5O3-2 = 2KCl-1 + 3O20
2KI-1 + Cl20 = 2KCl-1 + I20
Mn+4O2 + 4HCl-1 = Mn+2Cl2 + Cl20 + 2H2O
Такие реакции называются окислительно - восстановительными.
