
- •Оглавление
- •2. Химические свойства Металлов и Неметаллов
- •4. Коррозия Металлов, способы устранения коррозии
- •5. Кислота (классификация, слабые и сильные, номенклатура, химические свойства кислот, взаимодействие с неметаллами, получение, применение)
- •6. Химические свойства солей, получение, применение, классификация, номенклатура
- •1. Реакция нейтрализации
- •7. Химические свойства оксидов, определение, свойства, получение, номенклатура.
- •8. Химические свойства оснований, классификация, номенклатура, получение. Амфотерные гидроксиды и оксиды
- •10.Дисперсные системы. Строение мицелл. Воздействие на систему.
- •11. Скорость химической реакции. Факторы, влияющие на скорость.
- •12. Химическое равновесие. Принцип Ле-Шателье, обратимые, необратимые реакции
- •13. Окислительно-восстановительные реакции. Основные окислители и восстановители
- •14. Электролиз
- •15. Алканы, алкены, алкины. Химические свойства, применение.
- •16. Реакции полимеризации и поликонденсации
- •17. Химическая связь. Типы химической связи
- •18. Гидролиз и электрическая диссоциация
- •19. Способы выражения концентрации раствора. Растворы
- •20. Строение атомов: Модель Томсана, Теория Резерфорда, ядерная модель Резерфорда.
- •21. Правила заполнения электрических уровней: правило Хунда, Клечковского, принцип Паули.
- •22. Современное представление о строение атома: принцип неопределенности Гейзенберга, двойственная природа электрона.
- •Природный газ - сн4 (Метан)
- •Типы классификаций реакции.
- •По тепловому эффекту.
- •По присутствию других веществ.
10.Дисперсные системы. Строение мицелл. Воздействие на систему.
Дисперсной системой называется гетерогенная система, в которой мелкие частицы одной фазы равномерно распределены в объеме другой фазы.
Молекулярно-дисперсные системы. Указанные системы содержат частицы, размер которых не превышает одного нм. К данной группе относятся разнообразные истинные растворы неэлектролитов: глюкозы, мочевины, спирта, сахарозы.
Грубодисперсные системы характеризируются наиболее крупными частицами. К ним относят эмульсии и суспензии. Дисперсные системы, у которых твердое вещество локализируется в жидкой дисперсионной среде (раствор крахмала, глины), называются суспензиями. Эмульсии – это системы, которые получают в результате смешивания двух жидкостей, где одна в виде капелек диспергирована в другой (масло, толуол, бензол в воде или капельки триацилглицеролов (жира) в молоке.
Коллоидные дисперсные системы. В них размеры коллоидных частиц достигают до 100 нм. Такие частицы легко проникают через поры бумажных фильтров, однако не проникают через поры биологических мембран растений и животных. Поскольку коллоидные частицы (мицеллы) имеют электрозаряд и сольватные ионные оболочки, благодаря которым они остаются во взвешенном состоянии, они достаточно продолжительное время могут не выпадать в осадок. Ярким примером коллоидной системы являются растворы желатина, альбумина, гуммиарабика, коллоидные растворы золота и серебра.
Степень дисперсности позволяет различить гомогенные и гетерогенные дисперсные системы. В гомогенных дисперсных системах частицы фазы измельчены до молекул, атомов и ионов. Примером таких дисперсионных систем может быть раствор глюкозы в воде (молекулярно-дисперсная система) и кухонной соли в воде (ионно-дисперсная система). Они являются истинными растворами. Размер молекул дисперсной фазы не превышает одного нанометра.
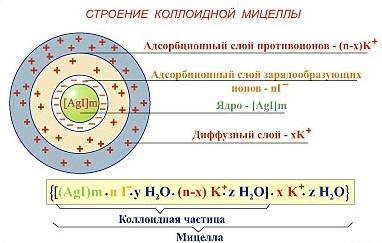
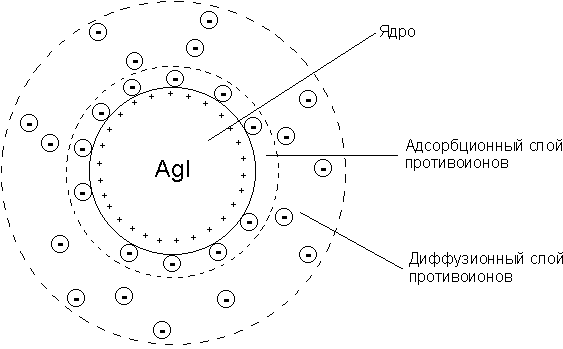
Мицеллой лиофобной системы называется гетерогенная микросистема, которая состоит из микрокристалла дисперсной фазы, окруженного сольватированными ионами стабилизатора.
Мицеллы — частицы в коллоидных системах, состоящие из нерастворимого в данной среде ядра очень малого размера, окружённого стабилизирующей оболочкой адсорбированных ионов и молекул растворителя.
Рассмотрим строение коллоидной мицеллы на примере гидрозоля иодида серебра, получаемого взаимодействием разбавленных растворов нитрата серебра и иодида калия:
AgNO3 + KI ––> AgI + KNO3
Коллоидная мицелла золя иодида серебра образована микрокристаллом иодида серебра, который способен к избирательной адсорбции из окружающей среды катионов Ag+ или иодид-ионов. Если реакция проводится в избытке иодида калия, то кристалл будет адсорбировать иодид-ионы; при избытке нитрата серебра микрокристалл адсорбирует ионы Ag+. В результате этого микрокристалл приобретает отрицательный либо положительный заряд; ионы, сообщающие ему этот заряд, называются потенциалопределяющими, а сам заряженный кристалл – ядром мицеллы. Заряженное ядро притягивает из раствора ионы с противоположным зарядом – противоионы; на поверхности раздела фаз образуется двойной электрический слой. Некоторая часть противоионов адсорбируется на поверхности ядра, образуя т.н. адсорбционный слой противоионов; ядро вместе с адсорбированными на нем противоионами называют коллоидной частицей или гранулой. Остальные противоионы, число которых определяется, исходя из правила электронейтральности мицеллы, составляют диффузный слой противоионов; противоионы адсорбционного и диффузного слоев находятся в состоянии динамического равновесия адсорбции – десорбции.
Схематически мицелла золя иодида серебра, полученного в избытке иодида калия (потенциалопределяющие ионы – анионы I–, противоионы – ионы К+) может быть изображена следующим образом:
{[AgI]m · nI– · (n-x)K+}x– · x K+
При получении золя иодида серебра в избытке нитрата серебра коллоидные частицы будут иметь положительный заряд:
{[AgI]m · nAg+ · (n-x)NO3–}x+ · x NO3–
Если на систему, находящуюся в состоянии химического равновесия, оказывать внешнее воздействие (изменять температуру, давление, концентрации веществ), то положение равновесия смещается в такую сторону, чтобы ослабить внешнее воздействие.
Влияние концентрации на смещение химического равновесия
![]()
реакция образования аммиака — протекает в газовой среде
![]()
реакция образования сложного эфира — реакция, проходящая в жидкой среде.
Увеличение концентрации реагентов смещает химическое равновесие в сторону продуктов реакции как в газовой, так и в жидкой среде.
Удаление продуктов из среды реакции так же смещает равновесие в сторону продуктов реакции.
Увеличение концентрации продуктов смещает химическое равновесие в сторону обратной реакции.
Влияние температуры на смещение химического равновесия
Все химические реакции делятся на два типа:
1. Эндотермические реакции — реакции, протекающие с поглощением теплоты.
![]() 2.
Экзотермические
реакции —
протекают с выделением теплоты.
2.
Экзотермические
реакции —
протекают с выделением теплоты.
![]() Соответственно,
с помощью температурного воздействия
мы можем оказывать влияние на смещение
химического равновесия в системе:
в
эндотермической реакции:
Соответственно,
с помощью температурного воздействия
мы можем оказывать влияние на смещение
химического равновесия в системе:
в
эндотермической реакции:
увеличение температуры смещает равновесие в сторону продуктов (прямой реакции);
уменьшение температуры смещает равновесие в сторону реагентов (обратной реакции);
в экзотермической реакции:
увеличение температуры смещает равновесие в сторону реагентов (обратной реакции);
уменьшение температуры смещает равновесие в сторону продуктов (прямой реакции);
Влияние давления на смещение химического равновесия
Этот вопрос относится только к реакциям в газовой среде.
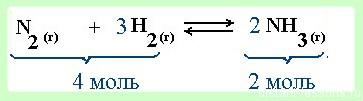
При увеличении давления равновесие смещается в сторону меньшего объема (в данном примере 4 моль → 2 моль, т.е. равновесие сместится в сторону продукта реакции -образования аммиака).
При уменьшении давления — в сторону большего объема (в сторону обратной реакции)
Если в реакции участвуют твердые вещества, например: 2C (тв) + O2 (г) ↔ 2CO (г), то их количество не учитывается.
