
- •Оглавление
- •2. Химические свойства Металлов и Неметаллов
- •4. Коррозия Металлов, способы устранения коррозии
- •5. Кислота (классификация, слабые и сильные, номенклатура, химические свойства кислот, взаимодействие с неметаллами, получение, применение)
- •6. Химические свойства солей, получение, применение, классификация, номенклатура
- •1. Реакция нейтрализации
- •7. Химические свойства оксидов, определение, свойства, получение, номенклатура.
- •8. Химические свойства оснований, классификация, номенклатура, получение. Амфотерные гидроксиды и оксиды
- •10.Дисперсные системы. Строение мицелл. Воздействие на систему.
- •11. Скорость химической реакции. Факторы, влияющие на скорость.
- •12. Химическое равновесие. Принцип Ле-Шателье, обратимые, необратимые реакции
- •13. Окислительно-восстановительные реакции. Основные окислители и восстановители
- •14. Электролиз
- •15. Алканы, алкены, алкины. Химические свойства, применение.
- •16. Реакции полимеризации и поликонденсации
- •17. Химическая связь. Типы химической связи
- •18. Гидролиз и электрическая диссоциация
- •19. Способы выражения концентрации раствора. Растворы
- •20. Строение атомов: Модель Томсана, Теория Резерфорда, ядерная модель Резерфорда.
- •21. Правила заполнения электрических уровней: правило Хунда, Клечковского, принцип Паули.
- •22. Современное представление о строение атома: принцип неопределенности Гейзенберга, двойственная природа электрона.
- •Природный газ - сн4 (Метан)
- •Типы классификаций реакции.
- •По тепловому эффекту.
- •По присутствию других веществ.
4. Коррозия Металлов, способы устранения коррозии
Коррозия – разрушение металлов и их сплавов в результате воздействия на них окружающей среды
4Fe + 3O2 = 2Fe2O3
Fe + H2SO4 = FeSO4 + H2
Химическая коррозия Разрушение металла окислением его в окружающей среде при контакте с газами или жидкостями не электролитами.
Электролиты — это вещества, растворы или расплавы которых проводят электрический ток. К электролитам относятся кислоты, основания и соли.
Электрохимическая коррозия Разрушение металла в среде электролита с возникновением внутри системы электрического тока
Способы борьбы с коррозией:
Применение защитных покрытий - покрытие другими металлами (никелирование, хромирование, кадмирование и т.д.) покрытие лаками, красками, эмалями
Приготовление сплавов, стойких к коррозии (нержавеющей стали)
Изменение состава среды путем применения ингибиторов - веществ, замедляющих или предотвращающих течение какой-либо химической реакции
Анодное покрытие – Покрывают более активным металлом
Катодное покрытие – Покрывают менее активным металлом
5. Кислота (классификация, слабые и сильные, номенклатура, химические свойства кислот, взаимодействие с неметаллами, получение, применение)
Кислоты – электролиты, диссоциирующие с образованием катионов водорода и анионов кислотного остатка Общая формула кислот H Ac, где n – число атомов водорода, равное заряду иона кислотного остатка, Ac – кислотный остаток.
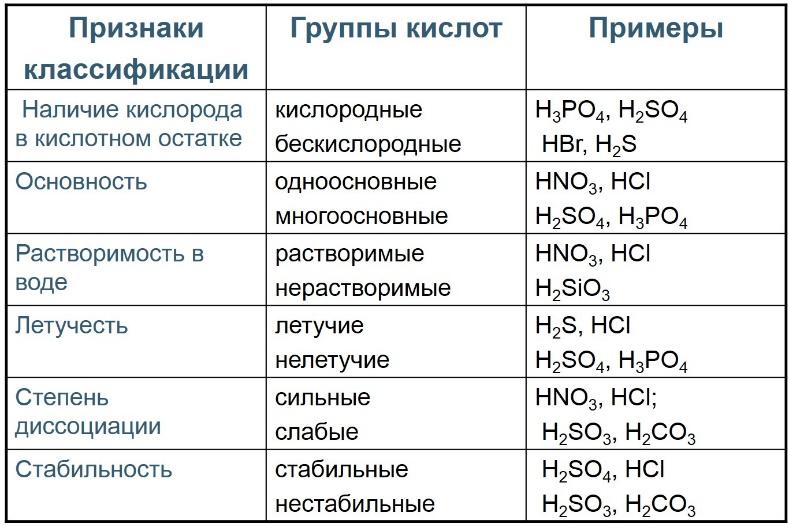
Номенклатура кислот
Названия бескислородных кислот образуются от названия элемента с суффиксом -о и прибавлением слов «водородная кислота»: HF – фтороводородная; HCl – хлороводородная, H2SH2S – сероводородная.
Названия кислородосодержащих кислот строятся следующим образом: название элемента+суффикс(ная, овая, истая и пр.) кислота.
Суффикс -ная, -вая характерен для кислот, содержащих элемент в высшей степени окисления. По мере понижения степени окисления суффиксы меняются в следующем порядке: -оватая, -истая, -оватистая.
Например, H2S+6O4H2S+6O4 — серная кислота, но H2S+4O3H2S+4O3 сернистая кислота
HCl+7O4HCl+7O4 — хлорная кислота,
HCl+5O3HCl+5O3 — хлорноватая кислота,
HCl+3O2HCl+3O2 — хлористая кислота,
HCl+1OHCl+1O - хлорноватистая кислота.
Если элемент в одной и той же степени окисления образует несколько кислородсодержащих кислот, то к названию кислоты с меньшим содержанием кислородных атомов добавляется приставка мета-, при наибольшем числе – приставкаорто-. Например, HPO3HPO3 метафосфорная кислота и H3PO4H3PO4 ортофосфорная кислота.
Для многих неорганических кислот характерны тривиальные названия:
плавиковая кислота - HFHF или фтороводородная
синимальная кислота - HCNHCN или циановодородная
соляная кислота - HClHCl или хлороводородная
Сила
кислот убывает в ряду:
![]()
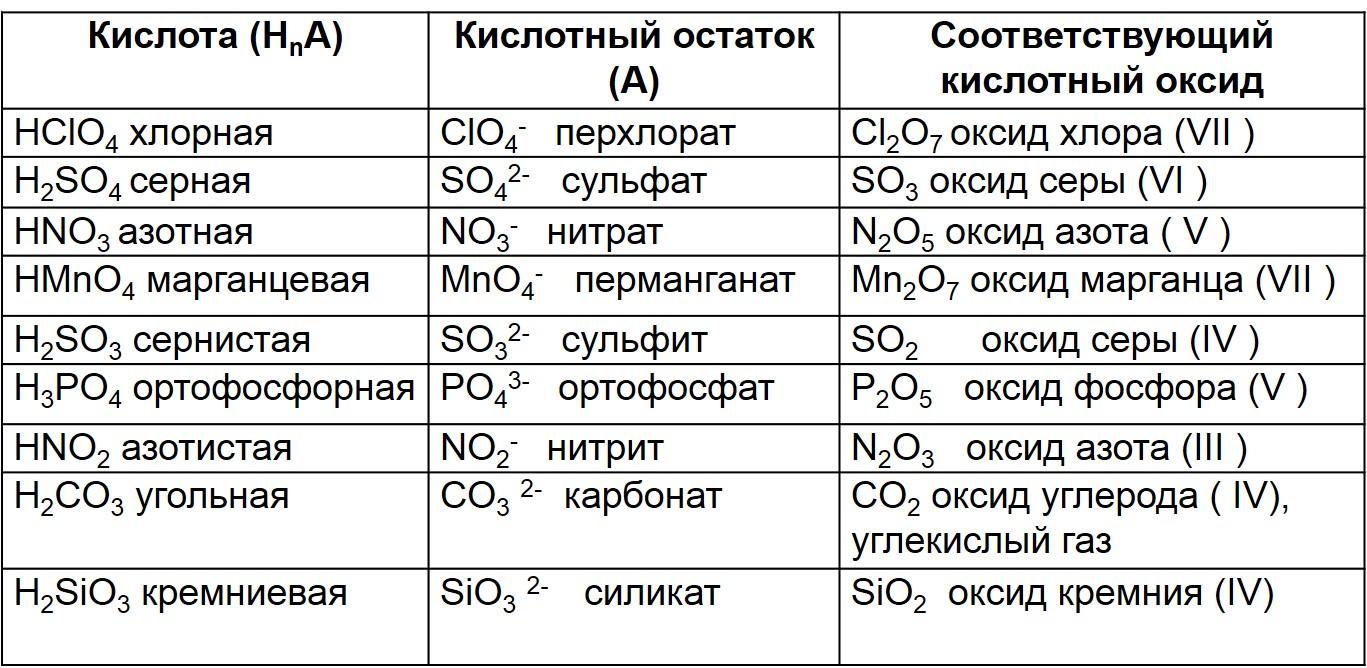
Кислородосодержащие кислоты и соответствующие кислотные оксиды
Получение кислот

Химические свойства кислот


Применение кислот часто происходит на производствах и в быту. Среди применяемых в быту кислот выделяют: азотную, соляную, фосфорную.
6. Химические свойства солей, получение, применение, классификация, номенклатура
Соли - Сложные вещества, которые в водных растворах диссоциируют на катионы металлов и анионы кислотных остатков. Июпак определяет соли как химические соединения, состоящие из катионов и анионов
КЛАССИФИКАЦИЯ И НОМЕНКЛАТУРА СОЛЕЙ
|
средние |
кислые |
основные |
|
Продукт полного замещения водорода кислоты на металл |
Продукт неполного замещения водорода кислоты на металл (известны только для многоосновных кислот) |
Продукт неполного замещения гидроксильных групп основания на кислотный остаток (известны только для многокислотных оснований) |
|
Название кислотного остатка (именительный падеж) название катиона металла в родительном падеже |
Приставка гидро (с соотвествующим числительным: ди-, три- и т.д.), название кислотного остатка катиона. |
Название кислотного остатка, затем название катиона в родительном падеже с приставкой гидроксо (с соотвествующим числительным: ди-, три- и т.д.). |
|
Na2SO4Na2SO4сульфат натрия CuCl2CuCl2 хлорид меди(II) Ca3(PO4)2Ca3(PO4)2 ортофосфат кальция |
NaHSO4NaHSO4 гидросульфат натрия CaHPO4CaHPO4гидроортофосфат кальция Ca(H2PO4)2Ca(H2PO4)2дигидроортофосфат кальция |
CuOHClCuOHCl гидроксохлорид меди (II) Ca5(PO4)3(OH)Ca5(PO4)3(OH)гидроксоортофосфат кальция |
|
двойные |
смешанные |
комплексные |
|
Продукт полного замещения водорода кислоты на несколько металлов |
Продукт полного замещения гидроксильных групп основания на несколько кислотных остатков |
Комплексные соединения состоят из внешней и внутренней координационной сферы, последняя образована атомом-комплексообразователем и лигандами. |
|
Название аниона в именительном падеже и катионов в родительном, через дефис. |
Названия анионов в именительном падеже через дефис и название катиона в родительном. |
Названия комплексных соединений состоят из двух частей: внутренней и внешней сферы, причем вся внутренняя сфера называется одним словом. * |
|
KAl(SO4)2KAl(SO4)2 – сульфат алюминия-калия; NH4MgPO4NH4MgPO4 – фосфат магния-аммония; (NH4)2Fe(SO4)2(NH4)2Fe(SO4)2 – сульфат железа(II) – аммония. |
CaCl(OCl)) – кальциевая соль соляной и хлорноватистой (HOCl) кислот (или хлорид-гипохлорит кальция). |
K3[Cu(CN)4]K3[Cu(CN)4] – тетрацианокупрат (I) калия; [Pt(NH3)3Cl]Cl[Pt(NH3)3Cl]Cl – хлорид хлоротриамминплатины (II); [Co(H2O)3F3][Co(H2O)3F3] – трифторотриаквакобальт |
Химические свойства солей
При химических реакциях солей проявляются особенности как катионов, так и анионов, входящих в их состав. Катионы металлов, находящиеся в растворах, могут вступать в реакции с другими анионами с образованием нерастворимых соединений. С другой стороны, анионы, входящие в состав солей, могут соединяться с катионами с образованием осадков или малодиссоциированных соединений. Таким образом, соли могут реагировать:
|
1. С металлами |
Cu + HgCl2 = CuCl2 + Hg , Zn + Pb(NO3)2 = Zn(NO3)2 + Pb. |
|
2. C кислотами |
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑, AgCl + HBr = AgBr↓ + HCl |
|
3. C солями |
AgNO3 + NaCl = AgCl↓ + NaNO3, K2CrO4 + Pb(NO3)2 = KNO3 + PbCrO4↓. |
|
4. C основаниями |
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4, Ni(NO3)2 + 2KOH = Ni(OH)2 + 2KNO3. |
|
5. Многие соли устойчивы при нагревании. Однако, соли аммония, а также некоторые соли малоактивных металлов, слабых кислот и кислот, в которых элементы проявляют высшие или низшие степени окисления, при нагревании разлагаются: CaCO3 = CaO + CO2, 2Ag2CO3 = 4Ag + 2CO2 + O2, NH4Cl = NH3 + HCl, 2KNO3 = 2KNO2 + O2, 2FeSO4 = Fe2O3 + SO2 + SO3, 4FeSO4 = 2Fe2O3 + 4SO2 + O2, NH4NO3 = N2O + 2H2O. | |
Получение:
