
- •Оглавление
- •2. Химические свойства Металлов и Неметаллов
- •4. Коррозия Металлов, способы устранения коррозии
- •5. Кислота (классификация, слабые и сильные, номенклатура, химические свойства кислот, взаимодействие с неметаллами, получение, применение)
- •6. Химические свойства солей, получение, применение, классификация, номенклатура
- •1. Реакция нейтрализации
- •7. Химические свойства оксидов, определение, свойства, получение, номенклатура.
- •8. Химические свойства оснований, классификация, номенклатура, получение. Амфотерные гидроксиды и оксиды
- •10.Дисперсные системы. Строение мицелл. Воздействие на систему.
- •11. Скорость химической реакции. Факторы, влияющие на скорость.
- •12. Химическое равновесие. Принцип Ле-Шателье, обратимые, необратимые реакции
- •13. Окислительно-восстановительные реакции. Основные окислители и восстановители
- •14. Электролиз
- •15. Алканы, алкены, алкины. Химические свойства, применение.
- •16. Реакции полимеризации и поликонденсации
- •17. Химическая связь. Типы химической связи
- •18. Гидролиз и электрическая диссоциация
- •19. Способы выражения концентрации раствора. Растворы
- •20. Строение атомов: Модель Томсана, Теория Резерфорда, ядерная модель Резерфорда.
- •21. Правила заполнения электрических уровней: правило Хунда, Клечковского, принцип Паули.
- •22. Современное представление о строение атома: принцип неопределенности Гейзенберга, двойственная природа электрона.
- •Природный газ - сн4 (Метан)
- •Типы классификаций реакции.
- •По тепловому эффекту.
- •По присутствию других веществ.
8. Химические свойства оснований, классификация, номенклатура, получение. Амфотерные гидроксиды и оксиды
Основания - Это химическое соединение, способное образовывать ковалентную связь с протоном (основание Бренстеда) либо с вакантной орбиталью другого химического соединения (основание Льюиса)
Химические свойства оснований
|
Щелочи |
Нерастворимые основания |
|
Изменение окраски индикторов | |
|
фенолфталеин - малиновый метилоранж - оранжевый лакмус- синий универсальный индикатор - от синего до фиолетового |
не меняют |
|
Взаимодействие с кислотами (реакция нейтрализации) | |
|
2NaOH+H2SO4=Na2SO4+2H2O2NaOH+H2SO4=Na2SO4+2H2O |
Cu(OH)2+2HNO3=Cu(NO3)2+2H2OCu(OH)2+2HNO3=Cu(NO3)2+2H2O |
|
Взаимодействие с кислотными оксидами | |
|
SO2+2KOH=K2SO3+H2O4SO2+2KOH=K2SO3+H2O4 |
−− |
|
Взаимодействие с амфотерными оксидами | |
|
Al2O3+6NaOH+3H2O=2Na3[Al(OH)6]Al2O3+6NaOH+3H2O=2Na3[Al(OH)6] в растворе Al2O3+2NaOH=2NaAlO2+H2OAl2O3+2NaOH=2NaAlO2+H2O в расплаве |
−− |
|
Взаимодействие с солями | |
|
средними (правило Бертолле): 2NaOH+MgSO4=Mg(OH)2↓+Na2SO42NaOH+MgSO4=Mg(OH)2↓+Na2SO4 кислыми: NaHCO3+NaOH=Na2CO3+H2ONaHCO3+NaOH=Na2CO3+H2O |
−− |
|
Разложение при нагревании | |
|
не разлагаются, кроме LiOH: 2LiOH−→−−−−−800∘C,H2Li2O+H2O2LiOH→800∘C,H2Li2O+H2O |
Cu(OH)2=CuO+H2OCu(OH)2=CuO+H2O |
|
Взаимодействие с неметаллами | |
|
2NaOH(конц., хол.)+Cl2=NaClO+NaCl+H2O2NaOH(конц., хол.)+Cl2=NaClO+NaCl+H2O 6NaOH(конц., гор.)+3Cl2=NaClO3+5NaCl+3H2O6NaOH(конц., гор.)+3Cl2=NaClO3+5NaCl+3H2O |
−− |
Методы получения оснований
1. электролиз водных растворов солей активных металлов:
2NaCl+2H2O=2NaOH+H2↑+Cl2↑2NaCl+2H2O=2NaOH+H2↑+Cl2↑
В ходе электролиза солей металлов, стоящих в ряду напряжения до алюминия, на катоде происходит восстановление воды с выделением газообразного водорода и гидроксид-ионов. Катионы металла, образованные в ходе диссоциации соли, образуют с полученными гидроксид-ионами основания.
2. взаимодействие металлов с водой: 2Na+2H2O=2NaOH+H2↑2Na+2H2O=2NaOH+H2↑ Этот метод не находит практического применения ни в лаборатории, ни в промышленности
3. взаимодействие оксидов с водой: CaO+H2O=Ca(OH)2CaO+H2O=Ca(OH)2
4. обменные реакции (можно получать и растворимые и нерастворимые основания): Ba(OH)2+K2SO4=2KOH+BaSO4↓Ba(OH)2+K2SO4=2KOH+BaSO4↓ CuCl2+2NaOH=Cu(OH)2↓+2NaNO3
Амфотерные соединения – это вещества, которые в зависимости от условий реакций проявляют кислотные или основные свойства.
Амфотерные гидроксиды – нерастворимые в воде вещества, и при нагревании они разлагаются на оксид металла и воду:
Zn(OH)2 = ZnO + H2O
2Fe(OH)3 = Fe2O3 + 3H2O
2Al(OH)3 = Al2O3 + 3H2O
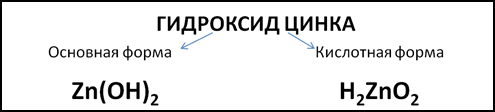
Примером амфотерного гидроксида может служить гидроксид цинка. Формула этого гидроксида в основной форме – Zn(OH)2. Но можно записать формулу гидроксида цинка в кислотной форме, поставив на первое место атомы водорода, как в формулах неорганических кислот: H2ZnO2 (Рис. 1). Тогда ZnO22- будет кислотным остатком с зарядом 2-.
Особенностью амфотерного гидроксида является то, что в нем мало различаются по прочности связи О-Н и Zn-O. Отсюда и двойственность свойств. В реакциях с кислотами, готовыми отдать катионы водорода, гидроксиду цинка выгодно разрывать связь Zn-O, отдавая ОН-группу и выступая в роли основания. В результате таких реакций образуются соли, в которых цинк является катионом, поэтому их называют солями катионного типа:
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
![]()
Амфотерные оксиды — солеобразующие оксиды, проявляющие в зависимости от условий либо осно́вные, либо кислотные свойства (то есть проявляющие амфотерность). Образуются переходными металлами. Металлы в амфотерных оксидах обычно проявляют степень окисления от III до IV, за исключением ZnO, BeO, SnO, PbO.
Амфотерные оксиды обладают двойственной природой: они могут взаимодействовать с кислотами и с основаниями (щелочами):
Al2O3 + 6HCl = 2AlCl3 + 3 H2O,
Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4].
Типичные амфотерные оксиды: H2O, BeO, Al2O3, Cr2O3, Fe2O3 и др.
9. Химическая термодинамика. Понятия системы, энтропия, энтальпия, тепловой эффект химической реакции, закон Гесса и его следствие. Эндотерм и Экзотерм реакции, 1 и 2 законы термодинамики, Скорость химической реакции (факторы влияющие), правило Вант- Гоффа, уравнение Вант- Гоффа.
Химическая термодинамика – наука, изучающая условия устойчивости систем и законы.
Термодинамика – наука о макросистемах.
Термодинамическая система – макроскопическая часть окружающего мира, в которой протекают различные физические и химические процессы.
Дисперсной системой называется гетерогенная система, в которой мелкие частицы одной фазы равномерно распределены в объеме другой фазы.
Энтропия (От греческого entropia) - поворот, превращение. Понятие энтропии впервые было введено в термодинамике для определения меры необратимого рассеяния энергии. Энтропия широко применяется и в других областях науки: в статистической физике как мера вероятности осуществления какого -- либо макроскопического состояния; в теории информации -- мера неопределенности какого-либо опыта (испытания), который может иметь разные исходы. Все эти трактовки энтропии имеют глубокую внутреннюю связь.
Энтальпия (тепловая функция, теплосодержание) — термодинамический потенциал, характеризующий состояние системы в термодинамическом равновесии при выборе в качестве независимых переменных давления, энтропии и числа частиц.
Проще говоря, энтальпия — это та энергия, которая доступна для преобразования в теплоту при определенном постоянном давлении.
Тепловые эффекты принято указывать в термохимических уравнениях химических реакций, используя значения энтальпии (теплосодержания) системы ΔН.
Если ΔН < 0, то теплота выделяется, т.е. реакция является экзотермической.
Для эндотермических реакций ΔН > 0.
Тепловой эффект химической реакции — это выделенная или поглощенная теплота при данных количествах реагирующих веществ.
Тепловой эффект реакции зависит от состояния веществ.
Рассмотрим термохимическое уравнение реакции водорода с кислородом:
|
2H2(г)+ O2(г)= 2H2 O(г), ΔH=−483.6 кДж |
Эта запись означает, что при взаимодействии 2 моль водорода с 1 моль кислорода образуются 2 моль воды в газообразном состоянии. При этом выделяется 483.6(кДж) теплоты.
Закон Гесса — Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути её протекания.
Следствия из закона Гесса:
Тепловой эффект обратной реакции равен тепловому эффекту прямой реакции с обратным знаком, т.е. для реакций
![]()
отвечающие
им тепловые эффекты ![]() связаны
равенством
связаны
равенством
![]() .
.
2. Если в результате ряда последовательных химических реакций система приходит в состояние, полностью совпадающее с исходным (круговой процесс), то сумма тепловых эффектов этих реакций равна нулю, т.е. для ряда реакций

сумма их тепловых эффектов
![]() .
.
Под
энтальпией образования понимают тепловой
эффект реакции образования 1 моля
вещества из простых веществ. Обычно
используют стандартные энтальпии
образования. Их обозначают ![]() или
или ![]() (часто
один из индексов опускают; f – от англ.
formation).
(часто
один из индексов опускают; f – от англ.
formation).
Первое начало термодинамики - Изменение внутренней энергии системы при переходе ее из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе
Согласно первому началу термодинамики, работа может совершаться только за счет теплоты или какой-либо другой формы энергии. Следовательно, работу и количество теплоты измеряют в одних единицах —джоулях (как и энергию).
ΔU = A + Q,
где ΔU — изменение внутренней энергии, A — работа внешних сил, Q — количество теплоты, переданной системе.
Второе начало термодинамики - Невозможен процесс, единственным результатом которого являлась бы передача тепла от более холодного тела к более горячему
Правило Вант-Гоффа гласит, что при повышении температуры на каждые 10о скорость химической реакции увеличивается в 2-4 раза.
Уравнение, которое описывает это правило, следующее:{\displaystyle ~V_{2}=V_{1}\cdot \gamma ^{\frac {T_{2}-T_{1}}{10}}}
![]()
где V2 – скорость протекания реакции при температуре t2, а V1 – скорость протекания реакции при температуре t1;
ɣ - температурный коэффициент скорости реакции. (если он равен 2, например, то скорость реакции будет увеличиваться в 2 раза при повышении температуры на 10 градусов).
Эндотерми́ческие реа́кции — химические реакции, сопровождающиеся поглощением теплоты. Для эндотермических реакций изменение энтальпии и внутренней энергии имеют положительные значения{\displaystyle \Delta H>0}{\displaystyle \Delta U>0}, таким образом, продукты реакции содержат больше энергии, чем исходные компоненты.
К эндотермическим реакциям относятся:
реакции восстановления металлов из оксидов,
электролиза (поглощается электрическая энергия),
электролитической диссоциации (например, растворение солей в воде),
ионизации,
взрыв воды-подводимое к малому количеству воды большое количество тепла тратится на мгновенный нагрев и фазовый переход жидкости в перегретый пар,при этом внутреняя энергия увеличивается и проявляется в виде двух энергий пара-внутримолекулярной тепловой и межмолекулярной потенциальной.
фотосинтеза.
Экзотермическая реакция — химическая реакция, сопровождающаяся выделением теплоты. Противоположна эндотермической реакции.
