
- •Оглавление
- •2. Химические свойства Металлов и Неметаллов
- •4. Коррозия Металлов, способы устранения коррозии
- •5. Кислота (классификация, слабые и сильные, номенклатура, химические свойства кислот, взаимодействие с неметаллами, получение, применение)
- •6. Химические свойства солей, получение, применение, классификация, номенклатура
- •1. Реакция нейтрализации
- •7. Химические свойства оксидов, определение, свойства, получение, номенклатура.
- •8. Химические свойства оснований, классификация, номенклатура, получение. Амфотерные гидроксиды и оксиды
- •10.Дисперсные системы. Строение мицелл. Воздействие на систему.
- •11. Скорость химической реакции. Факторы, влияющие на скорость.
- •12. Химическое равновесие. Принцип Ле-Шателье, обратимые, необратимые реакции
- •13. Окислительно-восстановительные реакции. Основные окислители и восстановители
- •14. Электролиз
- •15. Алканы, алкены, алкины. Химические свойства, применение.
- •16. Реакции полимеризации и поликонденсации
- •17. Химическая связь. Типы химической связи
- •18. Гидролиз и электрическая диссоциация
- •19. Способы выражения концентрации раствора. Растворы
- •20. Строение атомов: Модель Томсана, Теория Резерфорда, ядерная модель Резерфорда.
- •21. Правила заполнения электрических уровней: правило Хунда, Клечковского, принцип Паули.
- •22. Современное представление о строение атома: принцип неопределенности Гейзенберга, двойственная природа электрона.
- •Природный газ - сн4 (Метан)
- •Типы классификаций реакции.
- •По тепловому эффекту.
- •По присутствию других веществ.
2. Химические свойства Металлов и Неметаллов
1. Металлы реагируют с неметаллами.
2 Me + n Hal2 → 2 MeHaln
4Li + O2 = 2Li2O
Щелочные металлы, за исключением лития, образуют пероксиды:
2Na + O2 = Na2O2
2. Металлы, стоящие до водорода, реагируют с кислотами (кроме азотной и серной конц.) с выделением водорода
Me + HCl → соль + H2↑
2 Al + 6 HCl → 2 AlCl3 + 3 H2↑
Pb + 2 HCl → PbCl2↓ + H2↑
3. Активные металлы реагируют с водой с образованием щелочи и выделением водорода.
2Me + 2nH2O → 2Me(OH)n + nH2
Продуктом окисления металла является его гидроксид – Me(OH)n (где n-степень окисления металла).
Например:
Ca + 2H2O → Ca(OH)2 + H2↑
4. Металлы средней активности реагируют с водой при нагревании, образуя оксид металла и водород.
2Me + nH2O → Me2On + nH2
Продукт окисления в таких реакциях – оксид металла Me2On (где n-степень окисления металла).
3Fe + 4H2O → Fe2O3·FeO + 4H2
5. Металлы, стоящие после водорода, с водой и растворами кислот (кроме азотной и серной конц.) не реагируют
6. Более активные металлы вытесняют менее активные из растворов их солей.
CuSO4 + Zn = Zn SO4 + Cu
CuSO4 + Fe = Fe SO4 + Cu
Активные металлы ‑ цинк и железо заместили медь в сульфате и образовали соли. Цинк и железо окислились, а медь восстановилась.
7. Галогены реагируют с водой и раствором щелочи.
Фтор в отличие от других галогенов воду окисляет:
2H2O + 2F2 = 4HF + O2.
на холоде: Cl2+2KOH=KClO+KCl+H2OCl2+2KOH=KClO+KCl+H2O образуется хлорид и гипохлорит
при нагревании: 3Cl2+6KOH−→KClO3+5KCl+3H2O3Cl2+6KOH→t,∘CKClO3+5KCl+3H2O образуется лорид и хлорат
8 Активные галогены (кроме фтора) вытесняют менее активные галогены из растворов их солей.
HBr HF HCl HI
9. Галогены не реагируют с кислородом.
10. Амфотерные металлы (Al, Be, Zn) реагируют с растворами щелочей и кислот.
3Zn+4H2SO4=3ZnSO4+S+4H2O
11. Магний реагирует с углекислым газом и оксидом кремния.
2Мg + CO2 = C + 2MgO
SiO2+2Mg=Si+2MgO
12. Щелочные металлы (кроме лития) с кислородом образуют пероксиды.
2Na + O2 = Na2O2
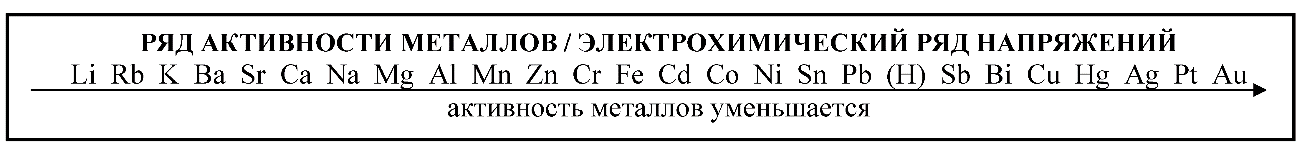
3. Классификация неорганических соединений
Простые вещества – вещества, молекулы которых состоят из атомов одного вида (атомов одного элемента). В химических реакциях не могут разлагаться с образованием других веществ.
Сложные вещества (или химические соединения) – вещества, молекулы которых состоят из атомов разного вида (атомов различных химических элементов). В химических реакциях разлагаются с образованием нескольких других веществ.
Простые вещества разбиваются на две большие группы: металлы и неметаллы.
Металлы – группа элементов, обладающая характерными металлическими свойствами: твёрдые вещества (исключение составляет ртуть) имеют металлический блеск, являются хорошими проводниками теплоты и электричества, ковкие (железо (Fe), медь (Cu), алюминий (Al), ртуть (Hg), золото (Au), серебро (Ag) и др.).
Неметаллы – группа элементов: твёрдые, жидкие (бром) и газообразные веществ, которые не обладают металлическим блеском, являются изоляторы, хрупкие.
А сложные вещества в свою очередь подразделятся на четыре группы, или класса: оксиды, основания, кислоты и соли.
Оксиды – это сложные вещества, в состав молекул которых входят атомы кислорода и какого – нибудь другого вещества.
Основания – это сложные вещества, в которых атомы металлов соединены с одной или несколькими гидроксильными группами.
С точки зрения теории электролитической диссоциации, основания – сложные вещества, при диссоциации которых в водном растворе образуются катионы металла (или NH4+) и гидроксид – анионы OH-.
Кислоты – это сложные вещества, в состав молекул которых входят атомы водорода, способные замещаться или обмениваться на атомы металла.
Соли – это сложные вещества, молекулы которых состоят из атомов металлов и кислотных остатков. Соль представляет собой продукт частичного или полного замещения атомов водорода кислоты металлом.
