
- •Оглавление
- •2. Химические свойства Металлов и Неметаллов
- •4. Коррозия Металлов, способы устранения коррозии
- •5. Кислота (классификация, слабые и сильные, номенклатура, химические свойства кислот, взаимодействие с неметаллами, получение, применение)
- •6. Химические свойства солей, получение, применение, классификация, номенклатура
- •1. Реакция нейтрализации
- •7. Химические свойства оксидов, определение, свойства, получение, номенклатура.
- •8. Химические свойства оснований, классификация, номенклатура, получение. Амфотерные гидроксиды и оксиды
- •10.Дисперсные системы. Строение мицелл. Воздействие на систему.
- •11. Скорость химической реакции. Факторы, влияющие на скорость.
- •12. Химическое равновесие. Принцип Ле-Шателье, обратимые, необратимые реакции
- •13. Окислительно-восстановительные реакции. Основные окислители и восстановители
- •14. Электролиз
- •15. Алканы, алкены, алкины. Химические свойства, применение.
- •16. Реакции полимеризации и поликонденсации
- •17. Химическая связь. Типы химической связи
- •18. Гидролиз и электрическая диссоциация
- •19. Способы выражения концентрации раствора. Растворы
- •20. Строение атомов: Модель Томсана, Теория Резерфорда, ядерная модель Резерфорда.
- •21. Правила заполнения электрических уровней: правило Хунда, Клечковского, принцип Паули.
- •22. Современное представление о строение атома: принцип неопределенности Гейзенберга, двойственная природа электрона.
- •Природный газ - сн4 (Метан)
- •Типы классификаций реакции.
- •По тепловому эффекту.
- •По присутствию других веществ.
17. Химическая связь. Типы химической связи
Химическая связь - это взаимное сцепление атомов в молекуле и кристаллической решётке в результате действия между атомами электрических сил притяжения.
Типы химической связи и их основные отличительные признаки.
|
Химическая связь |
Связываемые атомы |
Характер элементов |
Процесс в электронной оболочке |
Образующиеся частицы |
Кристаллическая решетка |
Характер вещества |
Примеры |
|
Ионная |
Атом металла и атом неметалла |
Электроположительный и электро отрицательный |
Переход валентных электронов |
Положительные и отрицательные ионы |
Ионная |
Солеобразный |
NaCl CaO NaOH |
|
Ковалентная |
Атомы неметаллов (реже-атомы металлов) |
Электроотрицательный реже электроположительный |
Образование общих электронных пар, заполнение молекулярных орбиталей |
Молекулы
|
Молекулярная
|
Летучий или нелетучий |
Br2 CO2 C6H6 |
|
--------- |
Атомная |
Алмазоподоб ный |
Алмаз Si SiC | ||||
|
Металличес кая |
Атомы металлов |
Электроположительный |
Отдача валентных электронов |
Положительные ионы и электронный газ |
Металлическая |
Металлическая |
Металлы и сплавы |
18. Гидролиз и электрическая диссоциация
Гидро́лиз — Это химическая реакция взаимодействия вещества с водой, при которой происходит разложение этого вещества и воды с образованием новых соединений.
Гидролиз солей - взаимодействие в водных растворах катионов и (или) анионов солей с молекулами воды, при котором к катиону, оказавшемуся в растворе, присоединяется группа ОН-, а к аниону - ион Н+ молекулы воды.
В результате гидролиза в растворе появляются ионы Н+ и ОН-, и среда становится соответственно кислой или щелочной.
Возможны следующие случаи гидролиза солей:
1) по аниону,
2)катиону,
3) катиону и аниону одновременно.
Рассмотрим подробно каждый из этих случаев.
Гидролиз по аниону. Ему подвергаются соли, образованные катионом сильного основания и анионом слабой кислоты (К2СОз, Na2S, Na2SO3, K3PO4 и др.). При гидролизе создается щелочная среда (рН > 7). Например:
1) в растворе CH3COONa диссоциирует:
CH3COONa « CH3COO- + Na+;
2) катионы Na+, отвечающие сильному основанию, с молекулами Н2О не реагируют:
Na+ + НОН реакция не идет;
3) анионы СН3СОО- слабой кислоты реагируют с молекулами воды, гидролизуются:
CH3COO- + НОН « СНзСООН + ОН-;
4) молекулярное уравнение гидролиза:
CH3COONa + НОН « СН3СООН + NaOH.
Гидролиз многозарядного аниона протекает ступенчато из-за ступенчатой диссоциации многоосновных кислот, при обычных условиях он проходит, в основном, по первой ступени.
Гидролиз по катиону. Ему подвергаются соли, образованные катионом слабого основания и анионом сильной кислоты (NH4Br, ZnCl2, Cu(NO3)2 и др.). При гидролизе таких солей идет подкисление среды (рН < 7). Например:
1) в растворе А1С13 диссоциирует:
А1С13 « AI3+ + ЗСl-;
2) анионы сильной хлороводородной кислоты ионы Cl- гидролизу не подвергаются:
Сl- + НОН реакция не идет;
3) катионы же слабого основания Аl3+ гидролизуются:
А13+ + НОН « АlОН2+ + H+,
4) молекулярное уравнение гидролиза:
А1С13 + Н2О « А1ОНС12 + НС1.
Гидролизом по второй и третьей ступени при обычных условиях можно пренебречь.
Гидролиз галогеналканов
Гидролиз галогеналканов используют дли получения спиртов. Присутствие щелочи (ОН ) иоэволяет «связать» получающуюся кислоту и сместить равновесие в сторону образования спирта.
Гидролиз сложных эфиров
Гидролиз сложных эфиров протекает обратимо в кислотной среде (в присутствии неорганической кислоты) с образованием соответствующего спирта и карбоновой кислоты.
Для смещения химическое равновесии в сторону продуктов реакции гидролиз проводят в присутствии щелочи. Исторически первым примером такой реакции было щелочное расщепление сложных эфиров высших жирных кислот, что привело к получению мыла. Это произошло в 1811 г., когда французский ученый Э. Шеврёль. нагревая жиры с водой в щелочной среде, получил глицерин и мыла — соли высших карбоновых кислот. На основании этого эксперимента был установлен состав жиров, они оказались сложными эфирами, но только «трижды сложными., производными трехатомного спирта глицерина — триглицеридамн. А процесс гидролиза сложных эфиров в щелочной среде до сих пор называют «омылением».
Например, омыление эфира, образованного глицерином, пальмитиновой и стеариновой кислотами:
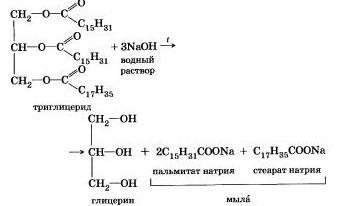
Натриевые соли высших карбоновых кислот — основные компоненты твердого мыла, калиевые соли — жидкого мыла.
Французский химик М. Бертло в 1854 г. осуществил реакцию этерификации и впервые синтезировал жир. Следовательно, гидролиз жиров (как и других сложных эфиров) протекает обратимо. Уравнение реакции можно упрощенно записать так:
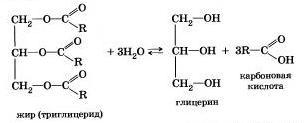
В живых организмах происходит ферментативный гидролиз жиров. В кишечнике под влиянием фермента липазы жиры пищи гидратизуются на глицерин и органические кислоты, которые всасываются стенками кишечника, и в организме синтезируются новые жиры, свойственные данному организму. Они по лимфатической системе поступают в кровь, а затем в жировую ткань. Отсюда жиры поступают в другие органы и ткани организма, где в процессе обмена веществ в клетках опять гидролиэу-ются и затем постепенно окисляются до оксида углерода и воды с выделеиием энергии, необходимой для жизнедеятельности.
В технике гидролиз жиров используют для получения глицерина, высших карбоновых кислот, мыла.
Гидролиз углеводов
Как вы зияете, углеводы являются важнейшими компонентами нашей пищи. Причем ди- (сахароза, лактоза, мальтоза) и полисахариды {крахмал, гликогеи) непосредственно не усваиваются организмом. Они, так же как и жиры, сначала подвергаются гидролизу. Гидролиз крахмала идет ступенчато. В лабораторных и промышленных условиях в качестве катализатора этих процессов используют кислоту. Реакции осуществляют при нагревании. Реакцию гидролиза крахмала до глюкозы при каталитическом действии серной кислоты осуществил в 1811 г. русский ученый К. С. Кирхгоф. В организме человека и животных гидролиз углеводов происходит под действием ферментов (схема 4).
Промышленным гидролизом крахмала получают глюкозу и патоку (смесь декстринов, мальтозы и глюкозы). Патоку применяют в кондитерском деле. Декстрины как продукт частичного гидролиза крахмала обладают клеящим действием: с ними связано появление корочки на хлебе п жареном картофеле, а также образование плотной пленки на накрал малеином белье под действием горячего утюга.
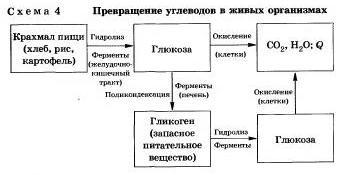
Еще один известный вам полисахарид — целлюлоза — также может гидролизоваться до глюкозы при длительном нагревании с минеральными кислотами. Процесс идет стуненчато, но кратко. Этот процесс лежит в основе многих гидролизных производств. Они служат для получения пищевых, кормовых и технических продуктов из непищевого растительиого сырья — отходов лесозаготовок, деревообработки (опилки, стружка, щепа), переработки сельскохозяйственных культур (соломы, шелухи семян, кочерыжек кукурузы и т. д.).
Техническими продуктами таких производств являются глицерин, этиленгликоль. органические кислоты, кормовые дрожжи, этиловый снирт, сорбит (шестиатомвый спирт).
Гидролиз белка
Вы знаете, что белки-биополимеры — основа жизни всех живых организмов (от вируса до человека) — состоят главным образом из аминокислот (наиболее часто встречаются 20). Установление последовательности расположения остатков аминокислот, составляющих молекулу белка, является первоначальной целью при исследовании его структуры. И установить ее помогает ступенчатый гидролиз белка, который осуществляют при нагревании с кислотами или щелочами, а также при действии ферментов.

Гидролиз аденозинтрифосфорной кислоты
Неизмеримо важную роль в организме играет процесс гидролиза аденозинтрифосфорной кислоты (ЛТФ). Это вещество служит источником энергии для всевозможных биохимических реакций (построения белка, сокращения мышц и др.). При гидролизе ЛТФ до аденозиндифосфорной кислоты (АДФ) энергия высвобождается. Обратный процесс образование ЛТФ из АДФ протекпет с поглощением энергии. Следовательно. АТФ это универсальное энергетическое вещество клетки. Водные растворы солей имеют разные значения ph и различные типы сред — кислотную (рН < 7), щелочную (рН > 7), нейтральную (рН - 7). Это объясняется тем, что соли в водных растворах могут подвергаться гидролизу.
Электролитическаядиссоциация
Распад молекул электролита на ионы под действием полярных молекул растворителя называется электролитической диссоциацией. Вещества, водные растворы или расплавы которых проводят электрический ток, называются электролитами.
К ним относятся вода, кислоты, основания и соли. При растворении в воде молекулы электролитов диссоциируют на положительные ионы – катионы и отрицательные – анионы. Процесс электролитической диссоциации обусловлен взаимодействием веществ с водой или другим растворителем, что приводит к образованию гидратированных ионов.
Так, ион водорода образует ион гидроксония:
Н+ + Н2О «Н3О+.
Для упрощения ион гидроксония записывают без указания молекул воды, то есть Н+.
NaCl + nH2O ® Na+(H2O)x + Cl–(H2O)n-x,
или принята запись:NaCl «Na+ + Cl–.
