
А Е Щеголев Органическая химия 2016 / 11 Полициклические ароматические углеводороды и их производные
.pdf
11.2.2.3. Окисление
Энергичное окисление кислородом на ванадиевом катализаторе приводит к разрушению одного кольца и образованию фталевого ангидрида:
O
O2 |
/ V2O5 |
/ T |
|
|
O |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
O
Эта реакция для монозамещѐнных нафталинов протекает по кольцу, имеющему бóльшую -электронную плотность. Так, например, в молекуле-аминонафталина разрушается замещѐнное кольцо, содержащее электронодонор:
NH2 |
|
O |
O2 / V2O5 |
/ T |
O |
|
|
O
А в молекуле -нитронафталина, наоборот, разрушается незамещѐнное кольцо, так как заместитель понижает электронную плотность, что препятствует реакции окисления:
NO2 |
|
|
NO2 O |
O2 |
/ V2O5 |
/ T |
O |
|
|
|
|
|
|
|
O |
Мягкое окисление нафталина и его производных также возможно. Причѐм нафталины окисляются легче, чем гомологи бензола, и эта реакция приводит обычно к образованию нафтохинонов:
|
O |
CH |
CH3 |
3 |
|
|
[O] |
|
O |
|
2-метил-1,4-нафтохинон |
584

11.2.3. СПОСОБЫ ПОЛУЧЕНИЯ
Главным источником нафталина, так же как и бензола, является каменноугольная смола. Кроме того, существуют и синтетические способы получения, как самого нафталина, так и его производных.
1. Из бензола и ацетилена пропусканием через раскалѐнные трубки:
T
+ 2 HC  CH
CH
2. Дегидрирование гомологов бензола:
CH2 |
|
|
|
|
|
|
|
|
|
|
CH2 |
Pt / T |
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
- 2H2 |
|
|
|
|
|
H2C |
CH2 |
|
|
|
|
|||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
CH3 |
|||
|
|
|
|
|
|
|||
|
|
|
|
|
|
1-метилнафталин |
||
3. Из бут-1,3-диена и п-бензохинона реакцией диенового синтеза с последующим дегидрированием и восстановлением:
|
O |
O |
O |
|
HC |
CH2 |
|
|
|
|
|
3H2 |
||
|
+ |
|
||
HC |
-2H2 |
-2H2O |
||
CH2 |
||||
|
|
|
||
|
O |
O |
O |
11.2.4. ВАЖНЕЙШИЕ ПРЕДСТАВИТЕЛИ
Нафтолы ( -нафтол и -нафтол) — бесцветные кристаллы со слабым фенольным запахом, хорошо растворимые в этаноле, диэтиловом эфире, хлороформе, бензоле, плохо в воде.
OH
OH
-нафтол, |
-нафтол, |
или нафталин-1-ол |
или нафталин-2-ол |
585

По химическим свойствам типичные фенолы. С водными растворами щелочей образуют растворимые в воде соли.
Подобно фенолам обладают дезинфицирующими свойствами. Однако в медицине нашѐл применение лишь -нафтол, его применяют для лечения кишечных заболеваний. Получают -нафтол из нафталин-2- сульфокислоты щелочным плавлением при температуре 300 340 С.
Применяются нафтолы также в производстве красителей. п-Нафтохинон (1,4-нафтохинон) — кристаллы жѐлтого цвета с
температурой плавления 128 С, хорошо растворимые в полярных органических растворителях, плохо в воде. По химическим свойствам аналогичен п-бензохинону. Сильный окислитель, легко восстанавливается до соответствующего гидрохинона. Сам является продуктом окисления нафталина триоксидом хрома в уксусной кислоте.
Является промежуточным продуктом в синтезе антрахиноновых красителей, катализатор в синтезе синтетического каучука, ингибитор коррозии.
Используется в производстве синтетического волокна — лавсана (полиэтилентерефталата) и в синтезе красителей.
Витамины К — группа производных п-нафтохинона, стимулирующих свѐртывание крови. Витамины К1 и К2 содержатся в зелѐных травах, листьях, овощах и представляют собой вязкую жѐлтую жидкость, нерастворимую в воде.
O |
O |
CH3 |
CH3 |
R |
|
O |
O |
витамины К1 и К2 |
витамин К3 |
Витамин К3 синтетический продукт, представляет собой лимон- но-жѐлтые кристаллы, плохо растворимые в воде.
11.3. АНТРАЦЕН
Молекулу антрацена можно представить как конденсированную систему из трѐх бензольных колец:
или
586
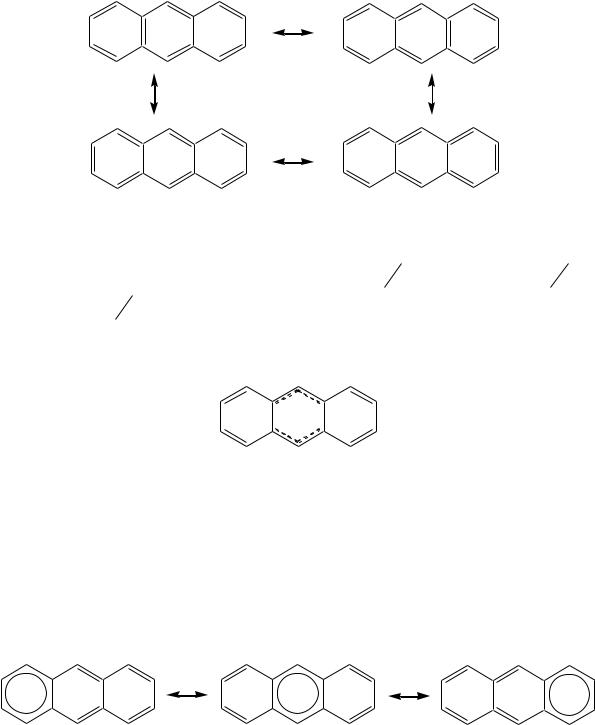
11.3.1. СТРОЕНИЕ, ИЗОМЕРИЯ, НОМЕНКЛАТУРА
Так же, как и в случае нафталина, все атомы углерода молекулы антрацена расположены в одной плоскости, атомные орбитали, участвующие в образовании -связей, находятся в гибридизации, близкой к sp2. Негибридные pz-орбитали образуют единую трициклическую сопряжѐнную систему. Поэтому молекулу антрацена можно представить в виде четырѐх граничных структур:
e a |
b |
e a |
b |
d |
c |
d |
c |
e a |
b |
e a |
b |
d |
c |
d |
c |
При этом, если выделить пять разных типов углерод-углеродных связей, можно заметить их неравнозначность, т.е. связи а, b, c, d и e обладают разным -характером. Так, для связей а, c и d это 14 , для связи b — 3 4 , а
для связи e — 12 . Таким образом, связь b по характеру близка к двойной,
связи e к ординарным, а остальные углерод-углеродные связи к полуторным. Это условно можно изобразить следующей структурой:
И, соответственно, длины углерод-углеродных связей в молекуле антрацена составляют: длина связи b — 0.137 нм, длина связи e 0.140 нм, а для других углерод-углеродных связей — 0.141 0.144 нм.
Каждый из трѐх шестичленных циклов в молекуле антрацена (только один из трѐх) обладает ароматичностью, так как представляет собой 6- - электронную циклическую сопряжѐнную систему. Остальные углеродные фрагменты можно представить диеновыми системами, соединѐнными с бензольным кольцом:
587

Антрацен обладает ароматичностью. Однако его ароматичность ниже ароматичности бензола и нафталина, так как ароматичность любой полициклической системы может быть оценена долей в ней ароматических циклов. В антрацене из трѐх циклов, имеющихся в молекуле, только один может быть ароматическим (а в двух других можно выделить лишь диеновые системы). В сравниваемом нафталине ароматическим является один цикл из двух. В результате такого сравнения и сравнения с бензолом получается ряд уменьшения ароматичности:
> |
|
|
|
> |
|
|
|
|
|
Приведѐм общепринятую нумерацию атомов углерода в антраценовой системе:
8 |
9 |
1 |
7 |
|
2 |
6 |
|
3 |
|
|
|
5 |
10 |
4 |
Положения 9 и 10 иногда называют мезоположениями.
В отличие от нафталина, для антрацена возможно уже три изомерных монопроизводных: по 1, 2 и 9 углеродным атомам соответственно:
X X
X
11.3.2. СВОЙСТВА
Антрацен — бесцветное кристаллическое вещество с температурой плавления 217 С и температурой кипения 351 С. Аналогично углеводородам ряда бензола и нафталина он нерастворим в воде, но растворяется в органических растворителях. Для растворов характерна фиолетовая флуоресценция.
Химические свойства антрацена определяются наличием ароматической и диеновой систем. При этом диеновый характер антрацена должен быть выражен ещѐ сильнее, чем у нафталина. В целом взаимодействие с электрофилами протекает легко, но во многих случаях сначала получаются
588

продукты присоединения по 9-му и 10-му положениям. При нагревании эти вещества превращаются в замещѐнные антрацены.
Так, бромирование антрацена протекает легко:
|
|
H Br |
|
+ Br2 |
Br - |
|
|
|
|
|
+ |
H |
Br |
Br |
|
T |
|
|
- HBr |
|
Br |
H |
|
9,10-дибром-9,10-дигидроантрацен |
9-бромантрацен |
|
Электрофильная атака в центральное кольцо оказывается значительно выгоднее, чем по любому периферийному кольцу. Это связано как со стабильностью образующегося -комплекса, в котором делокализация заряда происходит с участием двух бензольных колец
H E
+
H ,
так и с формально большей ароматичностью -комплекса и продукта присоединения 9,10-дибром-9,10-дигидроантрацена по сравнению с самим антраценом, так как в этих трициклических частицах присутствуют два ароматических кольца.
При сульфировании антрацена при повышенных температурах можно получить 1- и 2-замещѐнные сульфокислоты, однако первичным продуктом будет 9-антраценсульфокислота:
SO3H
H2SO4 



 T
T
антрацен-9-сульфокислота
589

SO3H



 SO3H
SO3H
+
антрацен-1-сульфокислота |
антрацен-2-сульфокислота |
Продукты моносульфирования могут легко дальше превращаться в дисульфокислоты (аналогично нафталину), давая, главным образом, смесь 1,5- и 1,8-дизамещѐнных антраценов, а при нагревании 2,6- и 2,7- антрацендисульфокислот.
Антрацен легко нитруется азотной кислотой в обычных условиях, образуя единственный продукт мононитрования 9-нитроантрацен:
NO2
HNO3
9-нитроантрацен
К типичным реакциям присоединения относятся реакция диенового синтеза (реакция Дильса–Альдера)
O O O 
O
+ O
O
малеиновый ангидрид
и реакция фотодимеризации антрацена
H
2 |
h |
2 |
H
590

Гидрирование антрацена в мягких условиях приводит к образованию 9,10-дигидроантрацена, что также объясняется высокой устойчивостью системы, содержащей два бензольных кольца:
H H
Na + C2H5OH
H H
Продукт исчерпывающего гидрирования (пергидроантрацен) можно получить, проводя реакцию в жѐстких условиях с применением металлических катализаторов.
Окисление по 9-му и 10-му атомам также протекает легко с участием разных окислителей, например, K2Cr2O7 в сернокислой среде, концентрированной HNO3 , кислорода при освещении и других:
O
[O]
O
9,10-антрахинон
При использовании кислорода реакция протекает через образование нестабильного фотооксида. Стабильный фотооксид удаѐтся получить только для некоторых 9,10-замещѐнных антраценов, например:
591

O
O
O2, h
9,10-дифенилантрацен |
9,10-дифенилантрацен-9,10-пероксид |
11.3.3. СПОСОБЫ ПОЛУЧЕНИЯ
Основным источником получения антрацена, как и нафталина, и бензола, является каменноугольная смола. Синтетические способы существуют, хотя они часто сложны и многостадийны. Так, например, антрацен может быть получен из нафталина и ацетилена (а значит, и из бензола и ацетилена — гл. 11.2.3):
T
+ 2 HC  CH
CH
или из бензола и фталевого ангидрида:
O |
O |
|
|
|
C |
O + |
|
|
COOH |
O |
|
O |
|
|
3H2 |
- H2O |
- 2H O |
|
2 |
O |
|
9,10-антрахинон |
антрацен |
592

Антрацен и его гомологи могут быть получены и в реакциях алкилирования по Фриделю–Крафтсу. Для этого используются бензол, его гомологи и их галогенпроизводные. Например:
CH2Cl
+ |
AlCl3 |
|
|
- 2HCl |
- H2 |
||
|
|||
|
ClCH2 |
|
9,10-дигидроантрацен
Используются также способы восстановления 9,10-антрахинона (аналогично в вышеприведѐнной схеме) и другие способы.
11.3.4. ВАЖНЕЙШИЕ ПРЕДСТАВИТЕЛИ
9,10-Антрахинон — светло-жѐлтое кристаллическое вещество с температурой плавления 286 С. Получают из бензола и фталевого ангидрида. Используют для синтеза красителей (ализарина, индантренового синего и др.).
Эмодины — производные антрахинона, являющиеся действующими веществами препаратов алоэ, ревеня, крушины и др., часто использующихся в качестве слабительных средств. Они содержатся как в свободном виде, так и в виде эфиров и гликозидов. Представителем является 1,8- дигидрокси-3,6-диметил-9,10-антрахинон (обнаружен в крушине):
OH O OH
H3C 



 CH3
CH3
O
Кроме того, в медицинской практике широко используются антибиотики антрациклинового ряда, структура которых содержит фрагмент антрахинона.
593
