
А Е Щеголев Органическая химия 2016 / 10 Производные бензола
.pdf
Глава 10. ПРОИЗВОДНЫЕ БЕНЗОЛА
В бензольном кольце в качестве заместителей могут быть самые разные атомы и атомные группировки. Такими заместителями могут быть атомы галогенов (-F, -Cl, -Br, -I), сульфо- (-SO3H), нитро- (-NO2), аминогруппы (-NH2), гидроксильная и алкоксильная группы (-OH, -OR), карбонильная и карбоксильная группы (-COR, -COOH) и другие.
Общую формулу монозамещѐнных бензолов можно представить в следующем виде:

 X
X
Однако в общем случае молекулы ароматических соединений могут содержать характеристические группы как в ароматическом кольце, так и в боковой алифатической цепи. Такие вещества, проявляющие свойства и ароматических соединений, и алифатических производных, также здесь будут рассмотрены.
10.1. ОБЩНОСТЬ СТРОЕНИЯ И СВОЙСТВ МОНОЗАМЕЩЁННЫХ БЕНЗОЛОВ
Заместители в бензольном кольце в соответствии со своей природой оказывают как электронное, так и пространственное влияние на строение всего соединения в целом и на его химическое поведение. Поэтому в распределении электронной плотности в молекулах монозамещѐнных бензолов и в реакционной способности этих веществ можно отметить много общего.
10.1.1. ЭЛЕКТРОННЫЕ ЭФФЕКТЫ ЗАМЕСТИТЕЛЕЙ
Индуктивные эффекты таких заместителей, как галогены, аминогруппа, гидроксильная и другие группы, будут действовать в направлении понижения электронной плотности ароматической системы, поскольку атомы, непосредственно связанные с кольцом, более электроотрицательны, чем углерод, с которым они связаны:

 X
X
450

С другой стороны, непосредственно связанные с кольцом атомы галогенов, кислорода или азота, содержат неподелѐнные пары электронов, которые могут взаимодействовать с делокализованными -электронами кольца, в результате чего возникает сопряжение -электронной системы ароматического фрагмента с р-орбиталью первого атома заместителя. Это можно показать при помощи резонансных структур:
:X |
+X |
+X |
+X |
X: |
|
- |
|
|
- |
|
|
|
|
|
|
|
- |
|
|
Для заместителей -OH, -OR, -NH2, -NR2 и т.д. величина электронодонорного мезомерного эффекта больше (по модулю) значения акцепторного индуктивного эффекта. Электронная плотность на кольце при этом возрастает. Такие
заместители являются в целом электронодонорами.
|
|
|
X '+ |
|
X |
|
- |
- |
|
-I |
+M > -I |
|||
|
|
|||
+M |
|
|
- |
|
|
|
|
Атомы галогенов, проявляющие такие же по направлению индуктивный и мезомерный эффекты по отношению к бензольному кольцу, напротив, являются в целом электроноакцепторами за счѐт бóльшего (по модулю) индуктивного эффекта по сравнению с мезомерным:
Hal -
Hal
-I |
+M < -I |
|
|
||
|
||
|
|
|
|
|
|
|
|
|
|
|
+M
Причины такого влияния атомов галогенов на бензольное кольцо изложены далее (гл. 10.2.2).
Однако если атом в заместителе, непосредственно соединѐнный с кольцом, связан кратной связью с ещѐ более электроотрицательным атомом, возникает сопряжение, приводящее к уменьшению электронной плотности кольца:
451

X=Y |
X-Y |
X-Y |
X-Y |
X=Y |
|
+ |
|
|
+ |
+
Это характерно для таких заместителей, как например -СHO, -COOH, -SO3H, -CN, -NO2. Индуктивный эффект, проявляемый этими заместителями,
— тоже акцепторный. Такие заместители являются в целом электроно-
акцепторами. Электронная плотность на кольце понижается:
|
X |
'- |
X=Y |
Y |
|
|
|
|
-I |
|
|
|
|
|
-M |
|
|
|
|
|
Таким образом, все заместители в бензольном кольце условно можно разделить на две большие группы: электронодоноры и электроноакцепторы.
Кроме перечисленных здесь к донорным заместителям относятся и алкильные радикалы в молекулах аренов. Но величина суммарного донорного эффекта (индуктивный эффект и эффект сверхсопряжения, как, например, в толуоле) невелика по сравнению с электронодонорным мезомерным эффектом, обусловленным р- -сопряжением таких групп, как например -OH, -NH2.
Таким образом, в порядке уменьшения суммарного электронного эффекта электронодоноры можно расположить в следующий ряд (приведены некоторые, наиболее типичные заместители):
-NH2 (-NHR, -NR2) > -OH (-OR) > -NHCOR > -R
Электроноакцепторные заместители также по-разному влияют на ароматическое кольцо, уменьшая электронную плотность на нѐм в разной степени. По силе акцепторного влияния такие заместители в бензольном кольце можно выстроить в следующий ряд:
-NR3+ > -NO2 > -CN > -SO3H > -CHO > -CRO > -COOH > -COOR > -CONH2
У галогенов, как акцепторных заместителей, имеются свои особенности влияния на распределение электронной плотности бензольного кольца, и в общий ряд акцепторов поэтому они не включены.
452

Относительную силу влияния заместителей можно ориентировочно определить по величине дипольного момента ароматического соединения, содержащего этот заместитель (табл. 10.1).
Таблица 10.1
Направление и величины дипольных моментов некоторых монозамещѐнных бензолов
Заместитель |
Дипольный |
Направление |
|||||
X |
момент , D |
|
диполя |
||||
-N(СH3)2 |
1.6 |
|
|
|
|
|
|
|
|
|
|
|
|
||
-OH |
1.6 |
|
|
|
|
X |
|
-NH2 |
1.5 |
|
|
|
|
||
|
|
|
|
|
|
||
-OCH3 |
1.2 |
|
|
|
|
|
|
-CH3 |
0.3 |
|
|
|
|
|
|
H |
0 |
|
|
|
|
|
|
-COOH |
1.0 |
|
|
|
|
|
|
-I |
1.3 |
|
|
|
|
|
|
-Br |
1.5 |
|
|
|
|
|
|
-Cl |
1.6 |
|
|
|
|
|
X |
-COOR |
1.9 |
|
|
|
|
||
|
|
|
|
|
|
||
-CHO |
2.8 |
|
|
|
|
|
|
|
|
|
|
|
|
||
-SO3H |
3.8 |
|
|
|
|
|
|
-CN |
3.9 |
|
|
|
|
|
|
-NO2 |
4.0 |
|
|
|
|
|
|
Для всех ароматических соединений должны быть характерны реак-
ции электрофильного замещения (SE). Заместители, обладающие донор-
ными или акцепторными электронными эффектами разной силы, могут облегчать взаимодействие с электрофилами или, наоборот, затруднять его, влияя, таким образом, на скорость реакции, а также на условия еѐ протекания и полноту превращения.
Кроме того, наличие в бензольном кольце акцепторных заместителей может привести к понижению электронной плотности на атомах углерода настолько, что становятся возможными и реакции нуклеофильного замещения (SN).
10.1.2. РЕАКЦИИ ЭЛЕКТРОФИЛЬНОГО ЗАМЕЩЕНИЯ
Взаимодействие монозамещѐнного бензола с электрофильной частицей должно протекать по механизму, рассмотренному на примере бензола
453

(гл. 9.5.1.1). Во всех этих случаях реакция электрофильного замещения бимолекулярна (в лимитирующей стадии принимает участие и субстрат, и электрофил), и, таким образом, для механизма можно применить обозначение SE2:
|
|
X |
H |
|
|
X |
|
|
|
|
|
|
E |
|
|
|
|
|
E |
|
|
|
|
|
|
+ |
|
|
|
о- |
|
|
|
|
|
+ |
|
||
|
|
|
|
- H |
|
|
|
X |
X |
X |
|
|
|
X |
|
E |
+ |
+ |
|
|
|
|
|
|
E |
+ |
H |
- H |
+ |
|
м- |
|
|
|
|
|
|||
|
|
|
|
|
E |
||
|
|
|
E |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
X |
|
|
|
X |
|
|
|
+ |
|
- H |
+ |
|
п- |
|
|
|
|
|
|
|
|
|
|
E |
H |
|
|
E |
|
Значительно реже встречается механизм мономолекулярного электрофильного замещения (SE1). Это, например механизм реакции декарбоксилирования — см далее (гл. 9.6, п.5). В том случае уходящая группа отщепляется до электрофильной атаки.
Как следует из приведѐнной схемы, в результате электрофильного замещения атома водорода в монозамещѐнных бензолах возможно образование трѐх изомерных продуктов реакции. Преимущественное направление замещения (о-, м- или п-) зависит от природы заместителя Х. Этот заместитель влияет не только на реакционную способность исходного вещества, но и на направление вступления электрофила Е. Поэтому все заместители по ориентирующему действию делят на две группы:
1)орто-пара-ориентанты (заместители I рода) и
2)мета-ориентанты (заместители II рода).
Ориентирующее действие заместителя зависит, прежде всего, от распределения электронной плотности в бензольном кольце под влиянием электронных эффектов этого заместителя.
Под влиянием донорных заместителей электронная плотность повышается в основном в орто- и пара-положениях ароматического кольца по отношению к заместителю, как было показано граничными структурами (см. выше). Поэтому все электронодонорные заместители направляют электро-
454
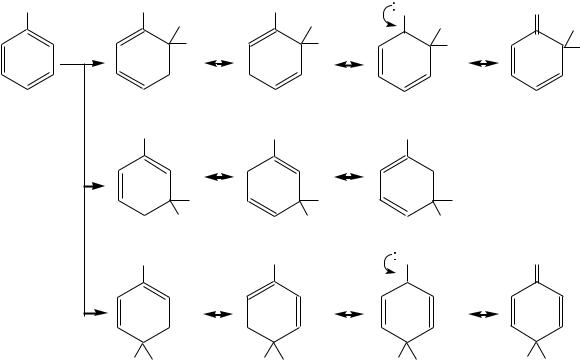
фильную частицу в орто- и пара-положения и являются заместителями I рода.
Ориентирующее направление заместителей I рода в о- и п-положения бензольного кольца может быть объяснено также сравнением устойчивости образующихся -комплексов. При образовании -связи между электрофилом и углеродным атомом, находящимся в орто-, мета- или пара-положении бензольного кольца, образуются соответственно три -комплекса, строение которых описывается следующими граничными структурами:
X |
X |
|
X |
|
|
+ |
|
X |
|
X |
|||
+ |
|
H |
H |
|
H |
H |
|
E |
E |
+ |
E |
E |
|
+ E |
|
|||||
|
|
|||||
|
|
+ |
+ |
|
|
|
|
X |
|
X |
X |
|
|
|
|
|
+ |
+ |
|
|
|
+ |
H |
H |
|
H |
|
|
|
E |
E |
|
E |
|
|
X |
|
X |
X |
|
+ |
|
|
|
X |
|||
|
|
|
|
+ |
|
|
|
|
+ |
+ |
|
|
|
H |
|
E |
H E |
H E |
|
H E |
В случаях вступления электрофила в о- и п-положения число граничных структур данных -комплексов больше, чем при вступлении электрофила в м-положение бензольного кольца (четыре против трѐх). Кроме того, среди о- и п-изомеров присутствуют такие структуры, в которых подчѐркивается участие неподелѐнной электронной пары первого атома заместителя в делокализации положительного заряда -комплекса, — это последние из изображѐнных в соответствующих рядах структур.
На ароматическом кольце галогенозамещѐнных бензолов электронная плотность понижена, но тем не менее галогены оказывают сильно выраженное орто- и пара-ориентирующее действие, и поэтому галогены тоже относятся к заместителям I рода, хотя и являются электроноакцепторами. Это явление рассматривается при обсуждении свойств арилгалогенидов (гл. 10.2.4.1), но может быть объяснено и динамическим подходом, как и для любого другого заместителя, проявляющего +М-эффект (см. выше).
455

Другие акцепторные заместители (кроме галогенов) проявляют –М- эффект по отношению к бензольному кольцу, и особенно сильное понижение электронной плотности наблюдается в орто- и пара-положениях к заместителю (показано граничными структурами). Поэтому электрофильная частица будет направляться преимущественно в мета-положение, где уменьшение электронной плотности почти не происходит. Таким образом, все электроноакцепторные заместители, за исключением галогенов, относятся к мета- ориентантам, или заместителям II рода.
С другой стороны, мета-ориентирующее действие групп, проявляющих –М-эффект, может быть объяснено и сравнением устойчивости образующихся -комплексов. В процессе электрофильного замещения атома водорода в молекуле замещѐнного бензола могут образоваться три изомерных-комплекса, строение которых описывается граничными структурами:
X |
X |
|
X |
X |
|
+ E+ |
|
H |
H |
|
H |
|
E |
E |
+ |
E |
|
|
|
+ |
+ |
|
|
|
X |
|
X |
X |
|
|
|
|
+ |
|
+ |
|
+ |
H |
H |
|
H |
|
|
E |
E |
|
E |
|
X |
|
X |
X |
|
|
|
|
|
+ |
|
|
|
+ |
+ |
|
|
H |
|
E |
H E |
H |
E |
Несмотря на то, что число граничных структур -комплексов при вступлении электрофила в орто-, мета- и пара-положения одинаково, -комплексы с электрофильной частицей в орто- и пара-положениях по отношению к заместителю менее устойчивы, так как одна из трѐх граничных структур в этих случаях сильно дестабилизирована за счѐт локализации положительного заряда на атоме углерода, связанном с заместителем. Эти граничные структуры изображены последними в соответствующих рядах.
Однако, рассматривая правила ориентации, нельзя забывать, что они определяют лишь преимущественное направление реакции замещения, то есть замещение идѐт в то или иное положение преобладающим образом, но
456

не исключительно. Обычно образуется смесь всех трѐх изомеров, но они находятся в соотношении, определяемом правилами ориентации.
На возможность преимущественного образования тех или иных изомеров помимо мезомерного эффекта заместителя влияют и другие факторы.
Индуктивный эффект
На соотношение продуктов орто- и пара-замещения может оказывать влияние и величина индуктивного эффекта заместителя. Особенно это характерно для таких заместителей, как -F и -OH, которые содержат атомы сильно электроотрицательных элементов, связанные с бензольным кольцом. В этих случаях за счѐт значительного –I-эффекта орто-положение дезактивируется, и, как результат, преобладает доля п-замещения.
Пространственный фактор Орто- и пара-положения в ароматическом кольце примерно одинаково
активированы +М-эффектом донорных заместителей, и по статистике должно получаться 67% орто- и 33% пара-изомеров, так как имеются два ор- то-положения и только одно пара-положение. Однако продукта пара- замещения часто получается больше. Это объясняется, главным образом, пространственными эффектами. Заместитель, находящийся в ароматическом кольце, экранирует орто-положения и мешает реагенту их атаковать. Пространственные препятствия проявляются тем сильнее, чем больше объѐм заместителя, связанного с ароматическим кольцом. Например, при нитровании аренов (гл. 9.5.2.1) получается следующее соотношение изомерных продуктов:
H3C |
|
|
|
|
|
|
|
|
|
|
+HNO3 |
H3C |
|
|
|
|
|
|
|
|
|
|
|
|
|
58% о-изомера |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4% м-изомера |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
- H2O |
|
|
|
|
|
|
|
|
|
|
|
NO2 |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
38% п-изомера |
|||||
H3C |
|
|
|
|
|
|
|
H3C |
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
+HNO3 |
|
|
|
|
|
|
|
|
|
|
|
30% о-изомера |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
H |
|
C |
|
|
|
|
|
|
|
|
H |
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
7.7% м-изомера |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
- H2O |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
H3C |
|
|
|
|
H3C |
|
|
|
|
|
|
|
|
|
NO2 |
62.3% п-изомера |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
H3C |
|
|
|
|
+HNO3 |
H3C |
|
|
15.8% о-изомера |
|||||||||||||||||||||||
|
|
|
|
|
||||||||||||||||||||||||||||
H3C C |
|
|
|
|
|
|
|
|
|
H3C |
C |
|
|
|
|
|
|
|
|
11.5% м-изомера |
||||||||||||
|
|
|
|
|
|
- H2O |
|
|
|
|||||||||||||||||||||||
H C |
|
|
|
|
H C |
|
|
|
|
|
|
|
|
|
|
NO2 |
72.7% п-изомера |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Размер электрофильной частицы также может влиять на соотношение орто- и пара-продуктов замещения. Так, при сульфировании электрофильная частица имеет больший размер, чем при нитровании, и поэтому сульфирование чаще всего приводит к образованию п-изомеров.
457

Электрофильная активность реагента оказывает прямое влияние на направление реакции замещения. Так, если электрофил обладает высокой энергией, то селективность реакции низкая; если же электрофильные свойства реагента выражены слабо, то в этом случае, как правило, селективность реакции высокая. Так, при взаимодействии толуола с бромом в присутствии AlBr3 образуется 33% о-изомера, 66.7% п-изомера и 0.3% м-изомера, при взаимодействии толуола с азотной кислотой — 58% о-изомера, 38% п-изомера и 4% м-изомера, а при взаимодействии этого же субстрата с серной кислотой — соответственно 32%, 62% и 6%.
10.1.3.РЕАКЦИИ НУКЛЕОФИЛЬНОГО ЗАМЕЩЕНИЯ
Вцелом монозамещѐнные бензолы по отношению к нуклеофильным реагентам очень мало реакционноспособны. Замещаемой группой в этих реакциях является группа X
X + :Y- |
Y + :X- |
|
, |
но возможно замещение и атома водорода — уходящей частицей тогда будет гидрид-ион Н¯.
X |
X |
|
Y |
+ :Y - |
+ :H - |
Во всех случаях нуклеофильное замещение протекает в достаточно жѐстких условиях и чаще всего только с сильными нуклеофилами (чаще всего это гидроксид- и амид-анионы). В ароматическом кольце должны быть акцепторные заместители, в противном случае замещение невозможно. Но даже при наличии акцепторных заместителей дополнительное введение сильного донора в кольцо (в общем случае) делает реакцию тоже невозможной. Алкильные группы как донорные заместители затрудняют реакцию, но не запрещают еѐ.
В зависимости от природы замещаемой группы X (а также от наличия дополнительных заместителей в кольце) нуклеофильное замещение может протекать по одному из следующих механизмов.
458

Ариновый механизм, или механизм отщепления-присоединения (ЕА):
X |
- |
|
|
|
|
|
+ :Y |
- HY |
H |
|
|
|
|
+ HY
|
X |
|
- |
: |
- X |
|
|
- |
|
дегидробензол
H

 Y
Y
Нуклеофильная атака по кольцу невозможна вследствие высокой-электронной плотности на нѐм, и нуклеофильная частица здесь играет роль основания, разрывая наиболее полярную С–H-связь.
Образующийся на первой стадии дегидробензол крайне неустойчив из-за высокого углового напряжения. Для углерода в sp-валентном состоянии характерны углы 180 , а не 120 , как в дегидробензоле, напоминающем изогнутый ацетилен. Вторая -связь в дегидробензоле имеет особое строение, она образована за счѐт бокового перекрывания sp2-гибридных орбиталей и очень непрочная.
Вболее общем случае, когда в реакцию вступает галогенопроизводное
салкильными заместителями в ароматическом кольце, на промежуточной стадии образуется ароматическое соединение с тройной связью в кольце —
арин:
X |
|
- |
|
+ |
:Y |
|
|
H |
|
- HY |
|
|
- X |
- |
|
R |
|
|
R |
арин,
поэтому и название механизма — ариновый.
Так как вторая стадия (присоединение нуклеофильного реагента) протекает быстро (и неселективно), то возможно образование двух изомерных продуктов примерно в равных количествах:
459
