
- •§ 1. Строение атома
- •Задачи
- •§ 2. Энергетика химических реакций
- •При протекании химических реакций обычно происходит разрыв химических связей и образование новых связей, кроме этого может происходить отрыв или присоединение электронов.
- •Задачи на энергетику химических процессов сводятся к тому, что нужно выразить процесс, энергия которого неизвестна, через комбинацию процессов, энергии которых известны.
- •Задачи
- •3.13*. Сколько заполненных и вакантных МО имеет молекула формальдегида СН2О?
- •Задачи
- •3.14. Какова ковалентность следующих атомов в основном и возбужденных состояниях: H, C, N, O, S, P, F, Cl, Mg, Al?
- •3.15. Изобразить энергетические диаграммы для валентных электронов углерода и кислорода, соответствующие ковалентности, равной нулю. Являются ли эти состояния атомов С и О возбужденными?
- •3.20*. Каково пространственное строение молекул NH2-CH2-CH3 и NH2-CH=CH2? Объяснить отличие направленности связей, которые образует атом азота в этих частицах.
- •3.21*. Отличается ли длина связи С=О в молекулах ацетальдегида и уксусной кислоты?
- •3.23*. Возможны ли изомеры для соединений состава CCl3F, [Zn(NH3)2Cl2], [Pt(NH3)2Cl2]?
- •3.25*. Димер Al2Cl6 и полимер (PdCl2)n имеют следующее строение:
- •Объяснить, почему Al находится в центре тетраэдра, а Pd – в центре квадрата из атомов хлора.
- •3.2.3. Дипольный момент молекул
- •Задачи
- •8.2. Кислотно-основные равновесия
- •основание 1 кислота 2 кислота 1 основание 2
- •8.2.1. Самоионизация (диссоциация) воды и шкала рН
- •Решение:
- •Приближения:
- •8.3. Равновесие между труднорастворимым соединением
- •ОТВЕТЫ
- •Приложение 1
- •Приложение 2
- •Формула кислоты
- •Формула кислоты
- •Основание по Бренстеду / сопряженная кислота
- •Основание по Аррениусу
- •Приложение 3
- •Приложение 4
- •Приложение 5
- •Стандартные электродные потенциалы для водных растворов
- •Элемент
3.9.Указать частицу с наибольшей энергией диссоциации в ряду
BeN, BN, N2, NO, NF.
3.10.Как будет изменяться энергия связи молекул NO, CO, F2 при присоединении или отрыве электрона?
3.11.Какие из следующих частиц парамагнитны: O2, N2, NO, NO+, NO−?
3.12*. Потенциалы ионизации Li и F равны 5,4 и 17,4 эВ соответственно. Изобразить диаграмму МО для молекулы LiF.
3.13*. Сколько заполненных и вакантных МО имеет молекула формальдегида СН2О?
3.2. Многоатомные частицы 3.2.1. Ковалентность атомов
Метод МО может быть применён и к многоатомным частицам, но это требует построения многоцентровых МО. Например, для молекулы СН4 надо описать восемь МО, образованных четырьмя 1s-AO атомов Н и четырьмя 2s и 2px, 2py, 2pz-АО атома С. Такой подход не является наглядным и оправдан лишь для количественного квантово-механического рассмотрения подобных систем. Для большого числа молекул можно ограничиться двухэлектронными связями, т. е. рассматривать МО изолированно для каждой химической связи.
При таком подходе число связей, которое может образовывать данный атом, равно числу неспаренных электронов. Это число неспаренных электронов называется ковалентностью.
В основном состоянии каждый атом характеризуется строго определённой ковалентностью. Например, ковалентность атомов Н, N, O, F равна 1, 3, 2, 1, что соответствует числу неспаренных электронов.
Число неспаренных электронов может увеличиться при переходе в возбуждённое состояние. Так, атом углерода в основном состоя-
33

нии образует две ковалентные связи (карбен: СН2). Для возбуждения атома С (С: 2 s22p2 → C*: 2s12p3) требуется энергия, которая компенсируется образованием дополнительных 2-х σ-связей (например, в устойчивой молекуле СН4). Это оказывается энергетически более выгодным, и в подавляющем большинстве химических соединений углерод образует 4 связи.
Необходимо отметить, что возбуждение электронов происходит без изменения главного квантового числа. Например, для гелия не получено ни одного соединения, т. к. для возбуждения Не 1s2 → He* 1s12s1 требуется энергия 19,8 эВ, которая не компенсируется образованием двух химических связей (при образовании одной σ-связи обычно выделяется энергия ~ 4–6 эВ).
Второй способ изменения ковалентности – удаление или приобретение атомом одного электрона. Например, N+, электронный аналог углерода, может проявлять ковалентность 4. Ион кислорода
О– – электронный аналог фтора и поэтому одноковалентен (например, ОН–).
В структурных формулах каждая ковалентная связь обозначается чёрточкой. Структурные формулы отражают и химический состав молекулы (количество атомов каждого элемента), и её строение (взаимное расположение атомов и то, как они связаны друг с другом).
H |
|
F Cl |
|
B |
Cl |
F |
F |
F |
H |
O |
|||||
|
|
|
|
||||||||||||
|
|
S |
|
S |
|
|
|
O |
|||||||
|
|
|
|
|
|
||||||||||
|
|
|
|
|
F |
|
|
||||||||
|
|
|
Cl |
F |
|
|
H |
O |
|||||||
|
|
|
|
|
|
|
F |
|
|
|
|
|
|
|
|
Рис. 7. Структурные формулы HF, BCl3, SF6, H2SO3
3.2.2. Пространственное строение многоатомных частиц
Пространственное строение (геометрическая форма) – это взаимное расположение атомов в многоатомной частице, характеризуемое длинами связей и валентными углами (углами между двумя связями).
Химические связи σ-типа обладают осевой симметрией, ось симметрии направлена вдоль линии связи. Поэтому углы между связями, образованными одним атомом, определяются взаимной ори-
34

ентацией его АО, электроны которых участвуют в образовании σ- связей.
Например, атомы трёхковалентного N и двухковалентного О образуют σ-связи с атомами Н за счёт электронов в 2р-состоянии. Известно, что оси трёх р-АО взаимно перпендикулярны. В соответствии с этим молекула NH3 имеет строение треугольной пирамиды, а Н2О – угловое строение, причём углы между σ-связями должны быть близки к 90о. Экспериментальные данные для NH3: 107,3o, а
для Н2О: 104,5о.
Для объяснения таких несоответствий между теорией и экспери-
ментом привлекаются представления о гибридизации атомных орбиталей.
Гибридные атомные орбитали (ГАО) – линейные комбинации атомных орбиталей, соответствующих нескольким различным значениям азимутального квантового числа.
Важнейшие типы ГАО и их взаимная ориентация
Тип |
Число гиб- |
Взаимная ориента- |
Геометрия |
гибридизации |
ридных ор- |
ция ГАО |
молекулы |
|
биталей |
|
|
sp |
2 |
|
линейная |
sp2 |
3 |
|
треугольник |
|
|
|
|
sp3 |
4 |
|
тетраэдр |
|
|
|
|
dsp2 |
4 |
|
квадрат |
|
|
|
|
35

dsp3 |
5 |
|
тригональная |
|
|
|
бипирамида |
|
|
|
|
d2sp3 |
6 |
|
октаэдр |
|
|
|
|
Как уже отмечалось, угловое строение Н2О и пирамидальное строение NH3 можно понять из взаимного расположения 2р-АО атомов N и О, на которых в свободных атомах находятся неспаренные электроны. Таким же образом можно объяснить угловое строение Н2S и пирамидальное строение РН3 – взаимным расположением 3р-АО атомов S и Р. Однако реальные углы между связями в молекулах Н2О и NH3 существенно ближе к соответствующему sp3-ГАО тетраэдрическому углу 109о. Тогда как экспериментальные углы между σ-связями в Н2S и РН3 составляют 92о и 94о соответственно, что существенно ближе к 90о, чем к тетраэдрическому. Поэтому можно полагать, что в образовании молекул NH3 и Н2О принимают участие неспаренные электроны на sp3-ГАО, а неподелённые пары электронов располагаются на оставшихся sp3-ГАО: одной – в случае N и двух – в случае О. Таким образом, для молекул NH3 и Н2О в образовании связей N и О с атомами Н участвуют три и две, соотве т- ственно, sp3-ГАО с неспаренными электронами, а вакантные одна и две, соответственно, sp3-ГАО принимают неподелённые пары электронов. Очевидно, что для объяснения углового строения Н2S и пирамидального строения РН3 не требуется привлечение представления о гибридизации и АО.
Механизм образования связи не влияет на тип гибридизации АО. Линейная молекула ВеCl2 может образоваться как из атомов Ве и двух атомов Cl, так и из ионов Ве2+ и 2 Cl–. В последнем случае ион Ве2+ (акцептор) предоставляет вакантные 2s- и 2р-АО, а ионы Cl– (доноры) – неподелённые пары электронов. Оба механизма приводят к одному и тому же sp-гибридному состоянию.
36

Рассмотрим примеры определения пространственного строения комплексных соединений, предварительно определив некоторые ос-
новные понятия.
Комплексное соединение состоит из центрального атома (ЦА) в определённой степени окисления, вокруг которого координированы нейтральные молекулы или ионы, называемые лигандами. Общее число σ-связей, образуемых ЦА с лигандами, называется координационным числом (КЧ) центрального атома.
Комплекс может быть нейтральным, а также положительным или отрицательным ионом в зависимости от зарядов ЦА и координированных лигандов. Поэтому в комплексных соединениях различают внутреннюю (или координационную) сферу, включающую ЦА и координированные лиганды, а также внешнюю сферу, образуемую противоионами.
Например, для комплексного соединения [Cu(NH3)4]SO4:
ЦА – Cu2+; лиганды – NH3; КЧ = 4; внутренняя сфера [ Cu(NH3)4]2+; внешняя сфера SO42–.
Строение комплексных соединений можно объяснить путём рассмотрения типа гибридных орбиталей центрального атома, участвующих в образовании σ-связей с лигандами. Обычно в комплексных соединениях реализуется донорно-акцепторный механизм образования связи. При этом ЦА (обычно ион переходного металла) предоставляет вакантные АО (акцептор электронов), а лиганд – неподелённые пары электронов (донор электронов).
Пример 3-4: Используя представления о ГАО, определить пространственное строение ионов [AuCl4]– и [PtCl4]2–.
Решение: В этих комплексах центральными атомами являются изоэлектронные ионы Au3+ и Pt2+, внешний электронный слой которых можно представить следующим образом:
Au3+ |
6s |
6p |
(Pt2+) |
|
5d
Можно было ожидать, что для образования связей должны использоваться 4 sp3-ГАО, т. е. комплекс должен быть тетраэдрическим. Но известно, что комплексы Au3+ и Pt2+ диамагнитны. Следо-
37

вательно, в образовании связей участвуют возбуждённые Au3+ и Pt2+ (для спаривания электронов затрачивается энергия, которая затем компенсируется выигрышем энергии при образовании химических связей):
Au*3+ |
|
6p |
|
(Pt*2+) |
6s |
||
|
|||
|
5d |
|
В образовании химических связей участвуют четыре dsp2-ГАО, которые комбинируются из вакантных одной 5d-, одной 6s- и двух 6p-АО и направлены к вершинам квадрата. Экспериментально установлено, что все комплексы Au3+ и Pt2+с КЧ = 4 имеют квадратное строение.
Центральные атомы, в которых в образовании связей с лиганда-
ми участвуют d2sp3-ГАО, образуют октаэдрические комплексы, например, Co3+ (ЭК: [Ar]3d6).
Co*3+ |
4s |
4p |
|
|
3d
Шесть d2sp3-ГАО комбинируются из вакантных двух 3d-, одной 4s- и трёх 4р-АО.
Примеры таких комплексов: [Co(NH3)6]3+ и [Pt(NH3)6]4+.
Для объяснения пространственного строения (геометрии) молекул существует ещё один подход – метод отталкивания ва-
лентных электронных пар (ОВЭП), основанный на модели от-
талкивания локализованных электронных пар (правила Гиллеспи):
1.Молекула принимает ту геометрическую структуру,
которая обеспечивает максимальное удаление электронных пар внешнего электронного слоя друг от друга, или иначе: минимум отталкивания валентных электронных пар.
38
2.Наиболее сильным является отталкивание неподелённых пар (НП), наиболее слабым – отталкивание электронных пар химических связей (СП), т. е. НП-НП > НП-СП > СП-СП (ряд уменьшения сил отталкивания).
3.Дополнение Найхольма:
Из нескольких возможных структур, включающих взаимодействия под углом 90о, наиболее энергетически выгодна структура, имеющая наименьшее число
взаимодействий под углом 90о с неподелённой парой.
Применение метода ОВЭП к конкретным многоатомным молекулам начинается с подсчёта числа НП центрального атома и числа связанных с ним атомов (СП). Сумма НП и СП называется стерическим числом (СЧ), т. е. СЧ = НП + СП.
Рассмотрим случаи, когда в молекуле типа АXn (А – центральный атом, X – связанные с ним атомы) нет НП (НП = 0).
Геометрическое строение молекул типа АXn
Молекула |
СЧ |
Геометрическое |
Пример |
|
|
строение |
|
АX2 |
2 |
линейная |
ВеCl2; CO2 |
АX3 |
3 |
треугольная |
BF3 |
AX4 |
4 |
тетраэдрическая |
CF4 |
АX5 |
5 |
тригонально- |
PF5 |
|
|
бипирамидальная |
|
AX6 |
6 |
октаэдрическая |
SF6 |
Алгоритм определения структуры молекулы согласно модели ОВЭП можно сформулировать следующим образом:
1.На основании формулы молекулы и возможных ковалентностей образующих ее атомов определить: центральный атом
(ЦА), количество валентных электронов ЦА (Nц), количество σ(nσ)- и π(nπ)-связей, которые образует ЦА.
2.Определить число связывающих пар: СП = nσ.
3.Определить число неподеленных пар: НП = (Nц − nσ − nπ)/2.
4.Определить стерическое число: СЧ = СП + НП. На основании принципов максимального отталкивания электронных пар предложить геометрию молекулы.
39
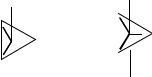
Пример 3-5: Определить геометрическое строение SO3.
Решение:
1. Центральный атом – сера, шесть валентных электронов (3s23p4); если учитывать, что ковалентность атома кислорода равна
двум, атом серы должен образовать три σ- и три π-связи.
2.СП = 3.
3.НП = (6 − 3 − 3)/2 = 0.
4.CЧ = 3 + 0 = 3.
Следовательно, молекула SO3 относится к типу AB3, геометрия молекулы – треугольник (атом серы в середине треугольника).
Внимание, вопрос – почему π-связи не учитываются при оп-
ределении СП?
Пример 3-6: Определить геометрическое строение молекулы
SF4Решение. :
1. Центральный атом – сера, шесть валентных электронов. Учитывая, что ковалентность атома фтора равна единице, атом серы должен образовать 4 σ-связи.
2.СП = 4.
3.НП = (6 − 4 − 3)/2 = 1.
4.CЧ = 4 + 1 = 5.
Молекула SF4 относится к типу АВ4Е. Все электронные пары направлены к вершинам тригональной бипирамиды, но для определения реальной геометрии необходимо сделать выбор из двух возможных структур:
a) |
|
F |
б) |
F |
|
F |
||
F |
|
S |
F |
|||||
|
S : |
|
|
|||||
|
|
|
||||||
|
|
|
|
|
||||
|
F |
|
|
F |
|
|||
|
|
|
||||||
|
|
|
.. |
|
||||
|
|
|
|
|
|
|||
|
|
F |
|
|
|
|
|
|
Число взаимодействий |
|
|
|
|
|
|
|
|
НП-СП под углом 90о: |
2 |
|
3 |
|
||||
|
40 |
|
|
|
|
|
||

В соответствии с дополнением Найхольма наиболее устойчивой является структура а). Геометрическая форма SF4 – бисфеноид, «ходули».
Варианты расположения заместителей и неподеленных пар согласно методу ОВЭП в молекулах с СЧ = 3 и больше показаны на рис. 8.
Рис. 8. Расположение электронных пар ЦА по Гиллеспи
Сопряжение – явление выравнивания электронной плотности в случае возникновения единой системы многоцентровых π-орбиталей, как, например, в соединениях с сопряжёнными кратными связями. Это явление имеет важное значение особенно в органической химии. Для сопряжения существенно, чтобы кратные связи были разделены простой связью, а формирующие их р- орбитали располагались параллельно. В этом случае можно говорить о ππ-сопряжении. Этот тип сопряжения реализуется в молекулах бензола и бутадиена. В молекуле бензола происходит полная делокализация электронов π-связей по кольцу углеродных атомов (все связи «полуторные»):
41

Вслучае бутадиена СН2=СН–СН=СН2 полного выравнивания электронной плотности между четырьмя атомами углерода не происходит.
Вобразовании π-орбиталей могут принимать участие р-орбитали, содержащие неподелённую пару электронов.
Сопряжение, в котором участвуют π-связи и р-орбитали с неподелённой парой электронов, называют рπ-сопряжением.
Рассмотрим в качестве примера уксусную кислоту (а) и анион уксусной кислоты (б):
|
O1 |
|
O |
|
|
|
|
CH3 |
C |
|
CH3 C |
|
O2 |
H |
O |
|
|
|
|
|
(а) |
|
(б) |
Вуксусной кислоте (а) у атома О2 имеется неподелённая пара 2р-электронов, и два других 2р-электрона участвуют в образовании
σ-связей с атомами С и Н.
Если 2р-орбиталь атома О2, занятая неподелённой парой электронов, ориентирована параллельно π-орбитали, образующей связь
С=О, то возникает единая система, т. е. три 2р-орбитали атомов С, О1 и О2 образуют три π-орбитали, на которых находятся четыре электрона.
Ванионе уксусной кислоты (б) атомы О эквивалентны и образуют единую систему из трёх π-орбиталей, на которых расположено четыре электрона.
Участие в рπ-сопряжении особенно характерно для АО двух элементов – О и N. Атом N имеет неподелённую пару 2s-электронов, которая не может участвовать в сопряжении. Однако для N имеется возможность рπ-сопряжения при возбуждении N:
N:2s22p3 → N*: 2s12p4
Например, в амиде уксусной кислоты
42

O
CH3 C
 NH2
NH2
в образовании 3-х σ-связей атома N* участвуют электроны на 3-х ГАО типа sp2 (плоское строение), а ещё одна р-АО атома с неподелённой парой электронов N участвует в рπ-сопряжении с π-связью С=О.
В заключение сравним строение молекул азотистой (а) и азотной (б) кислот:
|
|
|
|
|
|
|
|
|
|
|
O |
|
H |
|
O |
|
N |
|
O |
+ |
|
||||
|
|
|
H |
|
O |
|
N |
- |
||||
|
|
|
||||||||||
|
|
|
|
|
||||||||
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
(a) |
|
|
|
(б) |
|||||||
Вмолекуле HNO2 (a) атом N образует две σ-связи за счёт двух 2р-электронов и одну π-связь за счёт 2р-электронов атомов N и О. Строение иона NO2– – угловое.
Вмолекуле НNO3 (б) атом N может образовать только три связи
стремя атомами О, но при этом не соблюдаются значения кова-
лентности атомов О. Можно предположить, что в образовании связей с атомами О участвует N+(2s12p3), который образует три σ-связи типа sp2 и одну π-связь за счёт 2р-электронов N+ и О.
O
HO N+
 O-
O-
Кроме того, происходит рπ-сопряжение, т. е. выравнивание электронной плотности за счёт образования четырёхцентровых МО (N+
и3-х атомов О). Отметим, что в сопряжении участвует и атом О
гидроксигруппы.
Если рассмотреть строение NO3–, то он имеет плоское строение,
иэлектронная плотность равномерно распределена по всем связям
N–O.
43
