
Замараев - часть 3
.pdfВ соответствии с данными разд. 2.1.2 (случай «б») имеем следующие выражения для скорости расходования веществ A
и Bадс :
|
|
dCA |
= - kS × |
So |
|
× CA × qB , |
|
||||||
|
|
dt |
V |
|
|||||||||
|
|
|
|
|
|
|
|
|
|||||
|
|
dqB |
= - k2 ×CA × qB , |
|
|||||||||
|
|
|
|
|
|||||||||
|
|
dt |
|
|
|
|
|
|
|
|
|
||
где |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
kS = k1 × l * , |
|
||||||||
|
|
k2 = kS × sB* = k1 ×V * . |
|
||||||||||
Очевидно, что |
|
|
|
|
|
|
|
|
|
||||
|
dCP |
= - |
dCA |
= kS × |
|
So |
×CA × qB . |
(6.68) |
|||||
|
|
|
|
||||||||||
|
dt |
|
dt |
|
V |
|
|||||||
в) Бимолекулярная реакция в адсорбционном слое |
|
||||||||||||
Такая реакция имеет вид |
|
|
|
|
|||||||||
|
|
|
Aадс + Bадс ¾¾® P . |
(6.69) |
|||||||||
В соответствии с данными разд. 2.1.2 (случай «в») имеем
следующее выражения для скорости расходования веществ
Aадс и Bадс :
|
dqA = dqB = - k |
θ × q |
|
× q , |
(2.9) |
||||
|
dt |
|
dt |
|
2 |
|
A |
B |
|
где константа скорости |
|
|
|
|
|
|
|
||
k2θ = k2S ×Co = k1 × s * ×Co . |
|
||||||||
В последнем выражении |
C = No |
|
– поверхностная концен- |
||||||
|
|
|
o |
So |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
трация центров адсорбции.
6.Кинетика гетерогенных каталитических реакций
вусловиях адсорбционного равновесия
48

Пусть скорость гетерогенной каталитической реакции ли- митируется химической реакцией на поверхности, а стадии адсорбции и десорбции являются равновесными.
В условиях адсорбционного равновесия величины qA, qB и q P покрытия поверхности адсорбированными формами реаген- тов Aадс, Bадс и продукта Pадс можно выразить через изотермы Лэнгмюра. Рассмотрим выражения для скорости гетеро- генных каталитических реакций, получаемые в этих условиях, для некоторых практически важных случаев.
Случай 1. Мономолекулярная реакция на поверхности
Схема реакции:
|
|
|
быстро |
|
медленно |
|
|
быстро |
|
|
|
|
|
|
|||||||||
A + s |
Aадс |
Радс |
P + s . |
(6.70) |
|||||||||||||||||||
|
|
|
|
k1 |
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
Скорость реакции: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
W = W1 = k1 |
× qA = k1 × |
|
Kадс(A) |
×CA |
|
|
|
|
. |
(6.71) |
|||||||||
|
|
|
|
1+ K(A) |
|
×C |
A |
+ K(P) |
× C |
||||||||||||||
|
|
|
|
|
|
|
|
|
адс |
|
|
|
|
|
|
адс |
|
P |
|
||||
Рассмотрим предельные случаи:
1. Продукт P не адсорбируется, реагент A адсорбируется
слабо, т. е. |
|
|
|
|
|
Kадс(P) |
= 0 , |
Kадс(A) ×CA |
<< 1. |
(6.72) |
|
Тогда |
|
|
|
|
|
|
W = k1 × Kадс(A) |
×CA . |
|
(6.73) |
|
Реакция имеет первый порядок по реагенту A. |
|
||||
Энергия активации |
|
|
|
|
|
|
E = E + DH(A) . |
|
(6.74) |
||
|
|
1 |
адс |
|
|
Так как DH(A) < 0 , |
то |
E < E . |
|
|
|
адс |
|
1 |
|
|
|
В принципе, возможна ситуация, когда |
- DH(A) |
> E . |
|||
|
|
|
|
адс |
1 |
49

В этих условиях получаем E < 0, т. е. наблюдаемая ско-
рость гетерогенной каталитической реакции уменьшается при повышении температуры. Физический смысл этого явле- ния состоит в том, что с ростом T концентрация адсорбиро-
ванных молекул A, равная K(A)адс ×CA , уменьшается быстрее, чем растет константа скорости k1 .
2. Продукт реакции P не адсорбируется, реагент A адсор- бируется сильно, т. е.
C |
×K(P) |
= 0 , |
K(A) |
×C |
A |
>> 1. |
(6.75) |
P |
адс |
|
адс |
|
|
|
|
В этом случае |
|
|
|
|
|
|
|
|
|
|
W = k1 , |
|
|
|
(6.76) |
т. е. реакция имеет нулевой порядок по реагенту A.
3. Реагент A адсорбируется значительно более слабо, чем
продукт P, а P адсорбируется сильно, т. е. |
|
|
|||||||||
K(A) |
×C |
A |
<< K(P) |
×C , |
K(P) |
×C >> 1. |
(6.77) |
||||
адс |
|
адс |
|
|
P |
|
адс |
P |
|
||
В этом случае |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
K(A) |
×C |
A |
|
|
|
|
|
|
W = k |
1 |
× |
адс |
|
, |
|
(6.78) |
|
|
|
|
K(P) |
|
|
|
|||||
|
|
|
|
|
×C |
|
|
||||
|
|
|
|
|
|
адс |
|
P |
|
|
|
т. е. реакция имеет первый порядок по реагенту A и минус пер- вый порядок по продукту P.
Случай 2. Бимолекулярная реакция в адсорбционном слое. Схема реакции:
A + |
|
|
|
быстро |
|
|
Aадс, |
|
|||||
s |
|
||||||||||||
|
|
|
|
|
|
||||||||
|
быстро |
|
|
|
|||||||||
B + |
|
|
|
|
Вадс, |
|
|||||||
s |
(6.79) |
||||||||||||
|
|
|
|
|
|
||||||||
|
|
медленно |
|||||||||||
Аадс + Вадс |
Радс, |
||||||||||||
|
k2θ |
|
|||||||||||
Радс |
быстро |
|
P + |
|
. |
|
|||||||
|
s |
|
|||||||||||
|
|
|
|
|
|||||||||
|
|
|
|
|
|||||||||
50
Скорость реакции
|
|
K(A) |
×K(B) |
× C |
A |
×C |
|
|
||
W = k2θ × qA × qB = k2θ × |
|
адс |
адс |
|
B |
|
. (6.80) |
|||
(1+ K(A) |
×C |
A |
+ K(B) |
×C |
+ K(P) |
× C )2 |
||||
|
адс |
|
|
адс |
|
B |
адс |
P |
||
Рассмотрим предельные случаи.
1. Реагенты A и B адсорбируются слабо, а продукт P не ад-
сорбируется, т. е. |
|
|
|
|
|
|
|
|
|
||
K(A) |
×C |
A |
<< 1, |
K(B) ×C |
B |
<< 1, |
K(P) |
×C = 0 . (6.81) |
|||
адс |
|
|
адс |
|
|
|
|
адс |
P |
||
Тогда |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
W = k |
θ ×K(A) |
×K(B) |
×C |
A |
×C . |
(6.82) |
||
|
|
|
2 |
адс |
|
|
адс |
|
B |
|
|
Реакция имеет первый порядок по каждому из реагентов.
2. Реагент A адсорбируется сильно, а реагент B и продукт
P адсорбируются много слабее, чем A, т. е. |
|
|
|||||||||||||
K(A) |
×C |
A |
>> 1, |
K(A) |
×C |
A |
>> K |
(B) × C |
B |
, K(P) |
×C . |
(6.83) |
|||
адс |
|
|
адс |
|
|
адс |
|
|
адс |
P |
|
||||
Тогда |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
K(B) |
×C |
B |
|
|
|
|
|
|
|
|
|
W = k2θ × |
|
адс |
|
|
. |
|
(6.84) |
|||
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
K(A)адс ×CA |
|
|
||||
Реакция имеет первый порядок по реагенту B и минус первый порядок по веществу A. Физический смысл этого эффекта со- стоит в том, что реагент A «отравляет» катализатор путем вытеснения с его поверхности второго реагента B.
3. Реагенты A и B адсорбируются значительно более сла- бо, чем продукт P, а продукт P адсорбируется сильно, т. е.
K(A) |
×C |
A |
, |
K(B) |
×C |
B |
<< |
K(P) |
|
×C |
P |
||||
адс |
|
|
адс |
|
|
|
|
адс |
|
|
|||||
и |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
K(P) |
×C |
|
>> 1. |
|
|
|
|
|
(6.85) |
||
Тогда |
|
|
|
адс |
P |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
K(A) |
×K(B) |
×C |
A |
×C |
B |
|
|
|||
|
W = k2θ × |
|
адс |
|
адс |
|
|
. |
(6.86) |
||||||
|
|
(K(P) ×C )2 |
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
адс |
P |
|
|
|
|
|
|
51
Реакция имеет первый порядок по каждому из реагентов и минус второй порядок по продукту. Продукт «отравляет» ката- лизатор путем вытеснения с его поверхности реагентов A и B.
6.5.8. Автокаталитические реакции
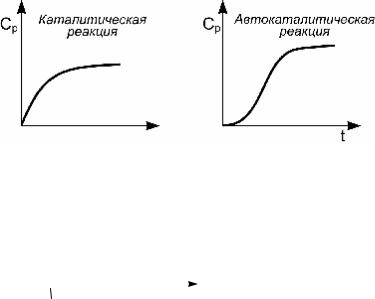
Автокатализом называется явление, состоящее в катали- тическом действии на реакцию какого-либо из ее продуктов.
Для обычных каталитических реакций скорость макси- мальна в начальный момент времени t = 0 . С ростом t она убывает вследствие расходования реагентов. Для автоката- литических реакций скорость вначале возрастает с ростом t вследствие образования все большего количества катализа- тора. Лишь на более поздней стадии она начинает умень- шаться вследствие уменьшения концентрации реагентов. Ка-
чественное различие между ходом кинетических кривых для обычной каталитической и автокаталитической реакций пока- зано на рис. 6.12.
Рис. 6.12. Качественное различие между ходом кинетических кривых
для обычной каталитической и автокаталитической реакций
Как видно из рисунка, кинетическая кривая для накопления продукта реакции P в случае автокаталитической реакции имеет S-образный вид.
Пример. Иодирование ацетона
1) CH3CCH3 |
k |
CH3C |
|
CH2 |
||||
|
|
|
||||||
|
|
|
||||||
медленно |
||||||||
|
|
|
|
|
|
|||
O |
|
|
OH |
|||||
52

2) CH3C |
|
CH2 |
+ I2 |
|
CH CCH I + H+ + I– |
|
|
|
|||||
|
быстро |
|||||
OH |
|
3 |
2 |
|||
|
|
O |
||||
Лимитирующая стадия 1 катализируется ионом H+.
Рассмотрим простейшую автокаталитическую реакцию
|
|
A ¾¾® B , |
(6.87) |
||
для которой |
|
|
|
|
|
|
dCB |
= k ×C |
×C |
|
|
|
|
|
|||
|
dt |
|
A |
B |
|
|
|
|
|
|
|
и при t = 0 CA = a , CB = b .
Обозначим x = CB - b = a - CA .
Тогда кинетическое уравнение принимает вид
dx |
= k× (a - x) ×(b + x) Þ |
dx |
|||
dt |
dt |
||||
|
|
||||
|
|
ß |
|
|
|
|
x |
dx |
|
|
|
|
òo |
|
|
||
|
(x - a) × (x + b) |
||||
|
14424443 |
|
|||
I
Напомним, что
= - k×(x - a) × (x + b) ; (6.88)
t |
|
= - kòdt . |
(6.89) |
o
ò |
Q(x) |
dx = ò |
Q(x) |
|
dx = ò |
A |
dx + ò |
B |
|
|
|
|
|
dx , |
|||||
P(x) |
(x - a) × (x - b) |
x - a |
x - b |
||||||
|
|
1442443 |
|
|
|
|
|
||
|
|
|
P(x) |
|
|
|
|
|
|
где |
|
|
|
|
|
|
|
|
|
|
|
|
Q(a) |
|
|
Q(b) |
|
|
|
|
|
|
A = ¢ |
, |
B = |
¢ |
. |
|
|
|
|
|
P (a) |
|
|
P (b) |
|
|
|
В нашем случае
α = a , β = − b , Q(a) = Q(b) =1 , P′(x) = b + x + x - a = 2x + b - a , P′(a) = 2a + b - a = a + b ,
53
|
P′(b) = - 2b + b - a = - (a + b) , |
|
|
|
||||||||||||||||||||
|
|
A = |
1 |
|
, |
|
B = - |
|
|
1 |
. |
|
|
|
|
|
||||||||
|
|
a + b |
a + b |
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Тогда |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
I = |
1 |
òx |
|
dx |
- |
1 |
|
òx |
dx |
= |
|
|
|
|
|||||||||
|
a + b |
|
x - a |
a + b |
x + b |
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
o |
|
|
|
|
|
|
|
o |
|
|
|
|
|
|
|
|
|
|
|
1 |
é |
|
x - a |
|
|
|
x + b ù |
|
|
1 |
|
|
|
a - x |
|
b |
|
||||||
= |
|
× êln |
|
|
|
|
- ln |
|
|
|
ú = |
|
|
|
|
×ln |
|
× |
|
. (6.90) |
||||
a + b |
- a |
|
b |
a + b |
b + x |
a |
||||||||||||||||||
|
ë |
|
|
|
|
û |
|
|
|
|
|
|||||||||||||
При этом наше кинетическое уравнение
|
|
I = - k òt |
dt |
|
|
|
|
|
|
|
|
|
o |
|
|
|
|
|
|
принимает вид |
|
|
|
|
|
|
|
|
|
|
|
æ b + x |
|
a ö |
|||||
k ×(a + b)× t = ln ç |
|
|
× |
|
÷ , |
|
|
||
|
|
|
|||||||
|
|
è a - x |
|
b ø |
|||||
|
|
ß |
|
|
|
|
|
|
|
|
|
|
|
||||||
|
x = |
b {exp [k ×(a + b)× t ]- 1} |
. |
||||||
|
1+ b exp [k ×(a + b)× t ] |
|
|||||||
|
|
a |
|
|
|
|
|
|
|
(6.91)
(6.92)
Введем безразмерные переменные
x |
= x , |
t ×k × a = t , |
b |
= xo . |
(6.93) |
|
a |
a |
|||||
|
|
|
|
Тогда дифференциальное кинетическое уравнение принима-
ет вид
dx |
= (1- x)×(xo + x) , |
(6.94) |
|
dt |
|||
|
|
а интегральное кинетическое уравнение принимает вид
54
|
x = |
x |
o |
[e(1+xo )×t -1] |
. |
(6.95) |
||
|
|
|
|
(1+xo )×t |
|
|||
|
|
1+ xo × e |
|
|
||||
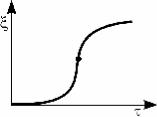
S–образная кинетическая кривая для x |
представлена на |
|||||||
рис. 6.13. |
|
|
|
|
|
|
|
|
|
Рис. 6.13. S-образная кинетическая кривая для |
|||||||
|
автокаталитической |
реакции A ¾¾® B |
||||||
|
( ξ = x / a |
– безразмерный параметр) |
||||||
Характерными особенностями этой кривой являются нали- чие периода индукции, в течение которого скорость реакции практически равна нулю, и точки перегиба. Наличие периода
индукции обусловлено чрезвычайно медленной начальной скоростью реакции при малых xo , т. е. малых начальных кон-
центрациях B. Наличие точки перегиба отражает борьбу двух тенденций: ускорение реакции во времени из-за накопления ка- тализатора B и ее замедление из-за расходования реагента A.
Положение точки перегиба ищем из условия
|
|
|
|
|
|
|
|
|
d2x |
|
|
d æ dx ö |
|
d æ dx ö |
dx |
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
= 0 , |
|
|
ç |
|
|
|
÷ = |
|
|
|
|
ç |
|
|
÷ × |
|
. |
|
|
(6.96) |
|
|
|
|
|
|
|
|
|
dt2 |
|
|
dtè dt ø |
dxè dt ø |
dt |
|
|
|
|
||||||||||||||
Но |
|
dx |
> 0 |
на всем протяжении процесса. Следовательно, |
||||||||||||||||||||||||||||
|
dt |
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
условие точки перегиба принимает вид |
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
d æ dx ö |
= |
d |
(1 |
- x)× (xo + x) |
= (1- x) |
dx |
|
- (xo + x) |
dx |
= 0 |
, |
||||||||||||||||||||
|
|
ç |
|
|
÷ |
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
dx |
dt |
|
dt |
||||||||||||||||||||||||||
|
dxè dt ø |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
1- x - xo - x = 0 , |
|
|
1- xo - 2x = 0 , |
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
x = |
|
1- xo |
|
. |
|
|
|
|
|
|
|
|
|
(6.97) |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
55
При малых xo |
|
|
|
|
|
|
x » |
1 |
|
, |
(6.98) |
|
2 |
|
|||
т. е. точка перегиба соответствует моменту времени, когда половина исходного вещества превратилась в продукт.
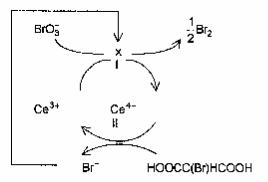
К автокаталитическим реакциям можно условно отнести и автоколебательные реакции. Первая автоколебательная ре- акция – катализируемое ионами церия окисление лимонной кислоты броматом калия – была открыта Б. П. Белоусовым в 1951 г. К настоящему времени открыто значительное количе- ство подобных систем; предполагается, что существование автоколебательных реакций частично объясняет периодич- ность функционирования живых организмов. Недавно были также обнаружены колебания в ходе многих гетерогенных ка- талитических реакций, в частности окисления СО на платине.
Возникновение колебательного режима протекания реак- ции требует присутствия в схеме реакции хотя бы одной авто- каталитической стадии. Например, в реакции окисления броммалоновой кислоты броматом калия такой стадией яв- ляется автоускорение восстановления бромата под действи-
ем Br− (рис. 6.14).
Рис. 6.14. Реакция Белоусова–Жаботинского
Наиболее простой механизм для реакции A ¾¾® F , при- водящий к осцилляциям, выглядит следующим образом:
56

A + x1 ¾¾®k1 2x1, x1 +x2 ¾¾k2 ® 2x2 , x2 ¾¾k3 ® F .
Это схема Лотки–Вольтерра, используемая для объясне- ния колебания популяций, например, зайцев Cx1 и волков
Cx2 . Ее отличие от всех ранее рассмотренных схем состоит в
том, что здесь, при некоторых значениях параметров не су-
ществует устойчивого стационарного состояния, т. е. в
системе обязательно будут возникать колебания Cx1 и Cx2 ,
даже если поддерживать концентрации СА и СF постоянными.
Рассмотрим метод анализа стационарного состояния на устойчивость.
Напишем кинетические уравнения для промежуточных реа- гентов:
dCdtx1 = k1CACx1 - k2Cx1Cx2 ,
dCx |
(6.99) |
|
= k2Cx1Cx2 - k3Cx2 . |
||
2 |
||
dt |
||
|
Предположим, что концентрации А и F изменяются мало в ходе реакции, тогда стационарная точка (т. е. стационарное состояние) системы определяется системой уравнений
ì0 = k1CACx1 - k2Cx1Cx2 , |
||||||
í0 = k C |
C |
x2 |
- k |
C |
, |
|
î |
2 x1 |
|
3 |
|
x2 |
|
имеющей единственное решение
|
= k3 , |
|
= |
k1CA |
. |
||
C |
C |
||||||
|
|||||||
x1 |
k2 |
x2 |
k2 |
||||
|
|
|
|
||||
(6.100)
(6.101)
Идеальная система может оставаться в этом состоянии неоп- ределенно долго, однако в реальных системах всегда суще- ствуют флуктуации, выводящие из состояния равновесия. Ес-
57
