
Замараев - часть 3
.pdf
n = Wjo × (1- e− ϕ t ) .
Видно, что в согласии с данными разд. 2.2.3, концентрация n стремится при t → ∞ к стационарному значению
n = Wjo .
Характеристическое время достижения этого стационарного значения равняется
t = 1j = g1- f .
В этом случае разветвленная цепная реакция кинетически ве- дет себя так же, как и неразветвленная цепная реакция.
Принципиально иная картина наблюдается, если ϕ > 0, т. е.
разветвление цепи преобладает над обрывом цепи. В этом случае концентрация активных центров n и, следова- тельно, скорость реакции экспоненциально растет во времени. При достаточно больших значениях ϕ этот рост настолько
быстр, что процесс воспринимается как самовоспламенение или взрыв. При достаточно хорошем теплоотводе этот взрыв будет идти в изотермическом режиме. При этом температура системы может быть весьма низкой для процесса взрыва, на- пример, несколько сотен градусов Цельсия. Явление самовос- пламенения реакции, обусловленное ее протеканием по раз- ветвленному цепному механизму, получило название цепного самовоспламенения.
Если ϕ = 0 , то
dn |
= W , |
¾¾® n = W × t . |
|
||
dt |
o |
o |
|
|
Зависимости n от t для трех рассмотренных случаев графи- чески изображены на рис. 7.1.
Из рисунка видно, что прямая, отвечающая ϕ = 0 , разделя- ет области стационарного и нестационарного протекания ре-
87
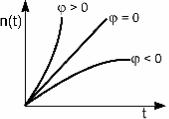
акции. Условие ϕ = 0 является условием предела самовос- пламенения.
Рис. 7.1. Зависимости концентрации n активного центра, ведущего реакцию, от времени для трех случаев соотноше-
ния факторов разветвления и обрыва цепи
7.2.4. Нижний и верхний пределы самовоспламенения.
Полуостров самовоспламенения |
|
Вернемся к реакции окисления H2. Для этой реакции |
|
j = f - g = 2 k2×CO2 - (k4 + k5× CO2 × CM ) |
(7.44) |
и условие предела самовоспламенения имеет вид |
|
j = 2 k2×CO2 - (k4 + k5× CO2 ×CM )= 0 . |
(7.45) |
A. Нижний и верхний пределы самовоспламенения |
|
В области низких давлений, определяемой из условия |
|
k4 >> k5×CO2 ×CM , |
(7.46) |
это уравнение для ϕ принимает вид |
|
j = 2 k2× CO2 - k4 = 0 . |
(7.47) |
В области высоких давлений, определяемой из условия |
|
k5×CO2 ×CM >> k4 , |
(7.48) |
уравнение ϕ = 0 принимает вид |
|
j = 2 k2×CO2 - k5× CO2 ×CM = 0 , |
|
ß |
|
2 k2 - k5× CM = 0 . |
(7.49) |
88
Таким образом, должны наблюдаться два предела само- воспламенения:
Первый предел наблюдается при низких давлениях, ко-
∙
гда скорость обрыва определяется гибелью атомов H на стенке реакционного сосуда (стадия 4 с константой скорости k4 ). Критическая концентрация CO2 , соответствующая этому
пределу, равняется
C(1) = |
k4 |
. |
(7.50) |
|
|||
O2 |
2 k2 |
|
|
|
|
||
Предел, условие которого задается последним уравнением,
называют нижним пределом самовоспламенения.
|
(1) |
Очевидно, что при CO2 < CO2 будет выполняться условие |
|
|
j = 2 k2× CO2 - k4 < 0, |
т. е. самовоспламенения не произойдет. |
|
(1) |
, напротив, будет выполняться условие |
При CO2 > CO2 |
|
j = 2 k2× CO2 - k4 > 0,
т. е. произойдет самовоспламенение.
Второй предел наблюдается при высоких давлениях, ко-
гда скорость обрыва цепи определяется реакцией гибели ато-
∙
мов H в объеме реакционной смеси (стадия 5 с константой
скорости k5 ). Критическую концентрацию C(2) , соответствую-
O2
щую этому пределу, можно найти из соотношений
|
|
C(2) |
= 2 k2 ; |
|
|
|
(7.51) |
|
|
|
M |
k5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(2) |
(2) |
|
(2) |
|
2 k2 |
|
|
C |
O2 |
= g × C , |
Þ C |
O2 |
= g × |
|
. |
(7.52) |
|
||||||||
|
M |
|
|
k5 |
|
|
||
|
|
|
|
|
|
|
|
|
В этих уравнениях C(M2) – критическое значение общей концен- трации частиц всех видов, имеющихся в системе
89

CM = CO2 + CH2 + CM′ ,
где M′ – молекулы, отличные от молекул H2 и O2, которые мо- гут быть добавлены в систему, g – мольная доля O2 в системе.
Предел, условие которого задается последним соотноше-
нием, называют верхним пределом самовоспламенения.
Б. Полуостров самовоспламенения
Среди констант скорости k2, k4 и k5, входящих в условия
нижнего предела
C(1) = k4 |
|
O2 |
2 k2 |
|
|
и верхнего предела
C(2) = 2 k2 × g ,
O2 k5
наиболее сильно изменяется с температурой константа k2. Это
∙
обусловлено тем, что реакции 4 и 5 гибели атомов H являют- ся экзотермическими, в то время как реакция 2 эндотермиче- ская. Действительно, тепловой эффект реакции 2
Q = - DH2 = DOH(O -H) - DO2 (O = O) = –71 кДж / моль.
Вследствие того что
E2 > E4 и E2 > E5,
при повышении T нижний предел самовоспламенения
(1) |
|
k(o)4 |
|
|
(E2 −E4 ) / RT |
||
CO2 = |
|
|
× e |
|
|
||
2 k(2o) |
|
|
|||||
будет понижаться, а верхний предел |
|||||||
(2) |
|
2 k2(o) |
|
|
|
−(E2 −E4 ) /RT |
|
CO2 = g × |
|
× e |
|
||||
k(5o) |
|
||||||
– повышаться. При некоторой температуре TM нижний и верх- ний пределы сливаются.
90
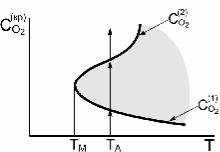
Зависимость между критической концентрацией кислорода
C(кр) и температурой T графически изображена на рис. 7.2.
O2
Область, ограниченную кривыми C(1) |
= f(1)(T) и C(2) = f(2)(T) , |
O2 |
O2 |
называют полуостровом самовоспламенения (на рисунке эта область заштрихована). Крайнюю левую точку полуостро- ва самовоспламенения (температура TM) называют мысом самовоспламенения.
Рис. 7.2. Зависимость между критической концентрацией кисло-
рода и температурой для реакции окисления H2. Выделенная область
– это полуостров самовоспла-
менения
Рассмотрим, каким образом будет изменяться скорость ре- акции окисления H2 при температуре TA, удовлетворяющей условию TA > TM. При низких концентрациях O2 цепного само- воспламенения не будет наблюдаться, пока будет выполнять-
ся условие
C < C(1) .
O2 O2
При увеличении CO2 до значения
C = C(1) O2 O2
начнет наблюдаться самовоспламенение. Оно будет наблю- даться в интервале значений CO2 :
(1) |
< CO2 |
(2) |
, |
CO2 |
< CO2 |
т. е. пока CO2 не возрастет до значения
C = C(2) .
O2 O2
91

При значениях CO2 , удовлетворяющих условию
C > C(2) ,
O2 O2
самовоспламенения вновь не будет наблюдаться.
В. Нижний предел в кинетической и диффузионной области
Согласно данным разд. 7.1.3, реакция обрыва цепи на стен- ке состоит из двух стадий – диффузии активного центра к по- верхности стенки и его реакции с какой-либо функциональной группой поверхности стенки. Если лимитирующей стадией об- рыва на стенке является диффузия, то такой обрыв называют
обрывом на стенке в диффузионной области.
Если лимитирующей стадией обрыва на стенке является реакция с функциональной группой поверхности, то такой об-
рыв называют обрывом на стенке в кинетической области.
Если скорости стадий реакции обрыва соизмеримы друг с другом, то такой обрыв называют обрывом на стенке в сме-
шанной области.
Для реакции окисления H2 при обрыве на стенке в диффу-
зионной области
k4 = aL×2D ,
где D – коэффициент диффузии активного центра; L – харак- теристический размер реакционного сосуда; a – коэффициент, величина которого зависит от формы сосуда (см. разд. 7.1.3). При этом условие нижнего предела по концентрации O2 имеет
вид
|
(1) |
k4 |
|
a×D |
|
|
||
|
CO |
= |
|
= |
|
|
. |
(7.53) |
|
2 k2 |
2 |
×k2 |
|||||
|
|
2 |
|
|
|
|||
|
|
|
|
2 L |
|
|
||
Поскольку D ~ 1/ P , где P – общее давление в системе, то |
||||||||
(1) |
, т. е. критическая концентрация O2, |
соответствующая |
||||||
CO2 |
||||||||
нижнему пределу, будет уменьшаться при добавлении в сис-
92
тему инертных газов. Видно также, что критическая концен-
трация C(1) зависит от a, т. е. от формы реакционного сосуда.
O2
Для реакции окисления H2 при обрыве в кинетическом ре-
жиме
|
|
e × |
|
|
|
S |
, |
|
|
|
|
|
|
k4 = |
u |
|
× |
|
|
|
|||||||
4 |
|
|
|
|
|
|
|||||||
|
|
|
V |
|
|
|
|||||||
и условие нижнего предела самовоспламенения имеет вид |
|||||||||||||
|
|
k4 |
|
|
|
e × |
|
× S |
|
|
|
||
(1) |
|
|
|
u |
|
|
|
||||||
CO2 = |
|
|
|
= |
|
|
|
|
|
. |
|
(7.54) |
|
2 k2 |
|
8 V ×k2 |
|
||||||||||
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
(1) |
, |
соответствую- |
Видно, что критическая концентрация CO2 |
|||||||||||||
щая нижнему пределу, в этом случае зависит не только от формы реакционного сосуда (через соотношение S/V), но и от материала, из которого изготовлен сосуд (через параметр e).
§ 7.3. Цепные реакции с вырожденным разветвлением
Вырожденным разветвлением цепей называется образова-
ние свободных радикалов при распаде достаточно стабильных продуктов цепной реакции. По механизму цепных реакций с вырожденным разветвлением протекает, например, окисление многих углеводородов кислородом.
Кинетика окисления углеводородов описывается следую- щей схемой:
|
∙ ∙ |
0. RH + O2 |
Wo |
¾¾¾® R + HO2 |
|
∙ |
∙ |
k
1. R + O2 ¾¾1 ® RO2
∙k
2.RO2 + RH ¾¾¾2 ® ROOH
∙k
3.RO2 ¾¾3 ® гибель
|
– реакция зарождения |
|
цепи; |
ü |
|
ï |
– реакция продолжения |
∙ ý |
|
+ Rï |
цепи; |
þ |
|
|
– реакция обрыва цепи. |
Это типичный механизм неразветвленной цепной реакции. В качестве реакции обрыва цепи рассматривается гибель толь-
93
∙ |
|
|
ко радикалов RO2 |
, так как k1 >> k2, и поэтому C ∙ |
>> C ∙ . Та- |
|
RO2 |
R |
ким образом, активным центром, лимитирующим развитие це-
∙
пи, является радикал RO2 . Для конкретности мы приняли, что
∙
гибель радикалов RO2 является линейной, хотя, в принципе,
она может быть и квадратичной. Принципиального различия в явлениях, наблюдаемых для рассматриваемой реакции для случаев линейной и нелинейной гибели, нет, поэтому мы огра- ничимся рассмотрением лишь случая линейной гибели.
Характерной особенностью рассматриваемой реакции яв- ляется то, что продукт реакции ROOH способен распадаться на два свободных радикала:
k ∙ ∙
4. ROOH ¾¾4 ® RO + OH.
При этом существенно, что константа скорости k4 достаточно велика, т. е.
k4 >> ko ×CO2 .
Поэтому накопления ROOH даже в небольших количествах достаточно, чтобы вклад реакции 4 в образование свободных радикалов стал превосходить вклад реакции 0.
∙ ∙
Образующиеся в реакции 4 свободные радикалы RO и OH очень активны и быстро вступают в реакции с исходным ве- ществом:
|
∙ |
∙ |
5. |
|
k5 |
R O + RH ¾¾® ROH + R; |
||
|
∙ |
∙ |
6. |
|
k6 |
OH + RH ¾¾® H2O + R. |
||
∙
Образовавшиеся радикалы R тут же вовлекаются в реакцию 1.
Рассмотрим поведение системы на небольших глубинах превращения, где расходом исходного углеводорода RH мож- но пренебречь, а скорость образования ROOH по реакции 2 намного превосходит скорость ее расхода по реакции 4.
94
Применим метод квазистационарных концентраций:
|
|
|
dC∙ |
dC ∙ |
|
|
|
|
dC ∙ |
|
|
|
|
|
||||||
|
|
|
|
R |
= |
|
|
RO |
|
= |
OH |
|
= 0 ; |
|
|
(7.55) |
||||
|
|
|
|
|
|
|
dt |
|
|
|||||||||||
|
|
|
dt |
|
dt |
|
|
|
|
|
|
|
|
|
||||||
|
dC ∙ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
0 ¹ |
|
R O2 |
= W |
|
+ 2 k |
4 |
× C |
- k |
3 |
× C |
∙ . |
(7.56) |
||||||||
|
|
|
||||||||||||||||||
|
|
dt |
o |
|
|
|
|
|
ROOH |
|
R O2 |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Необходимо также учесть уравнение для CROOH : |
|
|
||||||||||||||||||
|
|
dCROOH |
= k |
|
×C |
∙ × C . |
|
|
|
|
||||||||||
|
|
|
|
|
|
|
2 |
|
|
|
|
|||||||||
|
|
|
dt |
|
|
|
|
|
|
|
RH |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
R O2 |
|
|
|
|
|
||||||
Итак, имеем систему двух линейных дифференциальных уравнений первого порядка с постоянными коэффициентами.
Составим характеристическое уравнение
|
|
- (k3 + l) 2 k4 |
|
= 0 |
|
|
|||||||||||
|
|
|
|
|
|||||||||||||
|
|
|
k |
C |
RH |
|
- l |
|
|
|
|
||||||
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
ß |
|
|
|
|
|
|
|
|
|||
(k3 + l)× l - 2 k2 ×k4 ×CRH = 0, |
|||||||||||||||||
|
|
|
|
|
|
ß |
|
|
|
|
|
|
|
|
|||
l2 + k |
3 |
× l - 2 k |
2 |
×k |
4 |
× C = 0, |
|||||||||||
|
|
|
|
|
|
|
|
|
|
RH |
|
|
|||||
|
|
|
|
|
|
ß |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
k |
3 |
|
|
|
k2 |
|
|
|
|
|
|
|
|
|
|
l = - |
|
|
± |
|
|
3 |
+ 2 k |
2 |
×k |
4 |
×C . |
||||||
|
|
|
|
||||||||||||||
1,2 |
|
2 |
|
4 |
|
|
|
|
|
RH |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Ищем решение в виде
C ∙ = A × eλ1t + B × eλ2t ,
RO2
где A и B – постоянные интегрирования.
Из условия
C ∙ = 0 при t = 0
R O2
находим, что B = − A . Тогда
95

C ∙ = A × {1- e(λ1 −λ2 )t }× eλ1t .
RO2
Чтобы оценить l1 и l2 , рассмотрим отношения членов, стоя- щих под корнем выражения для l1 и l2 :
8 k2k4CRH = 8 × k4 × k2CRH = 8 × k4 × n . |
|||
k32 |
k3 |
k3 |
k3 |
В реакции окисления углеводородов длина цепей ν обычно невелика и равняется 10–100 звеньям.
Реакция 3 безактивационная, а реакция 4 имеет большую энергию активации E4 » D (RO - OH) » 160 кДж/моль. По-
этому, как показали эксперименты,
8 × k4 × n << 1. k3
В этих условиях выражение под корнем в формулах для l1,2 можно разложить в ряд, ограничившись первыми двумя
членами
|
k2 |
|
|
|
|
|
|
k |
3 |
|
é |
|
|
1 |
|
8 k |
2 |
×k |
4 |
× C |
ù |
|
|
3 |
+ 2 k |
2 |
×k |
4 |
× C = |
|
× |
ê |
1 |
+ |
|
× |
|
|
RH |
ú |
= |
||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
4 |
|
|
RH |
2 |
|
|
|
2 |
|
|
|
k |
32 |
|
|
||||||
|
|
|
|
|
|
|
|
ë |
|
|
|
|
|
|
û |
|
||||||
=k23 × éê 1+ 4 × kk4 × nùú
ë3 û
При этом |
|
|
|
|
|
|
l1 |
= - |
k3 |
+ |
k3 |
+ 2 k4 × n = 2 k4 × n |
|
|
|
|
||||
|
2 |
2 |
|
|
||
|
|
|
|
l2 = - k3 |
|
|
и |
|
|
|
|
|
|
|
C ∙ |
= A × {1- e−k3 t }× e2k4 νt . |
(7.57) |
|||
|
RO2 |
|
|
|
|
|
96
