
Замараев - часть 3
.pdf
Если в этом выражении для kэф хотя бы один из членов
kH2O ×CH2O , kAH ×CAH |
и kA − × CA− существен (т. е. превосходит |
|
сумму членов (kH3O+ |
×CH3O+ + kOH− ×COH− ) или соизмерим с ней), |
|
то говорят об общем кислотно-основном катализе. |
||
Если же в выражении |
(6.27) для kэф преобладают члены |
|
kH3O+ × CH3O+ и kOH− ×COH− , |
то говорят о специфическом ки- |
|
слотно-основном катализе.
Проанализируем в качестве примера, в каких случаях ,ренстедовский кислотный катализ слабой кислотой AH бу- дет описываться уравнениями, характерными для общего или специфического кислотного катализа.
Рассмотрим кислотно-каталитическую реакцию
|
|
|
|
|
|
|
S1 + S2 |
¾¾® P1 + P2 , |
(6.28) |
|||
состоящую из последовательности стадий: |
|
|||||||||||
1) S1 + AH |
|
|
|
k1 |
|
S H+ |
+ A− |
– стадия протонирования |
||||
|
|
|
|
|
|
|||||||
|
|
|
|
|
k–1 |
1 |
|
|
субстрата; |
|
||
|
|
|
|
|
|
|
|
|
||||
2) S H+ + S |
|
|
|
k2 |
|
P H+ |
+ P |
|
– стадия образования |
|
||
2 |
|
|
|
|
|
|
|
|||||
1 |
|
|
|
k–2 |
2 |
1 |
протонированного продукта; |
|||||
|
|
|
|
|
|
|
|
|||||
3) P H+ |
+ A− |
|
k3 |
|
P2 + AH |
|
– стадия депротонирования |
|||||
|
|
|
|
|
||||||||
|
|
|
|
|
||||||||
2 |
|
|
|
|
k–3 |
|
|
|
продукта |
|
||
|
|
|
|
|
|
|
|
|
||||
или |
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
k4 |
|
|
|
+ |
|
|
|
4) P2H |
+ H2 |
|
|
|
|
P2 + H3O |
|
|
|
|||
|
k–4 |
|
– стадия депротонирования |
|||||||||
5) H O+ + A− |
|
|
k5 |
|
|
AH + H2O |
||||||
|
|
|
продукта |
|
||||||||
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|||||||
3 |
|
|
|
|
k–5 |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|||
Совокупность стадий 4, 5 и стадия 3 представляют собой два различных маршрута регенерации исходной формы ката- лизатора – частицы AH.
Рассмотрим теперь, каковы будут кинетические уравнения в случаях, когда лимитирующими будут разные стадии.
28
1. Пусть наиболее медленной, т. е. лимитирующей, являет- ся первая стадия – образование частицы S1H+. В этом случае
W = |
dCP1 |
= |
dCP2 |
= W = k |
1 |
× C |
S |
× C |
AH |
. |
(6.29) |
|
|
||||||||||
|
dt |
|
dt |
1 |
|
1 |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
Имеем пример общего кислотного катализа.
2. Пусть концентрация S1H+ близка к равновесной, а лими- тирующей является стадия 2. В этом случае
W = W = k |
2 |
× C |
+ × C |
= k |
2 |
×K(1) |
× |
CS1× CAH |
×C |
. (6.30) |
|
||||||||||
2 |
S H |
S2 |
|
равн |
|
CA− |
S2 |
|||
|
|
1 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
Для равновесного протолитического взаимодействия ката-
лизатора с растворителем
AH + H2O 
 A– + H3O+
A– + H3O+
имеем
|
|
|
|
|
|
|
|
|
CH3O+ × CA |
− |
= Ka |
, |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
CAH |
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
(активность воды aH2O =1 по определению) |
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
ß |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CAH |
|
|
|
CH O+ |
|
, |
|
|
(6.31) |
||
|
|
|
|
|
|
|
|
|
|
|
CA− = |
|
|
Ka |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
Тогда из соотношений (6.30) и (6.31) имеем |
|
|
|
|||||||||||||||||||
W = k |
2 |
×K(1) ×C |
S1 |
× |
C |
AH |
×C |
S2 |
= |
k2 |
×Kравн(1) |
|
× C |
+ ×C |
×C |
. (6.32) |
||||||
|
|
|
|
|
|
|
|
|||||||||||||||
|
равн |
|
C |
A |
− |
|
|
|
K |
|
H3O |
S1 |
|
S2 |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
142a43 |
|
|
|
|
||||||
kэф
Как видим, W ~ CH3O+ и не зависит в явном виде от CAH. Имеем пример специфического кислотного катализа.
3. Пусть стадии 1 и 2 проходят настолько быстро, что кон- центрация промежуточного вещества P2H+ близка к равно- весной. Лимитирует регенерация катализатора по реакции 3.
В этом случае
29

|
|
|
|
W = W3 = k3 × CP2H+ × CA− . |
(6.33) |
|||||||||||||||||
Учтем, что |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
|
= Kравн(2) |
× |
|
CS H+ ×CS |
2 |
|
, |
|
|
|
|||||||
|
|
|
+ |
|
|
|
|
1 |
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
CP |
|
|
|
|
|
|
|||||||||
|
|
|
|
P2H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
C |
S1H |
+ |
= K(1) |
|
× |
CS1 ×CAH |
|
|
, |
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
равн |
|
|
|
CA− |
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
ß |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
P2H |
+ |
= K(1) |
×K(2) |
× |
CS1 × CS2 ×CAH |
. |
(6.34) |
|||||||||||||
|
|
|||||||||||||||||||||
|
|
|
|
|
|
равн |
|
равн |
|
CP1 |
×CA− |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Тогда получим |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
W = k3 |
× C |
|
+ × C |
|
− = |
k3 ×Kравн(1) ×Kравн(2) × |
CS1 × CS2 |
× CAH ,(6.35) |
||||||||||||||
|
|
CP |
||||||||||||||||||||
|
P2H |
|
|
|
A |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
т. е. имеем пример общего катализа.
4. То же, что в случае 3, но лимитирующая стадия регене- рации катализатора идет через последовательность из мед- ленной реакции 4 и быстрой равновесной реакции 5, а не по реакции 3. В этом случае
W = W4 |
= k4 ×CP H+ × CH2O ; |
(6.36) |
||||
|
|
|
2 |
|
|
|
C |
+ = K(1) |
×K(2) |
× |
CS1 ×CS2 × CAH |
. |
(6.34) |
|
||||||
P2H |
равн |
равн |
|
CP1× CA− |
|
|
|
|
|
|
|
||
Но, согласно соотношению (6.31),
CAH = CH3O+ .
CA− Ka
Поэтому
|
K(1) |
×K(2) |
C |
× C |
S2 |
|
|
|
|
W = k4 × |
равн |
равн |
× |
|
S1 |
×C |
+ . |
(6.35) |
|
|
|
|
CP |
|
|||||
|
Ka |
|
|
H3O |
|
|
|||
|
|
|
|
|
1 |
|
|
|
|
30

Как видим, изменение маршрута регенерации катализато-
ра привело к кинетической закономерности специфического катализа.
Таким образом, для одного и того же механизма реакции могут наблюдаться кинетические закономерности, свойствен- ные как общему, так и специфическому катализу, в зависи- мости от того, какая из стадий реакции является лимитирую- щей.
6.5.3.2. Катализ в сильнокислых средах
Рассмотрим кислотно-каталитическую реакцию
S ¾¾AH ® P ,
протекающую в сильнокислой среде по механизму
|
|
|
K1 |
+ |
– |
|
|
S + AH |
|
|
|
SH + A |
|
(быстро), |
|
|
|
|
|||||
k2 |
|
|
|||||
SH+ |
|
|
PH+ |
|
|
||
PH+ + A– |
|
k3 |
|
P + AH |
|
(быстро). |
|
|
|
|
|
||||
Стадия протонирования, как правило, быстрая, поэтому обе формы субстрата находятся в равновесии. Лимитирует
реакцию необратимая стадия превращения протонированной формы субстрата.
Следуя формализму § 5.4, запишем выражение для скоро-
сти реакции
W = W = k |
× |
aSH+ |
, |
|
|||
2 2 |
|
f ¹ |
|
|
2 |
|
|
где через f2¹ обозначен коэффициент активности активиро-
ванного комплекса второй стадии.
Полагая, что строение и распределение заряда в активи- рованном комплексе для стадии 2 близки к таковым для SH+, можно принять, что
f2¹ = fSH+ .
Тогда
31

W = k |
2 |
× |
fSH+ ×CSH+ |
= k |
2 |
× C |
|
+ |
(6.37) |
|
f ¹ |
SH |
|||||||||
|
|
|
|
|
|
|||||
|
|
2 |
|
|
|
|
|
|
||
Концентрацию субстрата в протонированной форме можно выразить через параметры среды. Действительно, поскольку катализатор (кислота) находится в равновесии с растворите- лем (водой)
H2O + AH |
Ka |
H3O+ + A–, |
|
можно найти отношение концентраций протонированной и исходной форм субстрата
|
CSH+ |
|
= |
|
fS |
|
× |
aSH+ |
= |
|
fS |
|
×K |
1 |
× |
aAH |
= |
|
|||||||||||||||||
|
C |
f |
|
|
|
|
|
f |
|
|
|
|
|||||||||||||||||||||||
|
|
|
+ |
|
|
|
a |
S |
|
|
|
|
+ |
|
|
|
|
a |
A |
− |
|
|
|
||||||||||||
|
S |
|
|
|
SH |
|
|
|
|
|
|
|
|
|
|
SH |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
K |
1 |
|
|
f |
|
|
|
|
|
aH |
O+ |
|
|
|
|
|
|
aH |
3 |
O+ |
|
|
|
||||||||
= |
|
|
|
× |
|
S |
|
|
× |
|
3 |
|
|
= K |
b |
× |
|
|
|
|
|
, |
(6.38) |
||||||||||||
|
K |
|
f |
|
|
a |
|
|
a |
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
a |
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
SH |
|
|
|
|
|
|
H2O |
|
|
|
|
|
|
|
H2O |
|
|
|
|||||||||||
где Kb – константа равновесия для реакции |
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
S + H3O+ |
|
|
|
Kb |
|
|
|
SH+ + H2O. |
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
Экспериментально показано, что отношение коэффициен-
тов активности |
fS |
|
определяется главным образом концен- |
f |
+ |
||
|
SH |
|
|
трацией и количеством кислоты и почти не зависит от типа субстрата. Поэтому в качестве характеристики среды исполь-
зуют кислотность по Гаммету
|
f |
|
aH |
O+ |
, |
(6.39) |
h = |
S |
× |
3 |
|
||
|
|
|
||||
0 |
fSH+ |
|
aH2O |
|
|
|
|
|
|
|
|||
которую можно определить независимо, например по степени протонированности индикаторного основания.
Подставляя выражения (6.38) и (6.39) в уравнение массо-
баланса
C(0)S = CS + CSH+ ,
32

находим |
|
|
|
|
|
|
|
|
|
|
K |
×h |
o |
× C(0) |
|
C |
SH |
+ = |
b |
|
S |
. |
|
|
|
|
|
||||
|
|
1+ Kb×ho |
|||||
|
|
|
|||||
Таким образом, скорость реакции (6.37) выражается через
кислотность среды и константу основности субстрата как
|
|
Kb×ho |
|
×CS(0) |
|
(0) |
|
|
|||||||
|
W = k2 |
|
|
|
|
|
|
|
|
|
= kэф ×CS |
, |
(6.40) |
||
|
1+ K |
b |
×h |
|
|||||||||||
|
|
|
|
|
|
|
o |
|
|
|
|
||||
где |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
kэф |
= |
k2 ×Kb×ho |
. |
|
|
|
||||||||
|
1+ Kb×ho |
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
||||||||
Если Kb×ho << 1, то протонизация субстрата S мала и |
|
||||||||||||||
|
W |
= K |
B |
× k |
2 |
× h |
×C(0) |
, |
|
(6.41) |
|||||
|
кат |
|
|
|
|
|
o |
S |
|
|
|
||||
т. е. Wкат прямо пропорциональна функции кислотности.
В обратном случае Kb×ho >> 1 практически весь субстрат
находится в протонированной форме и скорость реакции дос-
тигает предельного значения
(W ) |
= k |
2 |
×C(0) . |
(6.42) |
кат max |
|
S |
|
6.5.4. Катализ кислотами Льюиса
Классический пример катализа кислотами Льюиса – реак- ции Фриделя–Крафтса. Например:
C6H6 + RCl ¾¾kнабл¾® C6H5R + HCl ,
протекающие в присутствии AlCl3.
Эта реакция протекает по следующему механизму:
1) |
RCl + ACl3 |
|
быстро |
|
|
R+ × |
AlCl4− |
|
|
|
R+ + AlCl4− ; |
|||
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
||||||
2) |
С6H6 + R+ |
медленно |
|
|
[C6H6R]+; |
|
|
|
|
|||||
3) |
[C6H6R]+ + AlCl4− |
|
быстро |
|
C6H6R + HCl + AlCl3. |
|||||||||
|
|
|
|
|
||||||||||
|
|
|
|
|
||||||||||
33
Как показали эксперименты, уравнение для скорости реак-
ции имеет вид
W = kнабл× CC6H6 ×CRCl× CAlCl3 , |
(6.43) |
где kнабл включает константу равновесия стадии 1 и константу скорости стадии 2.
6.5.5. Механизмы катализа комплексами металлов
Причины активации молекул реагентов при их координации к комплексам металлов были рассмотрены в п. 8 § 5.2. Типич- ными (хотя и не единственно возможными) являются меха- низмы каталитических циклов, состоящие из последо- вательности реакций окислительного присоединения реаген- тов к катализатору, внедрения фрагментов реагентов по свя- зи металл–лиганд и восстановительного элиминирования продуктов реакции.
Примеры
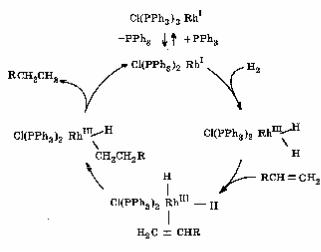
1. Каталитическое гидрирование олефинов (рис. 6.5).
Рис. 6.5. Ката-
литический цикл реакции гидриро-
вания олефинов
34
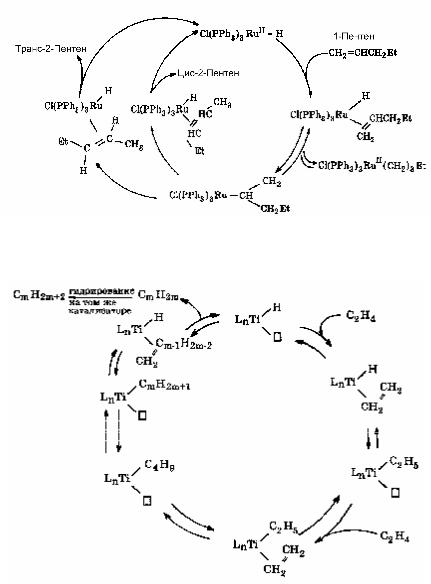
2. Каталитическая изомеризация олефинов (рис. 6.6).
Рис. 6.6. Каталитический цикл реакции изомеризации олефинов
3. Полимеризация олефинов (рис. 6.7).
Рис. 6.7. Каталитический цикл реакции полимеризации олефинов
35
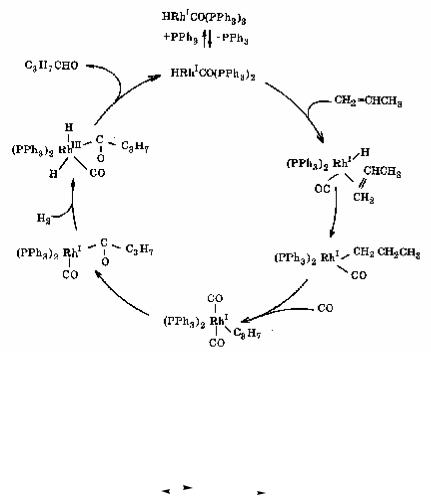
4. Гидроформилирование олефинов (рис. 6.8).
Рис. 6.8. Каталитический цикл реакции гидроформилирования олефинов
6.5.6. Катализ ферментами. Схема Михаэлиса– Ментен
Катализ ферментами можно описать следующей простей- шей схемой, предложенной Михаэлисом и Ментен:
|
|
k1 |
|
|
k2 |
|
E + S |
|
|
ES |
E + P. |
||
k–1 |
|
|||||
|
||||||
В этой схеме E – фермент; S – субстрат; ES – фермент- субстратный комплекс. Эта схема уже была рассмотрена на- ми выше (см. разд. 6.5.2, случай 2). Применяя метод стацио-
нарных концентраций и учитывая уравнение материального баланса
36
|
|
|
C(0) = C |
+ C |
|
, |
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
E |
|
|
|
E |
|
|
ES |
|
|
|
|
|
|
|
|
|
|
|
получаем уравнение |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
dC |
k |
2 |
×C(0) ×C |
S |
|
|
V ×C |
S |
|
|
|
||||||||||
W = |
|
|
P |
= |
|
|
|
E |
|
|
= |
|
|
|
|
|
, |
(6.44) |
||||
|
|
|
|
K |
|
+ C |
|
|
|
K |
|
+ C |
|
|||||||||
|
|
dt |
|
m |
S |
|
|
|
|
m |
S |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
где |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V = k |
2 |
× C(0) , |
|
|
K |
m |
= k−1 + k2 |
|
|
|
|
|||||||||||
|
|
|
E |
|
|
|
|
|
|
|
|
|
k1 |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
– константа Михаэлиса.
Константа k2, характеризующая скорость превращения комплекса ES в продукт реакции P, изменяется в широких пределах, в зависимости от природы фермента и субстрата. Например, при комнатной температуре для пепсина, расщеп-
ляющего пептидную связь
R
R1 C NH CO R2, k2 » 10–3 c–1,
CO R2, k2 » 10–3 c–1,
H
а для каталазы, разлагающей H2O2, k2 » 106 c–1 .
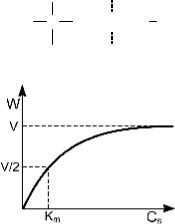
На рис. 6.9 приведена за- висимость между W и CS, которая следует из уравне- ния Михаэлиса–Ментен
При CS >> Km скорость
достигает максимального
Рис. 6.9. Зависимость между скоро- стью ферментативной реакции и кон- центрацией субстрата, которая сле- дует из уравнения Михаэлиса–
Ментен
W =
значения W = V = k2 ×C(E0) .
В этих условиях весь фер-
мент находится в форме комплекса ES и дальнейшее увеличение CS уже не мо- жет увеличить W.
При CS = Km получаем
V / 2.
37
